ИНТРАТЕКАЛЬНАЯ ТЕРАПИЯ ПРИ ОСТРОЙ ЛИМФОБЛАСТНОЙ ЛЕЙКЕМИИ И НЕЙРОЛЕЙКЕМИИ У ДЕТЕЙ
Aннотация
Интратекальная терапия (ИТТ), появившаяся в начале эволюции терапии лейкемий как дополнительный лечебный и профилактический подход при ведении больных с острой лимфобластной лейкемией (ОЛЛ) и нейролейкемией (НЛ), в настоящее время представляет надежную лечебную опцию, которая позволяет заменять краниальное облучение даже у пациентов с высоким риском острой лимфобластной лейкемии (ОЛЛ) и нейролейкемии (НЛ), высокоэффективно купировать любую НЛ-инициальную (ИНЛ), доклиническую (ДНЛ), клиническую (КНЛ), что позволяет предотвращать кумулятивные риски развития не только НЛ, но и костномозговых рецидивов, так как известно, что НЛ-рецидив обычно предшествует костномозговому рецидиву. Любая протокольная терапия включает элементы ИТТ, которые хорошо санируют ликвор, высоко-результативно улучшают выживаемость детей. Только 2,4% – встречаемость НЛ на оригинальных немецких и других международных протоколах. Были использованы все рекомендации немецкого протокола BFM, в том числе относительно цитоза, статуса ЦНС, рисков и т.д. Исследованные показатели (концентрации общего белка-ОБ, альбумина-А и глобулинов-Г, суммарного α-аминоазота-Ам и отдельных нейроактивных аминокислот (глутаминовой кислоты-ГлуК и глутамина-Глу) в ЦСЖ и сыворотке крови, N-ацетилнейраминовой кислоты –НАНК в ЦСЖ, а также концентрационные градиенты ЦСЖ/ сыворотка крови для А, Ам, ГлуК и Глу в различные периоды ОЛЛ и НЛ оказались равноценны исследованиям с радиоактивными веществами и нейронспецифическими белками, что позволяет предложить эту панель биомаркеров в педиатрическую практику. Для более широкого использования результатов данного исследования можно рекомендовать НАНК как предиктор НЛ и для ранней диагностики НЛ, течения оккультной – ОНЛ и всех других видов НЛ, Ам, ГлуК и Глу – для определения токсического фактора, нейротоксичности, ОБ, А, Г – для первоначального обозначения белкового профиля ЦСЖ. Концентрационные градиенты в динамике наблюдения могут определить возможное течение НЛ (с исходом в ремиссию, затяжное, с летальным исходом).
Ключевые слова: интратекальная терапия, гематоэнцефалический барьер, цереброспинальная жидкость, острая лимфобластная лейкемия, нейролейкемия, дети
Введение. Острая лимфобластная лейкемия (ОЛЛ) на сегодня самая распространенная неопластическая патология системы крови у детей (75% – от всех гемобластозов у детей), при которой возможна 70% летальность [4]. Заболеваемость ОЛЛ в настоящее время составляет 30–40 случаев на 1 млн. населения в год, 3,2-4,7 на 100 000 детского населения [5].
Современное протокольное лечение на основе немецкого протокола BFM дало возможность получения длительных ремиссий и практического выздоровления таких детей, однако высокодозовость может иметь много неблагоприятных последствий на детский организм [3].
Интратекальная терапия (ИТТ), применяемая у детей с острой лимфобластной лейкемией (ОЛЛ) и нейролейкемией (НЛ), – важная лечебно-профилактическая опция, которая позволяет не только заменять краниальное облучение, но и даже отказаться от него в силу большой токсичности и развития грозных осложнений, даже у пациентов с высоким риском ОЛЛ и НЛ, высокоэффективно купировать любую НЛ – инициальную (ИНЛ), доклиническую (ДНЛ), клиническую (КНЛ), что позволяет предотвращать кумулятивные риски развития не только НЛ (cumulative incidence of relapse CIR-NL), но и костномозговых рецидивов [3, 36], а также нежелательные опасные побочные эффекты. Любая протокольная терапия включает элементы ИТТ, которые высоко результативно улучшают выживаемость детей, надо только подобрать дозу и частоту введения лекарств. Встречаемость НЛ в оригинальных немецких и других международных протоколах только 2.4%. В 60-е годы прошлого века после возможности получения первой полной ремиссии НЛ стали основной проблемой выживаемости детей. ИТТ стала совершенствоваться: вместо 1 (Mtx) препарата (1ИТ) стали применяться их комбинации – в основном 2 (2ИТ) (Mtx+ara-C), в ИТТ стал включаться гормональный препарат – преднизолон, который впоследствии стал все чаще заменяться дексаметазоном. Дексаметазон стал более предпочтителен, т.к. имеет лучшие лечебные результаты при ОЛЛ, НЛ, снимает клеточный отек, стабилизирует клеточные мембраны ЦНС.
Высокие результаты выживаемости, полученные при лечении по международному немецкому протоколу BFM, применяемого в России и сопоставимые с данными зарубежных исследований, позволили ряду ученых создавать новые модифицированные российские протоколы, которые имеют не меньший успех по результативности. Благодаря применению протоколов ALL-MB-2002, 2008 и др. выживаемость детей с ОЛЛ в России стала более 85% [4, 20].
Ключевое значение оккультной НЛ – ОНЛ у детей предопределило столь пристальное внимание к изучаемой проблеме и ИТТ [23]. Профилактика НЛ улучшилась благодаря ее интенсификации интратекальным введением препаратов в остром периоде, консолидации и на протяжении 1 года лечения, что позволило не применять в большинстве случаев краниальное облучение, которое имеет много неблагоприятных последствий [1, 7].
Многие прогностические факторы перестали быть значимыми в эволюции лечения ОЛЛ, например, такие как иммунофенотип, однако появились новые прогностические критерии, такие как спленомегалия, ИНЛ, которые и стали основными предикторами течения заболевания [20]. Возможно, имеются маркеры прогноза и на уровне ЦСЖ, которые в дальнейшем могут быть использованы для улучшения стратегии лечения ОЛЛ и НЛ.
Литературные данные показали, что белковые соединения, в том числе характерные для нервной системы, различные ферменты, вещества, повышающиеся при иммунологических процессах, особенно гликопротеины (ГП), интерлейкины могут быть диагностическими маркерами при лейкозах [6]. Так, повышенный плеоцитоз при НЛ [27], альбумин GFA СМЖ как маркер астроцитарного вовлечения [15], основной белок миелина (ОБМ) СМЖ [28], иммунореактивный паратиреоидный гормон и кальцитонин [35], сиаловая кислота [10], общий белок СМЖ [30], повышенные количества лейкоцитов и белка СМЖ [Rautonen, 1988],компьютерная томография и прокоагулянтная активность СМЖ [32], активность аденозин деаминазы [24], лактатдегидрогеназы [11], эозинофилия [25], интерлейкин-2 [14], нейроиммунологический профиль [15], иммунореактивный бета-эндорфин [18], бета-2-микроглобулин [39], фибронектин [21], СД9 [22], карбокситерминальный препептид 1 типа проколлагена [38], бласты с низким плеоцитозом [29] были исследованы в ЦСЖ при ИТТ для определения маркеров НЛ.
Согласно литературным источникам по нейрогенезу, многие вещества ЦНС полисиализированы. Литературные источники также описывают преобладание ГП и гликолипидов в нервной ткани [8, 37]. Все они неспецифические, но в определенных случаях на них, видимо, можно ориентироваться для определения стратегии и тактики лечения заболевания.
Таким образом, для оптимизации терапии с целью повышения общей выживаемости детей с ОЛЛ и НЛ, ИТТ приобрела особое значение, и, возможно, дополнительные биохимические критерии ЦСЖ помогут в дальнейшей эволюции успешного лечения ОЛЛ, НЛ.
Цель исследования – оценка проведенной ИТТ на состояние ГЭБ и ЦСЖ по панели биомаркеров при ОЛЛ и НЛ у детей в динамике наблюдения и определение их диагностической и прогностической значимости при НЛ.
Задачи исследования:
1. Изучить показатели концентрации общего белка (ОБ), альбумина (А) и глобулинов (Гб), суммарного α-аминоазота (Ам) и отдельных нейроактивных аминокислот (глутаминовой кислоты-ГлуК и глутамина-Глу) в ЦСЖ и сыворотке крови при ОЛЛ (статус СТ-ЦНС-1): острый период, ремиссия, костномозговой рецидив) и развившейся НЛ: доклинический ДНЛ и клинический КНЛ варианты НЛ (СТ-ЦНС-3), ИНЛ – инициальной НЛ у детей (СТ-ЦНС-6)
2. На основании определения концентрационных градиентов ЦСЖ/ сыворотка крови для альбумина, суммарного α-аминоазота, глутаминовой кислоты и глутамина в различные периоды ОЛЛ (СТ-ЦНС-1: острый период, ремиссия, рецидив) и при осложнении НЛ (СТ-ЦНС -3: ДНЛ, КНЛ, СТ-ЦНС-6: ИНЛ) у детей:
- оценить проницаемость гематоэнцефа-лического барьера (ГЭБ);
- оценить динамику проницаемости ГЭБ в различные периоды ОЛЛ и при осложнении НЛ у пациентов, при ИТТ. Оценить значимость этих показателей в ранней диагностике и прогнозе НЛ, при ИТТ;
- сравнить полученные биохимические величины ЦСЖ при различных вариантах НЛ, ИТТ;
- сравнить величины биохимических параметров ЦСЖ при различных цитозах НЛ, при различных видах терапии ОЛЛ, ИТТ;
3. Оценить проведенную ИТТ: 1 (Mtx) препарат, 2 (Mtx+ara-C), с преднизолоном, с дексаметазоном.
Материалы и методы исследования. В работе представлены результаты обследования, исследования, лечения, наблюдения 103 пациентов с ОЛЛ и НЛ (в возрасте от 3 до 18 лет), которым проведена немецкая протокольная терапия BFM и стандартные курсы полихимиотерапии (ПХТ) в НЦЗД РАМН. Согласие родителей (опекунов) пациента на лечение в клинике и на настоящее исследование получено.
В качестве групп сравнения были выбраны пациенты с ремиссией ОЛЛ (53 ребенка) и НЛ (19 детей). В процессе наблюдения дети переходили из одной группы в другие по мере протекания заболевания. НЛ наблюдалась нами с разделением по вариантам: ИНЛ, ДНЛ, КНЛ. Пациенты на протокольном BFM-лечении распределялись на три группы риска –
1) стандартного риска (SRG),
2) промежуточного риска (ImRG) и 3.высокого риска (HRG) и по статусу ЦНС: ЦНС-1: острый период, ремиссия, рецидив, при НЛ – ЦНС-3: ДНЛ, КНЛ, ЦНС-6: ИНЛ у детей согласно критериям немецкого оригинального протокола.
Биохимические методы исследования. Были изучены концентрации общего белка (ОБ), альбумина (А), глобулинов (Гб), α-аминоазота (α-Ам), глутаминовой кислоты (ГлуК) и глутамина (Глу) в ЦСЖ и сыворотке крови, N-ацетилнейраминовой кислоты (NАНК) в ЦСЖ. Проницаемость ГЭБ оценивалась нами на основании вычисления концентрационных градиентов ЦСЖ/ сыворотка крови для А (КА), К α-Ам, КГлуК и КГлу. Реактивы использовались фирмы Berhinger (ФРГ), Sigma (США). Определения проведены на спектрофотометре “Atom” (Швеция), СФ-15а (Россия).
ЦСЖ брали у больных во время проведения контрольных люмбальных пункций, одновременно интратекально вводили препараты (1 – метотрексат – МТХ или в сочетании 2 – МТХ и цитозин-арабинозид – ara-C или 3 – плюс преднизолон/дексаметазон) с профилактической и лечебной целью. Венозную кровь брали натощак в день проведения люмбальных пункций из крупных магистральных сосудов или из катетера в подключичной вене перед введением препаратов.
Все определения проводились как минимум в трех параллельных пробах, средние значения были использованы для статистической обработки результатов. Определение каждого биохимического показателя проведено в динамике заболевания: в разные периоды ОЛЛ от 1 до 5 раз, при осложнении ОЛЛ НЛ – от 1 до 12 раз (1621 образец ЦСЖ, 834 образец сыворотки крови – всего 2455 образцов).
Оценка всех полученных результатов проведена в сравнении с группой детей с ОЛЛ, находящихся в ремиссии, а также с нормативами, принятыми в литературе для здоровых детей. При проведении каждой серии исследований использованы контрольные сыворотки (PrecinormS, PrecinormG, PrecinormU – Berhinger, ФРГ). Все результаты обработаны статистически на компьютере пакетом программ «Statistica».
Результаты и их обсуждение. Как до ИТТ, так и после нее, определявшиеся биохимические показатели соответствовали течению заболевания. Только развитие НЛ сопровождалось значимым увеличением этих биохимических показателей ЦСЖ. Сравнение полученных величин после различных вариантов ИТТ (1 препарат-1ИТ, 2-2ИТ, 3-3ИТ компонентной) не выявило значительных различий, что говорит об обоснованности критериев для разграничения показаний к дифференцированному назначению ИТТ. Мультикомпонентность ИТТ определяет больше эффект от лечения, несмотря на определенную токсичность (Т), так как дозировка соотнесена сейчас не с возрастом, а с площадью поверхности тела. Нейротоксичность возникает в основном в результате системного лечения, особенно высокодозового MTX лечения, что обусловило его применение в новых средне- и мало- дозовых режимах в блоках модифицированной протокольной терапии. Однако нельзя исключить нейротоксичность ИТТ и индивидуальную чувствительность. Раньше в прошлом веке после начала применения ХТ, в т.ч. ИТТ, развивались явления «химического менингизма», которые описаны в литературе и могли приводить к летальному исходу. Сегодня применяются более очищенные и новые поколения лекарственных препаратов.
Разная частота ИТТ также не выявила значительных отличий в величинах определявшихся показателей. Применение гормонов в ИТТ сопровождалось положительным клиническим эффектом во всех случаях, состояние ремиссии продолжалась дольше. Так, примером 1ИТ явилась группа острого периода на ПХТ, 2ИТ – дети с ДНЛ, 3ИТ – пациенты с КНЛ, ИНЛ, в некоторых случаях ДНЛ.
В остром периоде ОЛЛ ОБ ЦСЖ был 0.3±0.01 (0.05) г/л с разбросом min-max величин 0.25-0.74, А ЦСЖ – 0.18±0.007 (0.04) г/л с min-max 0.11-0.22, Г ЦСЖ – 0.12±0.003(0.04) г/л с min-max 0.04-0.16, в ремиссии ОБ ЦСЖ оказался на верхней границе нормы и выше, чем в начале заболевания, т.е. остром периоде – 0.46±0.02 (0.15) г/л с min-max 0.25-0.74, А ЦСЖ выше, чем в остром периоде – 0.23±0.005 (0.05) с min-max 0.13-0.26, Г ЦСЖ повышены – 0.23±0.01 (0.08) с min-max 0.12-0.45. Разброс величин, скорее всего, свидетельствует об неоднородности группы детей по биохимическим параметрам ЦСЖ.
В остром периоде ДНЛ ОБ ЦСЖ достоверно составлял 0.51±0.04(0.15) (p<0.05), в ремиссии 0.56±0.11 (0.31) (p<0.01), А ЦСЖ – 0.26±0.03 (0.09), в ремиссии 0.27±0.02 (0.05), Г ЦСЖ – 0.25±0.04 (0.14), в ремиссии 0.29±0.07 (0.02) (p<0.01). Таким образом, при ДНЛ не во всех случаях наступает полная ремиссия, не всегда быстро нормализуется проницаемость ГЭБ, а ИТС нарастает, несмотря на констатацию клинической ремиссии.
Ам был 2.23±0.34 (0.8), в ремиссии 1.9±0.19 (0.5), подостром периоде 2.7±0.05 (1.0) (p<0.01) – характеризуя, видимо, нейротоксичность на уровне ЦНС, ГлуК ЦСЖ 78.7±8.42 (24.7) (p<0.05), в ремиссии 32.1±13.4 (23.3), Глу ЦСЖ 656.2±9.3 (92.3), в ремиссии 563.5±42.0 (72.7), НАНК ЦСЖ 66.2±5.2 (11.7) (p<0.01), в ремиссии 40.3±3.5 (6.1), в отдельных случаях с размахом до
82.0 мг/л, не констатируя ремиссию, хотя общепринятый анализ ЦСЖ соответствовал ремиссии по данным цитоза, Г 0.26±0.03 (0.15) (p<0.05), в ремиссии 0.11±0.02(0.05), достоверно повышаясь более чем в 2 раза, т. е. при 2-ИТ не всегда и не у всех пациентов происходит снижение и нормализация ОБ ЦСЖ. Наоборот, даже повышается почти в 2 раза при нормализации цитоза. Цитоз не всегда может отражать ремиссию. Однако, в подостром периоде, который выделен нами впервые, ОБ-А ЦСЖ повышается в отдельных случаях, видимо, как эквивалент нейротоксичности на биохимическом уровне без клиники и, возможно, при разрушении бластов. Видимо этим объясняются такие случае, когда ЦСЖ санировалась быстро, ИТТ поэтому короткая (1-2 ИТ) ИТТ, но НЛ возвращается вновь и быстро. Конечно, бывают случаи, когда ЦСЖ санируется быстро и ремиссия продолжается долго до развития общего рецидива. Как правило, развивается и встречается комбинированный рецидив.
Резервуар Оммайя – очень сложный и травматичный метод лечения для пациентов с НЛ и поэтому не всегда может быть использован в широкой педиатрической практике.
Только ГлуК острого периода была выше нормы на фоне проводимого лечения.
При КНЛ острый период имел достоверно повышенный ОБ-ЦСЖ 0.73±0.05 (0.17) (p<0.001), который снижался практически до нормы в ремиссии 0.27±0.02 (0.15), А-ЦСЖ также снижался с острого периода к ремиссии – 0.31±0.02 (0.08) (p<0.05), в ремиссии 0.26±0.02 (0.06), Г ЦСЖ были очень высокими 0.42±0.05 (0.17) (p<0.01), но на фоне проводимого лечения, в том числе 3ИТТ в ремиссии снижались до нормы 0.17±0.02 (0.05), Ам ЦСЖ был 4.4±0.5 (1.7) (p<0.001), в ремиссии 2.3±0.2 (0.8) – нормализовался также, в подостром периоде у отдельных пациентов повышаясь до 6.03 – видимо, характеризуя нейротоксичность на уровне ЦНС, ГлуК ЦСЖ острого периода была 95.2±12.6 (30.4) (p<0.001), в ремиссии 152.32, Глу ЦСЖ острого периода 717.0±50.9 (160.8) (p<0.01), в ремиссии 291.5, НАНК ЦСЖ острого периода был достоверно высокий 111.5±13.1 (22.7) (p<0.001), в ремиссии 52.5±1.2 (2.0), в отдельных случаях снижаясь только до 121.8 мг/л, не констатируя ремиссии, хотя общепринятый анализ ЦСЖ соответствовал ремиссии по данным цитоза, Г были достоверно повышены 0.26±0.03 (0.15) (p<0.05), в ремиссии снижаясь до нормы на фоне лечения 0.11±0.02 (0.05), что говорит об эффективности ИТТ, даже в случаях КНЛ и о состоянии относительной иммунодепрессии на уровне ЦНС. Т.е. 3-ИТ всегда и у всех пациентов нормализует белковые величины ЦСЖ, практически всегда достигая клинико-лабораторной ремиссии на уровне ЦНС.
При ИНЛ острый период имел самый высокий ОБ ЦСЖ 1.0±0.05 (0.16) (p<0.01), который снижался более чем в 2 раза и практически только до верхних границ нормы в ремиссии 0.41±0.05 (0.1), А ЦСЖ острого периода был повышен, характеризуя начальные изменения проницаемости ГЭБ 0.36±0.02 (0.05), лишь с тенденцией к снижению в ремиссии 0.3±0.04 (0.1), Г-ЦСЖ были достоверно увеличены, косвенно свидетельствуя об интратекальном синтезе (ИТС) – 0.26±0.03 (0.15) (p<0.05), в ремиссии снижаясь до минимальных величин, которые отражают иммуносупрессию на фоне протокольной терапии – 0.11±0.02 (0.05), Ам ЦСЖ 1.83±0.2 (0.5), в ремиссии достоверно нарастал – 3.7±0.5 (1.1) (p<0.001) (несмотря на нормальный цитоз, свидетельствующий о ремиссии, высокодозовость первого протокола отражается на биохимических величинах ЦСЖ, характеризуя нейротоксичность, в подостром периоде также достоверно высокий уровень 3.1±0.2 (0.5) (p<0.001) – характеризуя нейротоксичность на уровне ЦНС, что, возможно, еще раз подтверждает необходимость и обоснованность сопроводительной терапии с самого начала I протокола, возможно, указывает на необходимость в сопроводительной терапии дезинтоксикационного лечения –перорально или инфузионно), НАНК ЦСЖ максимально высокий из всех НЛ – 173.6±6.4 (9.0) (p<0.001), в ремиссии снижаясь практически в 3 раза, но все равно оставаясь выше верхней границы нормы более чем в 2 раза – 67.0±31.0 (43.8), в отдельных случаях до 98.0 мг/л (выше верхней границы нормы более чем в 3 раза), не констатируя ремиссии, хотя общепринятый анализ ЦСЖ соответствовал ремиссии по данным цитоза и др. (рис.1, 2), НАНК ЦСЖ статистически достоверный признак НЛ, полезный маркер в случаях малого цитоза при инициальной НЛ, без клинических проявлений доклинического НЛ).
Г ЦСЖ были достоверно увеличены более чем в 2 раза, свидетельствуя об ИТС – 0.26±0.03 (0.15) (p<0.05), в ремиссии резко снижаясь на фоне иммуносупрессивной терапии 0.11±0.02 (0.05), т.е. 3-ИТ практически у большинства пациентов снижает повышенные биохимические величины ЦСЖ. На На основании вышеизложенного, I протокол (высокодозовый, мультимодальный) действительно эффективно подавляют опухолевый клон. Наступает состояние иммуносупрессии на всех уровнях, в т.ч. ЦНС.
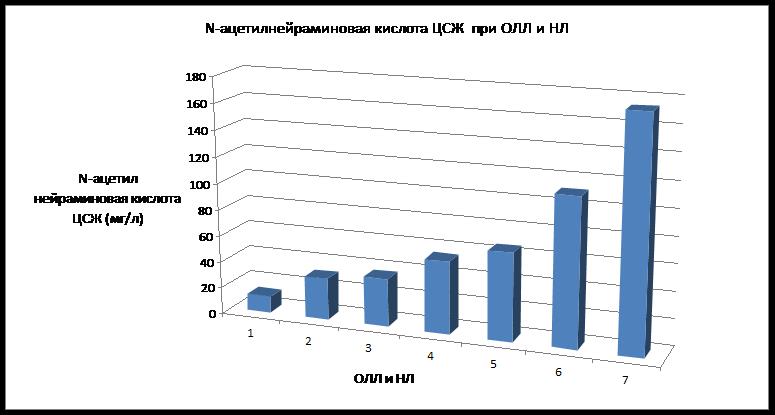
Рис. 1. Концентрация N-ацетилнейраминовой кислоты в различные периоды ОЛЛ и острые периоды нейролейкемии у детей
Fig. 1. The concentration of N-acetylneuraminic acid in different periods of ALL and acute neuroleukemia in children
1. Норма.
2. Ремиссия.
3. Острый период ОЛЛ.
4. Костномозговой рецидив ОЛЛ.
5. Доклиническая нейролейемия (ДНЛ) – острый период.
6. Клиническая нейролейкемия (КНЛ) – острый период.
7. Инициальная нейролейкемия(ИНЛ) – острый период.
Fig.1. N-acetylneuraminic acid CSF during different periods of ALL and acute periods of neuroleukemia in children
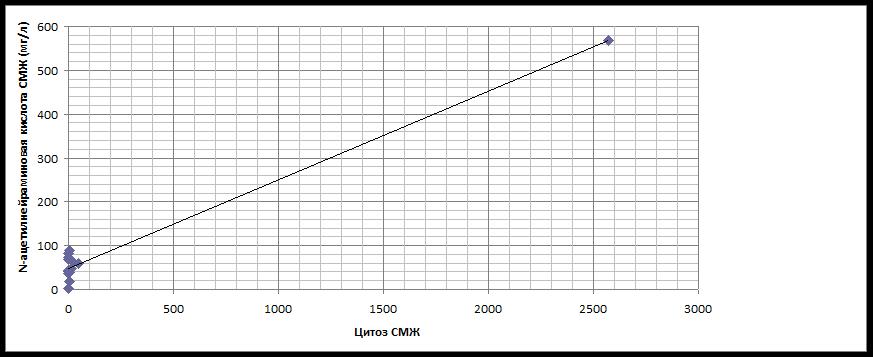
Рис. 2.Корреляционная зависимость цитоза и N-ацетилнейраминовой кислоты цереброспинальной жидкости в остром периоде доклинической нейролейкемии у детей (r=0.99, p<0.001)
Fig. 2. Cytosis correlation and N-acetylneuraminic acid of CSF in the acute period of preclinical neuroleukemia
in children
Таким образом, определявшиеся биохимические показатели ЦСЖ характеризовали только НЛ, однако в динамике наблюдения вышеуказанные величины нарастают. Возможно, это происходит в результате изменения состояния ГЭБ и/или интратекального синтеза. Концентрационные градиенты постоянно находились на верхней границе нормы, напоминая состояние «незрелости» ГЭБ, как в период новорожденности.
Соответственно 3 группам риска имеются определенные различия в ИТТ, но они, как правило, различаются только по интенсивности проводимой ХТ.
Очень хорошо показала себя во всех мультицентровых рандомизированных кооперированных международных исследованиях TIT (3ИТТ), даже как эквивалент лучевой терапии, что позволяет надеяться в ближайшем будущем снизить лучевую нагрузку на детский организм во время лечения и избежать грозных последствий и осложнений для растущего организма [5].
ИТТ претерпела модификации, особенно после 70-90 гг. 20 в, в связи с изменениями представлений о дозировке вводимых эндолюмбально цитостатических препаратов, что позволило избежать токсичности у детей старше 10 лет и адекватно дозировать ИТТ у детей дошкольного возраста. [36].
Таким образом, ИТТ была и остается самым надежным методом лечения и профилактики НЛ. [3] Часто ОЛЛ, НЛ сочетаются с врожденным дискератозом, в данном исследовании также встретились такие случаи [2].
Можно прогнозировать улучшение исходов ОЛЛ, НЛ в дальнейшем за счет применения более улучшенных фармакологических препаратов, более таргетных, очищенных, с противовирусными, антибактериальными свойствами, улучшающими иммунитет, нетоксичными, укрепляющими ГЭБ, обладающими нейро- и ноотропными, нейротрофическими характеристиками, уменьшающими сладж-синдром, улучшающими общее и мозговое кровообращение, метаболизм головного мозга, потенциал самовосстановления, регенерацию стволовых клеток и др. [9, 11, 17, 26, 33]. С учетом современных достижений биотехнологии можно прогнозировать дальнейшую эволюцию в терапии ОЛЛ, НЛ без увеличения ее токсичности. [19] Возможно, альтернативное интратекальное применение специализированных стволовых клеток с системной трансплантацией гемопоэтических стволовых клеток – ТГСК, может эффективно дополнить лечебную тактику и стратегию при ОЛЛ, НЛ [31].
Выводы
1. Во всех периодах заболевания исследованные параметры ЦСЖ оказались повышенными, косвенно свидетельствуя об ИТС во все периоды ОЛЛ, НЛ, начиная с острого периода и не нормализуясь в ремиссии, у отдельных больных. ОБ ЦСЖ постепенно увеличивался с удлинением сроков ремиссии.
2. Концентрационные градиенты для более мелких молекул, таких, как аминокислоты, свидетельствовали о состоянии ГЭБ, близкому к состоянию незрелости, как у новорожденных, вследствие метаболических процессов. Динамика проницаемости ГЭБ изменялась на протяжении течения заболевания.
Так, в остром периоде ОЛЛ состояние проницаемости ГЭБ была наименьшей для ИП. По мере протекания заболевания проницаемость ГЭБ волнообразно изменялась: увеличивалась при костномозговом рецидиве, но более при развитии НЛ. Наибольшие изменения отмечались при ИНЛ, но быстро регрессировали на фоне проводимой протокольной терапии. Аналогичные отклонения были при КНЛ, но практически в большинстве случаев наблюдения не возвращались к исходным величинам. Величины, полученные при ДНЛ находились между ИНЛ и КНЛ, но отмечались случаи ДНЛ, аналогичные ИНЛ и КНЛ, но без клиники и не снижались до исходного уровня даже на фоне ИТТ.
Необходимо отметить, что косвенные признаки ИТС имеются на протяжении всего течения заболевания, даже когда констатируется состояние ремиссия по общепринятому анализу ЦСЖ и по стандартным протокольным признакам. Начальный ИТС (ОНЛ, ИНЛ) показывает НАНК ЦСЖ и вообще НАНК ЦСЖ показала достоверную диагностическую значимость для процессов НЛ. Ам – хороший критерий нейротоксичности (даже без клиники). А (концентрационный градиент А) ЦСЖ показал прогностическую значимость для течения НЛ (с исходом в ремиссию, затяжное течение, летальный исход).
На фоне ИТТ в подостром периоде НЛ, который выделен нами впервые, возможно, повышение показателей в этот момент свидетельствует о нейротоксичности, о распаде НЛ очага. Г ЦСЖ отражают иммуносупрессию ЦСЖ на фоне проводимой протокольной терапии и в тоже время повышаясь в отдельные периоды как признак ИТС.
Концентрационные градиенты свидетельствовали о состоянии ГЭБ, близкому к состоянию незрелости ГЭБ, как у новорожденных. Динамика проницаемости ГЭБ изменялась на протяжении течения заболевания.
Так, в остром периоде ОЛЛ проницаемость ГЭБ была наименьшей. По мере протекания болезни ГЭБ волнообразно изменялась: увеличивалась при костномозговых рецидивах, но более при развитии НЛ. Наибольшие изменения отмечались при ИНЛ, но быстро регрессировали на фоне проводимой протокольной терапии. Аналогичные отклонения были при КНЛ, но практически в большинстве случаев наблюдения не возвращались к исходным величинам. ИП при ДНЛ находились между ИНЛ и КНЛ, но отмечались случаи ДНЛ, аналогичные ИНЛ и КНЛ, но без клиники и не снижались до исходных величин даже на фоне ИТТ.
Необходимо отметить, что косвенные признаки ИТС имеются на протяжении всего течения заболевания, даже когда констатируется ремиссия по стандартным протокольным признакам. За начальный ИТС (ОНЛ, ИНЛ) очень надежна НАНК ЦСЖ. НАНК ЦСЖ показала достоверную диагностическую значимость для процессов НЛ. Ам – хороший критерий нейротоксичности. А (концентрационный градиент А) ЦСЖ показал прогностическую значимость для течения НЛ.
На фоне ИТТ в подостром периоде НЛ, который выделен нами впервые, возможно, повышение белковых параметров ЦСЖ в этот момент свидетельствует о НТ, о распаде НЛ очага. Г ЦСЖ отражают иммуносупрессию ЦСЖ на фоне проводимой протокольной терапии и в тоже время повышаясь в отдельные периоды, как отражение ИТС.
3. Протокольная терапия показала лучшие результаты, как близкие, так и отдаленные по безрецидивному течению и выживаемости, т. е. ЦСЖ санировалась быстро, встречаемость НЛ составила только 2.4%, что сопоставимо с данными оригинальных немецких протоколов.
4. ИТТ 3-х компонентная (TIT), усиленная в остром периоде и консолидации показала лучшие исходы.
5. Инициальная нейролейкемия, встречающаяся в остром периоде ОЛЛ, чаще всего диагностируемая во время проведения индукционной терапии, несмотря на очень высокие величины белкового профиля ЦСЖ, санируется быстро и надежно проводимой 3ИТ на фоне массивной системной ПХТ. ИТТ легко санирует инициальную НЛ.
В отношении данной статьи не было зарегистрировано конфликта интересов.




















Список литературы
С. 47-52.
Pp. 112-115.
10 (3). Pp. 237-241.
49 (11). Pp. 873-888.
Pp. 765-769.
56 (6). Pp. 265-268.
Pp. 1867-1877.