РАЗРАБОТКА ОРИГИНАЛЬНОЙ МЕТОДИКИ ОПРЕДЕЛЕНИЯ СЕРОУГЛЕРОДА В ИНФУЗИОННЫХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТАХ
Aннотация
В данной статье рассматривается необходимость разработки методик определения сероуглерода как недопустимой примеси в инфузионных лекарственных средствах. Актуальность настоящего исследования обусловлена тем, что согласно токсикологической характеристике сероуглерод проявляет канцерогенные, тератогенные и генотоксичные свойства. Таким образом, он является одним из наиболее опасных для макроорганизма токсикантов, выделяемых пробками из резины, произведенной с применением тетраметилтиурамдисульфида. Известно, что до настоящего времени в производстве резины для укупорочных пробок флаконов инфузионных лекарственных препаратов продолжается использование тетраметилтиурамдисульфида, что делает необходимым определение сероуглерода как недопустимой примеси в инфузионных лекарственных средствах на уровне нормативной документации. Цель исследования.Доказать, что разработанная методика количественного определения сероуглерода в инфузионных препаратах позволяет получать достоверные результаты.Материалы и методы. В качестве объекта исследования выбраны инфузионные лекарственные препараты, укупоренные резиновими пробками. В качестве стандартного образца для проведения анализа использовался сероуглерод. Количественное определение сероуглерода в полученных образцах проводилось методом хромато-масс-спектрометрии, используя колонку, капиллярную кварцевую, размером 30 м × 0,32 мм с неподвижной фазой 5%-дифенил-95%-диметилполисилоксан (Elite-5, ф-мы PerkinElmer, США). Расчёт содержания сероуглерода проводили с помощью внутреннего стандарта, в качестве которого был использован метилэтилсульфид. Результаты.Методика заключается в отборе равновесной паровой фазы из указанных модельных образцов, помещённых в стрессовые условия (повышенная температура, УФ облучение и окисление) и дальнейшем хромато-масс-спектрометрическом определении сероуглерода в отобранной пробе. Результаты определения считали достоверными, если выполнялись следующие критерии пригодности хроматографической системы: число теоретических тарелок, рассчитанное для пика сероуглерода должно быть не менее 40000 теоретических тарелок; коэффициент разделения пиков сероуглерода и внутреннего стандарта должен быть не менее 3,5; относительное стандартное отклонение величин отношения площадей пиков сероуглерода к площадям пиков внутреннего стандарта (RSD) должно быть не более 6,17%; коэффициент корреляции линейной зависимости величин отношения площадей пиков сероуглерода к площадям пиков внутреннего стандарта от концентрации сероуглерода в калибровочном образце было не менее 0,9978. На основании предварительных исследований диапазон количественного определения сероуглерода в инфузионных препаратах установлен в пределах от 0 до 1000 мкг/л. Заключение.Таким образом, масс-спектрометрия является чрезвычайно перспективным методом фармацевтического анализа и позволяет получать достоверные результаты в диапазоне от 0,1 мкг до 1 мкг сероуглерода в 10 мл пробы.
Ключевые слова: хромато-масс-спектрометрия, сероуглерод, стандартизация инфузионных растворов, тетраметилтиурамдисульфид
Введение. Известно, что в производстве резиновых изделий широко применяется тетраметилтиурамдисульфид (ТМТД) [1, 4, 10]. В настоящее время производство пробок на основе бутилкаучука российскими производителями также осуществляется с использованием ТМТД как ускорителя вулканизации [5]. В свою очередь, доказано, что данное вещество оказывает общетоксическое, раздражающее, аллергическое, тератогенное, мутагенное действие, повышает чувствительность к алкоголю [4, 6, 13]. Широкое применение ТМТД, его токсичность, наличие случаев отравления со смертельным исходом определяют важное судебно-химическое значение данного соединения [4, 13, 16].
Десять лет назад применение ТМТД как ускорителя вулканизации было запрещено при производстве автомобильных камер и бескамерных шин из-за миграции высокотоксичных продуктов в окружающую среду, как при производстве данных изделий, так и при их эксплуатации [3]. Полнота доступной информации о токсичности ТМТД и его производных должна была быть признано экспертами Минздрава России более чем достаточным, чтобы не включать его в рецептуры резин для производства медицинских изделий. Особенно укупорочных пробок для инфузионных лекарственных препаратов. Недопустимо выдавать гигиенические сертификаты на производство пробок, содержащих ТМТД в своем составе, в настоящее время уже в соответствии с международным стандартом GMР и ГОСТ Р 52537-2006 «Производство лекарственных средств. Система обеспечения качества. Общие требования». Тем не менее, до настоящего времени производство резин для укупорочных пробок флаконов инфузионных лекарственных препаратов продолжается.
Обобщенные данные по миграции летучих органических соединений, в т.ч. сероуглерода, из полимерных материалов показывают, что продолжительность их выделения в контактирующие среды может варьироваться от нескольких часов до многих месяцев [3]. Кроме того, в работе признанного специалиста в области исследований упаковочных материалов Ф. Локс отдельно отмечается, что самопроизвольная миграция летучих продуктов очень велика [8].
Одним из наиболее опасных для макроорганизма токсикантов, выделяемых пробками из произведенной с применением ТМТД резины, является сероуглерод. Помимо канцерогенных, тератогенных и генотоксичных свойств данное соединение обладает выраженным тетурамоподобным действием. При инфузионном введении находящемуся в состоянии алкогольного опьянения индивидууму лекарственного препарата с примесью сероуглерода закономерно предполагать возникновение острых катастрофальных состояний у пациента.
Следовательно, разработка инструментария, позволяющего идентифицировать и количественно определить примесь сероуглерода в растворах для инфузий, важная задача фармацевтического анализа. Особо нужно подчеркнуть необходимость определения сероуглерода как недопустимой примеси в инфузионных лекарственных средствах на уровне НД.
Результаты исследований по оценке токсичности экстрагентов, перешедших в водные вытяжки и инфузионные лекарственные препараты из образцов укупорочных пробок на основе каучука марки БК 1675М, изготовленных с использованием ТМТД, установили значительные изменения в составе периферической крови и показателей кроветворной функции печени и почек – ни одна из изученных резин не была признана удовлетворительной [11]. Также обобщенные данные практических результатов по производству и использованию инфузионных лекарственных препаратов, укупоренных пробками из резины на основе каучуков БК, показывают, что при длительном хранении инъекционных растворов может увеличиваться их мутность, образоваться взвесь и появиться запах, характерный для летучих сульфидов [12].
Анализ открытых литературных и патентных публикаций показал, что основной объем исследований по данной теме касается частных вопросов по исследованию резин в пищевой промышленности и относится к 1960-м гг. [8]. Примеси и вещества, переходящие из пробок в инфузионный лекарственный препарат, достоверно не установлены, следовательно, не исследованы процессы их взаимодействия и данные комбинированного действия этих веществ и примесей на сам препарат. А по некоторым идентифицированным веществам и примесям отсутствуют необходимые данные по токсичности на индивидуальное вещество [14].
В настоящее время общее содержание мигрирующих веществ определяют только по интегральным показателям водной вытяжки. Из органических веществ, мигрирующих из пробок, определяют содержание ТМТД и диметилдитиокарбамата цинка в водных вытяжках методом газо-жидкостной хроматографии (ГЖХ), несмотря на тот факт, что уже в 1964 г. было достоверно установлено, что ТМТД полностью претерпевает превращения с образованием первичных и вторичных продуктов реакций [15].
Предложена методика газохроматографического определения летучих серосодержащих веществ, мигрирующие из пробок в водный экстракт, с использованием ГСО и пламенно-ионизационной / пламенно-фотометрической детекции [3]. Однако низкая чувствительность, методическая сложность, само использование ГСО на основе серосодержащих соединений делают её малопригодной для целей фармацевтического анализа.
Цель исследования: доказать, что разработанная методика количественного определения сероуглерода в инфузионных препаратах позволяет получать достоверные результаты.
Материалы и методы исследования. В качестве объекта исследования выбраны инфузионные лекарственные препараты, укупоренные резиновими пробками. В качестве стандартного образца для проведения анализа использовался сероуглерод. Количественное определение сероуглерода в полученных образцах проводилось методом хромато-масс-спектрометрии, используя колонку, капиллярную кварцевую, размером
30 м × 0,32 мм с неподвижной фазой
5%-дифенил-95%-диметилполисилоксан (Elite-5, ф-мы PerkinElmer, США). Расчёт содержания сероуглерода проводили с помощью внутреннего стандарта, в качестве которого был использован метилэтилсульфид.
Результаты исследования и их обсуждение.
Приготовление испытуемых образцов. В 4 сосуда для получения равновесной паровой фазы (РПФ) вместимостью 20 мл, помещали по 10,0 мл исследуемого образца препарата. Один из этих сосудов сразу же герметизируют силиконовой мембраной с фторопластовым слоем, а в три сосуда прибавляли по 500 мкл воды и по 100 мкл раствора внутреннего стандарта (метилэтилсульфида) и герметизировали силиконовой мембраной с фторопластовым слоем.
Приготовление калибровочных образцов сероуглерода. В 11 сосудов для получения РПФ вместимостью 20 мл, помещали по 10,0 мл 0,9% раствора натрия хлорида и прибавляли указанные в таблице объёмы воды, раствора сероуглерода и раствора внутреннего стандарта. После прибавления раствора внутреннего стандарта сосуды герметизировали силиконовой мембраной с фторопластовым слоем.
Приготовление исходного раствора внутреннего стандарта. 20 мл изопропилового спирта помещали в мерную колбу вместимостью 25 мл, прибавляли 250 мкл метилэтилсульфида, доводили объём раствора изопропиловым спиртом до метки и перемешивали.
Раствор хранили при температуре ниже – 10оС. Срок годности – 3 месяца.
Приготовление раствора внутреннего стандарта. 20 мл изопропилового спирта помещали в мерную колбу вместимостью 25 мл, прибавляли 100 мкл исходного раствора внутреннего стандарта, доводили объём раствора изопропиловым спиртом до метки и перемешивали.
Раствор использовали свежеприготовленным.
Таблица
Объемы растворов для приготовления калибровочных образцов сероуглерода
Table
The volume of solutions for the preparation of calibration samples of carbon disulphide
№ виалы | Объём 0,9% раствора натрия хлорида (мл) | Объём воды (мкл) | Объём раствора сероуглерода (мкл) | Объём раствора внутреннего стандарта (мкл) | Количество сероуглерода в калибровочном образце (мкг) | Концентрация внутреннего стандарта (нг/мл) |
1 | 10,0 | 500 | 0 | 100 | 0 | 336,8 |
2 | 10,0 | 450 | 50 | 100 | 0,100 | 336,8 |
3 | 10,0 | 400 | 100 | 100 | 0,200 | 336,8 |
4 | 10,0 | 350 | 150 | 100 | 0,300 | 336,8 |
5 | 10,0 | 300 | 200 | 100 | 0,400 | 336,8 |
6 | 10,0 | 250 | 250 | 100 | 0,500 | 336,8 |
7 | 10,0 | 200 | 300 | 100 | 0,600 | 336,8 |
8 | 10,0 | 150 | 350 | 100 | 0,700 | 336,8 |
9 | 10,0 | 100 | 400 | 100 | 0,800 | 336,8 |
10 | 10,0 | 50 | 450 | 100 | 0,900 | 336,8 |
11 | 10,0 | 0 | 500 | 100 | 1,000 | 336,8 |
Приготовление исходного раствора сероуглерода. 20 мл изопропилового спирта помещали в мерную колбу вместимостью 25 мл, прибавляли около 25 мг (19,8 мкл) (точная навеска) сероуглерода, доводили объём раствора изопропиловым спиртом до метки и перемешивали (1 мг/мл).
Раствор хранили при температуре ниже – 10оС.
Срок годности – 3 месяца.
Приготовление раствора сероуглерода. 40 мл изопропилового спирта помещали в мерную колбу вместимостью 50 мл, прибавляли 100 мкл исходного раствора сероуглерода, доводили объём раствора изопропиловым спиртом до метки и перемешивали (2 мкг/мл).
Измерения. Сосуды с испытуемыми образцами и образцами сероуглерода для калибровки помещали в устройство для получения, отбора и ввода в хроматограф РПФ и обрабатывали в следующих условиях:
- температура термостата образцов: + 60оС;
- время термостатирования: 20 мин;
- температура шприца-отборника: + 70оС;
- скорость перемешивания образцов: 200 об/мин;
- объём пробы: 0,1 мл.
Условия хроматографирования:
- колонка, капиллярная кварцевая, размером 30 м × 0,32 мм с неподвижной фазой 5%-дифенил-95%-диметилполисилоксан (Elite-5, ф-мы PerkinElmer, США или аналогичная), толщина слоя 1,0 мкм;
- температура колонки: + 45оС;
- скорость газа-носителя (гелий):
0,9 мл/мин;
- температура блока ввода проб: + 80оС;
- деление потока: 1:40 (0 – 1 мин, далее 1 : 5);
- температура интерфейса GC-MS: + 250оС;
- диапазон сканирования: от 65 z/m до 85 z/m (0,1 сек).
По результатам хроматографирования образцов для калибровки хроматографической системы рассчитывали коэффициенты (a и b) линейной зависимости величин отношения (Boi) площадей пиков сероуглерода (Soi) к площадям пиков внутреннего стандарта (Sinstoi) на хроматограммах РПФ образцов для калибровки хроматографической системы к количеству сероуглерода (Moi). Расчет проводили по формулам:

Мoi – количество сероуглерода в образце для калибровки хроматографической системы, в микрограммах.
Концентрацию сероуглерода в испытуемых образцах (Х), в микрограммах в 1 мл, рассчитывали по формуле:
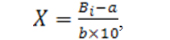 (4)
(4)
где Bi – среднее значение отношений площадей пиков сероуглерода к площадям пиков внутреннего стандарта, рассчитанное из хроматограмм РПФ испытуемых образцов;
“a” и “b” – коэффициенты линейной зависимости.
Результаты определения считали достоверными, если выполнялись следующие критерии пригодности хроматографической системы:
- число теоретических тарелок, рассчитанное для пика сероуглерода должно быть не менее 40000 теоретических тарелок;
- коэффициент разделения пиков сероуглерода и внутреннего стандарта должен быть не менее 3,5;
- относительное стандартное отклонение величин отношения площадей пиков сероуглерода к площадям пиков внутреннего стандарта (RSD) должно быть не более 6,17%;
- коэффициент корреляции линейной зависимости величин отношения площадей пиков сероуглерода к площадям пиков внутреннего стандарта от концентрации сероуглерода в калибровочном образце было не менее 0,9978.
Примечания:
1. Приготовление 0,9% раствора натрия хлорида. 9,0 г натрия хлорида помещали в мерную колбу вместимостью 1000 мл, прибавляли 900 мл воды для инъекций, перемешивали до полного растворения натрия хлорида, доводили объём раствора до метки водой для инъекций и перемешивали.
2. При приготовлении калибровочных образцов сероуглерода, дозирование раствора сероуглерода и раствора внутреннего стандарта проводили поршневыми бюретками с неопределенностью отмеряемого объёма не более 0,25 мкл.
Валидационные исследования методики количественного определения сероуглерода в инфузионных лекарственных средствах проводили в соответствии с требованиями [2, 7, 17].
На основании предварительных исследований диапазон количественного определения сероуглерода в инфузионных препаратах установлен в пределах от 0 до 1000 мкг/л.
Методика заключается в отборе равновесной паровой фазы из указанных модельных образцов, помещённых в стрессовые условия (повышенная температура, УФ облучение и окисление) и дальнейшем хромато-масс-спектрометрическом определении сероуглерода в отобранной пробе.
Расчёт содержания сероуглерода проводили с помощью внутреннего стандарта, в качестве которого был использован метилэтилсульфид.
Для подтверждения доказательства, что разработанная методика позволяет получить достоверные результаты, проведена валидационная оценка разработанной методики.
Для проведения валидации исследовались следующие характеристики:
- специфичность;
- робастность;
- линейность;
- правильность;
- точность;
- внутрилабораторная точность;
- пригодность хроматографической системы.
Заключение. Для идентификации и количественного определения сероуглерода в инфузионных лекарственных препаратах был использован метод хромато-масс-спектрометрии, т.к. масс-спектрометрия является чрезвычайно перспективным методом фармацевтического анализа [9].
В ходе проведенных исследований экспериментально подтверждено, что валидационные характеристики ГЖХ-методики количественного определения сероуглерода в инфузионных препаратах позволяют получать достоверные результаты в диапазоне от 0,1 мкг до 1 мкг в пробе 10 мл.
В отношении данной статьи не было зарегистрировано конфликта интересов.




















Список литературы
1. Бырько В.М. Дитиокарбаматы. М.: Наука, 1984. 185.
2. Юргель Н.В., Младенцева А.Л., Бурдейна А.В. и др. Руководство по валидации методик анализа лекарственных средств. М.: Фармацевтическая промышленность, 2007. 58.
3. Гужова С.В., Симонова Н.Н., Лиакумович А.Г. и др. Санитарно-химические исследования многокомпонентного состава веществ, мигрирующих из резиновых медицинских пробок на основе бутилкаучуков // Вестник Росздравнадзора. №5. 2013. С. 44-49.
4. Крамаренко В.Ф., Туркевич Б.М. Анализ ядохимикатов. М.: Химия, 1978. 264 с.
5. Вышегородская Р.А., Мельникова Г.К., Элькина И.А. Рецептура и свойства резин для изготовления изделий медицинского назначения. Каталог-справочник. М.: ЦНИИТЭнефтехимия, 1985. 560 с.
6. Гадаскина И.Д., Филов В.А. Превращения и определение промышленных органических ядов в организме. М.: Медицина, 1971. 254-255.
7. Государственная фармакопея Российской Федерации 13-е изд. / Министерство здравоохранения и социального развития Российской Федерации, Федеральное агентство по здравоохранению и социальному развитию, Федеральная служба по надзору в сфере здравоохранения и социального развития [и др.]. М.: Научный центр экспертизы средств медицинского применения, 2015. Ч. 1. 1470 с.
8. Локс Ф. Упаковка и экология: учеб. пособие / пер. с англ. О.В. Наумовой; под ред. В.Н. Наумова. М.: Изд-во МГУП, 1999. 220 с.
9. Писарев Д.И., Новиков О.О., Васильев Г.В., Селютин О.А. Опыт использования метода MALDI/TOF/MS в фармацевтическом анализе // Научные ведомости Белгородского государственного университета. Серия: Медицина. Фармация. 2012. Т. 18. № 10-2 (129). С. 76-85.
10. Грушко Я.М. Вредные органические соединения в промышленных выбросах в атмосферу. М: Химия, 1986. 207 с.
11. Шумская Н.И., Проворов М.Н., Емельянова Л.В. Гигиеническая оценка резиновых изделий и исходного сырья для их изготовления. М.: ЦНИИИТЭнефтехимия, 1981. 67 с.
12. Тенцова А.И., Алюшина М.Т. Полимеры в фармации. М.: Медицина, 1985. 256 с.
13. Жаворонков Н.И. Патогенез, диагностика, лечение и профилактика отравлений животных карбаматными пестицидами: Автореф. дис. … д-ра вет. наук. Москва, Россия, 1981. 35 с.
14. Курляндский Б.А., Филов В.А. Общая токсикология. М.: Медицина, 2002. – 608 с.
15. Блох Г.А. Органические ускорители вулканизации каучуков. 2-е изд. перераб. М.: Химия, 1972. 559.
16. Зайнутдинов Х.С., Вергейчик Т.Х., Икрамов Л.Т. Определение тетраметилтиурамдисульфида и трихлорфенолята меди в трупном материале методом производной спектрофотометрии // Суд.-мед. эксперт. 1990. 33. 4. C. 27-30.
17. CPMP/ICH/381/95 (ICH Topic Q 2 (R1)). Note for Guidance on Validation of Analytical Procedures: Text and Methodology. June 1995. 15 p.