Исследование нейродинамических нарушений у крыс при черепно-мозговой травме
Aннотация
Актуальность: Бытовой и производственный травматизм, в том числе и черепно-мозговая травма (ЧМТ) – заболевания, которые являются основной проблемой общественного здравоохранения во всех промышленно развитых странах и ведут к стойкой потере трудоспособности, а так же высокой смертности, инвалидизации и приводят к высоким затратам на лечение. Цель исследования: Исследовать нейродинамические нарушения у крыс при черепно-мозговой травме. Материалы и методы: Исследование проводилось на 48 половозрелых крысах-самцах линии «Wistar», которым моделировали черепно-мозговую травму в специальной установке с помощью грузов различной массы. Далее проводили оценку неврологического дефицита в динамике и морфологическое исследование срезов головного мозга животных. Результаты: С увеличением массы груза в эксперименте поведенческая активность крыс снижалась. Проявлялось это в снижении общей активности, числа стереотипных движений, максимальной скорости перемещения, общей дистанции. Время отдыха увеличивалось. Полученные данные в поведенческих тестах «Rota-rod» и «Инфракрасный монитор активности» подтверждают степень тяжести ЧМТ в экспериментальных группах. Исходя из показателей летальности и степени тяжести ЧМТ гистологическая картина в приоритетной группе (m=155 г), аналогична морфологической картине у человека при травме подобного рода. Заключение: Параметры данной модели (вес груза 155 грамм, высота падения 0,6 метра, область воздействия лобно-теменная), дают возможность получить разнообразную неврологическую симптоматику, которая может быть подвергнута количественной и качественной оценке, в том числе и в динамике. Полученные результаты структурных изменений в тканях головного мозга коррелируют с данными неврологического дефицита и поведенческого статуса лабораторных животных (к 7 суткам сохраняются структурные изменения в тканях головного мозга, на фоне появления признаков репаративных процессов).
Введение. Бытовой и производственный травматизм, в том числе и черепно-мозговая травма (ЧМТ) – заболевания, которые являются основной проблемой общественного здравоохранения во всех промышленно развитых странах и ведут к стойкой потере трудоспособности, а так же высокой смертности, инвалидизации и приводят к высоким затратам на лечение [1, 2]. К самым распространенным причинам возникновения ЧМТ относят ДТП и падения.
В структуре летальности населения травматизм стойко занимает 3 место. Черепно-мозговая травма является наиболее распространенной разновидностью повреждений и составляет до 40% от всех видов травм. Согласно статистике Всемирной организации здравоохранения, уровень данной патологии ежегодно вырастает на 2%. Согласно прогнозам данной организации, ЧМТ как одна из основных причин смерти и инвалидности к 2020 году может составить конкуренцию таким социально значимым заболеваниям, как ишемическая болезнь сердца и цереброваскулярные заболевания [3]. Наблюдается прирост более тяжелых форм повреждений в связи с развитием науки и техники. В Российской Федерации показатели ЧМТ составляют 4,5 на 1000 населения за 12 месяцев. Степень летальности при данной патологии в легкой форе достигает 5-10%, при тяжелых формах 41-85% [4, 5]. Ежегодно в Мире от ЧМТ погибает более 5 млн. человек [6].
Долгосрочный дефицит после ЧМТ возникает не только из-за прямых последствий травмы, но и из-за продолжающихся процессов, таких как нейрональная экситотоксичность, воспаление, окислительный стресс и апоптоз. Дефицит, связанный с данной патологией, обусловлен как прямыми механическими эффектами (первичная травма), так и косвенными эффектами, возникающими из сложных патологических каскадов, включающих широкий спектр клеточных и молекулярных путей (вторичная травма). Первичная черепно-мозговая травма возникает в момент первоначального удара и вызывает ряд прямых повреждений, таких как острая гибель клеток из-за механических нарушений. Вторичная травма возникает из-за последующих физиологических процессов, таких как экситотоксичность, которая вызывает ряд событий, включая деполяризацию и более запаздывающие механизмы воспаления и апоптоза.
В настоящее время ЧМТ не имеет эффективного лечения. Диагностика и лечения данной патологии является одной из важнейших проблем в современной медицины, поэтому разработка и внедрение новых экспериментальных методик и веществ, которые способны снизить степень повреждений головного мозга и уровень летальности, остается одной из основных задач современного здравоохранения.
Цель исследования. Поиск адекватной экспериментальной модели патологии для оценки эффективности фармакологической коррекции черепно-мозговой травмы у крыс.
Материалы и методы исследования. Эксперимент проводили на 48 половозрелых крысах-самцах линии «Wistar» 5-6-месячного возраста (m=220-240 г). Грызуны содержались с соблюдением всех правил лабораторной практики при проведении доклинических исследований на территории РФ. Животные находились в стандартных условиях, которые соответствуют санитарным правилам (№ 1045-73), утвержденным МЗ СССР06.04.73г.апо устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)пи ГОСТ Р 53434-2009. Для эксперимента произведена акклиматизация и отбор животных. Карантин не менее 10 дней. Для идентификации грызунов применялись специальные метки на теле. В период проведения эксперимента животные были здоровыми, без изменений поведения, аппетита, режима сна и бодрствования.
Для воспроизведения ЧМТ собрали устройство, основой которого являлась модель, предложенная Т.Ф. Соколовой и Ю.В. Редькиным [7]. Закрытую черепно-мозговую травму наносили с помощью свободно падающего груза разной массы из полой трубы высотой 110 см, закрепленной в штативе вертикально. На конце трубы располагался боек со стопором. Ход бойка при различной вариации приложения силы составлялии5 мм. В полость трубы помещался груз фиксированной массы на определенную высоту, далее отпускали и ударяли о боек, который в следствии наносил удар по черепу крысы (S ударной поверхности бойка – 0,5см2).
Место воздействия ударной нагрузки определялось исходя из анатомии коры головного мозга крысы. Воздействие осуществлялось в зоне локализации моторной и сенсорной коры (поля Fr1, Fr3, FL, HL, Par1, Раг2) [8]. Для избегания перелома костей свода черепа голову крысы жестко не фиксировали. Осуществлялась фиксация на лабораторном столике за задние конечности и дополнительное вытяжение за верхние резцы. Зона повреждения располагалась в лобно-теменной области левого полушария. Анатомическими ориентирами на черепе служили задние края глазницы и гребень теменной кости [9]. Строилась линия между задними краями глазниц и пальпаторно определялся гребень теменной кости. Воздействие наносилось непосредственно кнутри от этих линий, в зоне теменной кости прилегающей к лобно-теменному шву.
Крыс в эксперименте наркотизировали внутрибрюшинным введением хлоралгидрата (350 мг/кг). Протокол исследования включал следующие этапы: моделирование ЧМТ; оценка поведенческого статуса и неврологического дефицита животных по шкале оценки McGraW в модификации И.В. Ганнушкиной (1996) [5, 10] на 1, 3, 7 и 14 сут после моделирования патологии; тест «Rota-rod»; тест актиметрии «Инфракрасный монитор активности»; морфологическое исследование.
Выделяли 4 группы (n=12) животных:
1) интактные;
2) ЧМТ при высоте поднятия груза – 0,6м, вес – 145 гр.;
3) ЧМТ при высоте поднятия груза – 0,6м, вес – 155 гр.;
4) ЧМТ при высоте поднятия груза – 0,6м, вес – 170 гр.
Животных группы контроля фиксировали в установке, но травму не наносили.
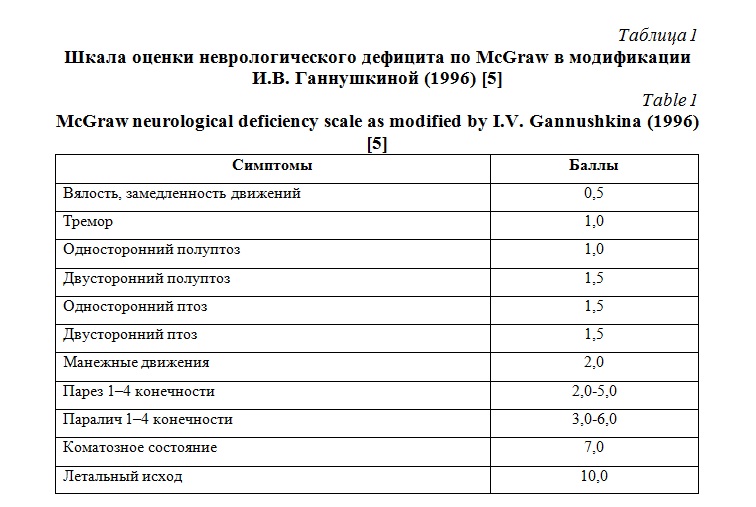
Балльная шкала оценки неврологического McGraw в модификации И.В. Ганнушкиной. Эта шкала отражает признаки неврологического дефицита, суммировались по отдельным животным, определялся средний показатель в группе. Показатели от 0,5 до 2,5 оценивались как легкий неврологический дефицит, от 2,5 до 5,5 как дефицит средней тяжести, от 5,5 до 10 тяжелый неврологический дефицит (таблица 1).
Тест «Rota-rod» – тест на моторную координацию движений, который активно используется при патологиях мозгового кровообращения. В данном эксперименте использовали постоянная скорость вращения стержня – 20 об/мин. Регистрировали латентный период (ЛП) первого падения (время первого падения животного с вращающегося стержня) и суммарное время удержания на вращающемся стержне за 3 попытки. Тест «Rota-rod» проводили через 24, 48 и 72 часа после моделирования ЧМТ, в нем измеряли 2 показателя: латентный период первого падения и суммарное время удержания за 3 попытки в течение 3-х минут [11].
«Инфракрасный монитор активности» включает в себя двухмерную квадратную раму и систему инфракрасных лучей для обнаружения движений грызунов. IR Actimeter позволяет проводить исследования произвольной двигательной активности, количества и длительности эпизодов подъема на задние лапы, стереотипных движений, а также исследовательского поведения в модели «перфорированного поля» в условиях дневного и ночного освещения. [3, 12-17].
В контрольных группах на 3 и 7 сутки после моделирования ЧМТ с соблюдением принципов гуманного отношения к животным, производилось выведение части животных из эксперимента с помощью эвтаназии, под наркозом (хлоралгидрат 350 мг/кг), методом пункции левого желудочка до полного обескровливания. Полученный биоматериал (головной мозг) фиксировали в 10% растворе формалина. После фиксации осуществляли иссечение участка коры больших полушарий головного мозга в области травмы (лобно-теменной области) и заливали в парафин по стандартной методике. Далее, изготавливали срезы толщиной 5-7 мкм и окрашивали гематоксилином и эозином [13].
Микроскопирование и фотографирование осуществляли с помощью оптической системы, состоящей из микроскопа Leica CME и окуляр-камеры DCM – 510 на увеличениях х100, х200 и х400 крат с документированием снимков в программе FUTURE WINJOE, входящей в комплект поставки окуляр-камеры.
Описательная статистика была применена ко всем данным. Полученные результаты исследовали на нормальность распределения. С помощью критерия Шапиро-Уилка был выбран тип распределения. В случае нормального распределения были подсчитаны среднее значение M и стандартная ошибка среднего m. В случаях ненормального распределения были рассчитаны медиана Me и квартильный размах QR. Межгрупповые различия анализировались параметрическими (t-критерий Стьюдента) или непараметрическими (критерий Манна-Уитни) методами, в зависимости от типа распределения. Различия были определены при 0,05 уровне значимости. Статистический анализ сделан с помощью программного обеспечения Statistica 10.0 [18].
Результаты и их обсуждение. При определении оптимальных параметров воспроизведения черепно-мозговой травмы были получены следующие показатели летальности в группе:
1) интактные – 0%,
2) вес 145гр. – 10%, в первые сутки гибели животных не фиксировали, а в последующие 3 суток умерло одно животное (10%)
3) вес 155 гр. – 30% интраэкспериментально погибло одно животное, в последующие 3 суток умерло 2 животных (30%)
4) вес 170 гр. – 60% интраэкспериментально погибло 3 животных, в последующие 3 суток умерли еще три животных (60%).
У крыс интактной группы проявления неврологического дефицита зафиксировано не было.
При оценке неврологического дефицита у животных 2 группы (m=145 г) отсутствовали неврологические нарушения как на 3-е сутки после анестезии, так и в последующем. Фиксировали такие симптомы, как вялость и односторонний полуптоз (суммарный бал по группе в 1 сутки – 0,94±0,19) Неврологический дефицит в данной группе характеризовался, как легкий и с тенденцией к регрессу на третьи сутки (0,44±0,16). В 3 группе (m=155 г) на 1-е сутки после экспериментальной ЧМТ, присутствовала разнообразная неврологическая симптоматика, соответствующая дефициту средней тяжести по шкале McGraw (4,33±0,77), с некоторым регрессом к 7 суткам (4,87±0,22).
В 4 группе с массой груза 170 гр. при очень высокой летальности наблюдался грубый неврологический дефицит с тяжелыми нарушениями, который прогрессировал к 7 суткам (1 сутки – 7,86±0,65; 7 сутки – 8,34±0,24) (таблица 2).
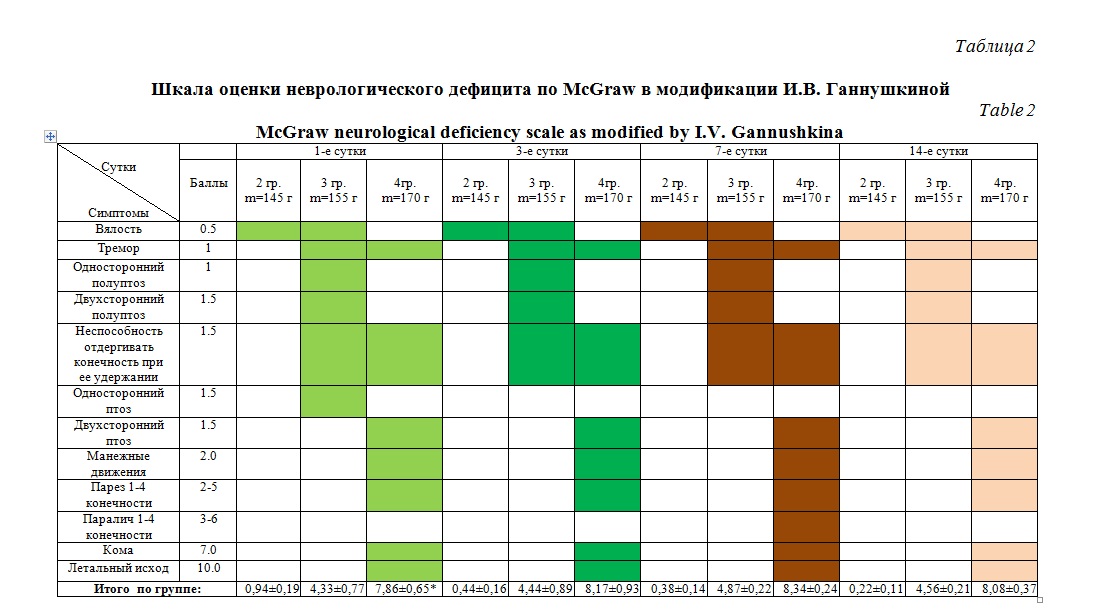
Учитывая полученные результаты близкие к оптимальным параметрам модели были, полученные в 3 группе, при допустимой летальности до 30% во время проведения эксперимента и в первые трое суток после него, у лабораторных животных получена разнообразная неврологическая симптоматика, которая может быть подвергнута количественной и качественной оценке, в том числе и в динамике
При проведении теста «Rota-rod»» в контрольных группах фиксировали снижение этих показателей. Так же определялась регрессия суммарного времени удержания с первых по третьи сутки исследования (таблица 3). Моделирование ЧМТ у животных экспериментальных групп вызвало проявление значительных нарушений силы и координации. С увеличением массы груза, снижались значения латентного периода (ЛП) 1 падения. Во второй группе у грызунов, наблюдались менее выраженные нарушения силы и координации с положительной динамикой на 2-е сутки наблюдения, которая выражалась в увеличении ЛП первого падения и особенно суммарного времени удержания за 3 попытки. Самые низкие показатели наблюдались в 4й группе. Наиболее перспективной группой для фармакологической коррекции, исходя из результатов данного теста, является 3 группа (с массой груза 155 г).


Параллельно проводилось исследование поведенческого статуса животных в тесте актиметрии «Инфракрасный монитор активности» (таблица 5).
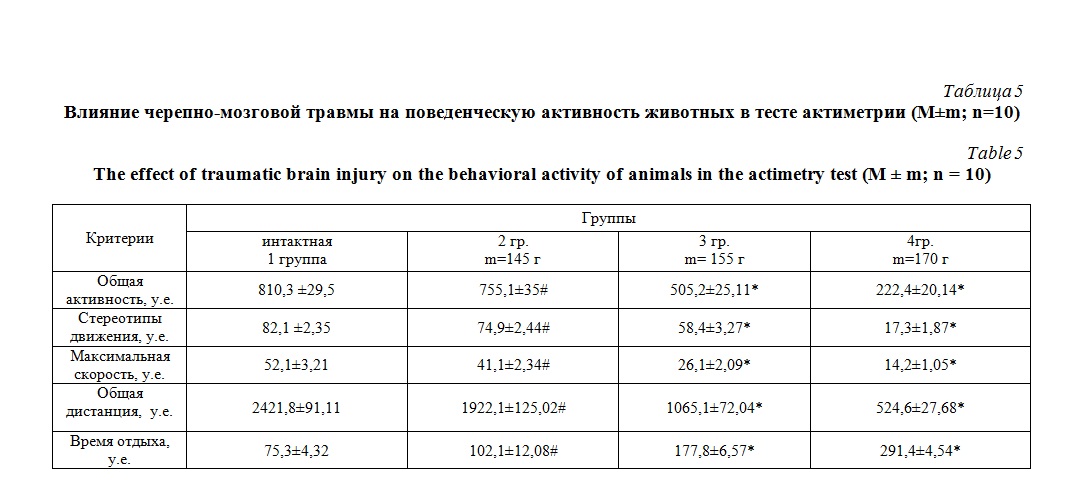
При описании двигательной активности у грызунов в данном тесте установлено, что активность 2 группы животных по сравнению с интактными снижалась, но статистически незначимо (p>0,05). С увеличением массы грузика в эксперименте активность крыс снижалась. Характеризовалось это снижением общей активности, числа стереотипных движений, максимальной скорости перемещения, общей дистанции, увеличением времени отдыха (таблица 5)
Учитывая результаты, полученные в предыдущих тестах, оптимальные параметры модели для исследования были получены в 3 группе при m=155 г. Крысам данной группы было произведено микроскопическое исследование срезов головного мозга в динамике на 3 и 7 сутки после моделирования ЧМТ.
Изучение строения коры полушарий головного мозга у интактных крыс, перенесших анестезию, не выявило морфологических нарушений.
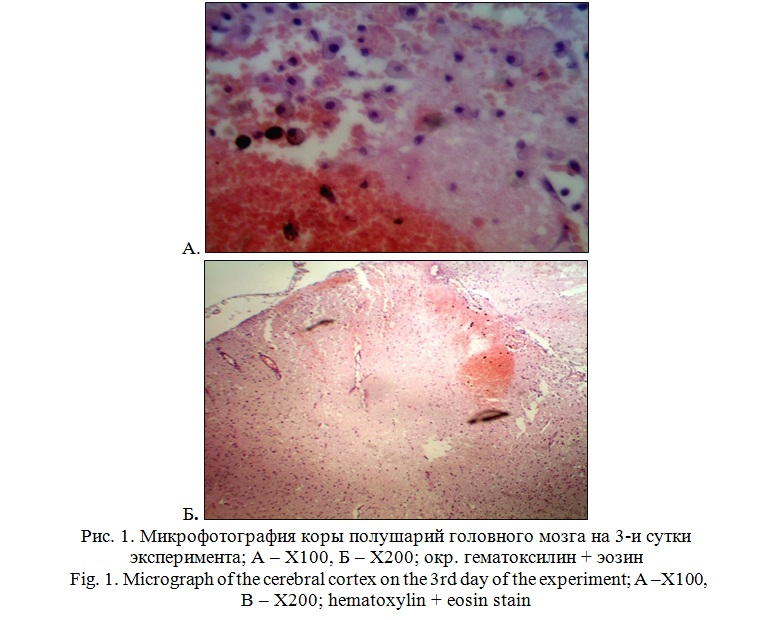
В условиях эксперимента на 3 сутки на микрофотографиях визуализируются выраженные структурные изменения в веществе мозга, заключающиеся в наличии участков локального отека вещества мозга в сочетании с субарахноидальными и корковыми кровоизлияниями (рисунок 1А). Под большим увеличением визуализируется пропитывание тканей мозга эритроцитами и определяется большое количество макрофагов (рисунок 1Б).
Вокруг кровеносных сосудов серого вещества выражены явления периваскулярного отека, а в кровеносных сосудах, локализованных между серым и белым веществом наблюдалось кровенаполнение и расширение их просвета (рисунок 2).
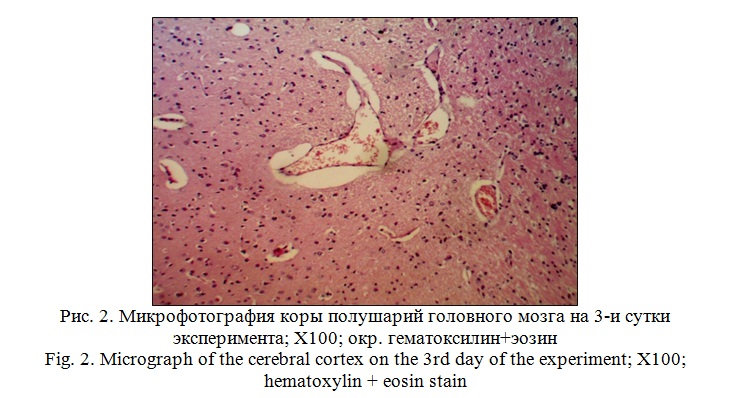
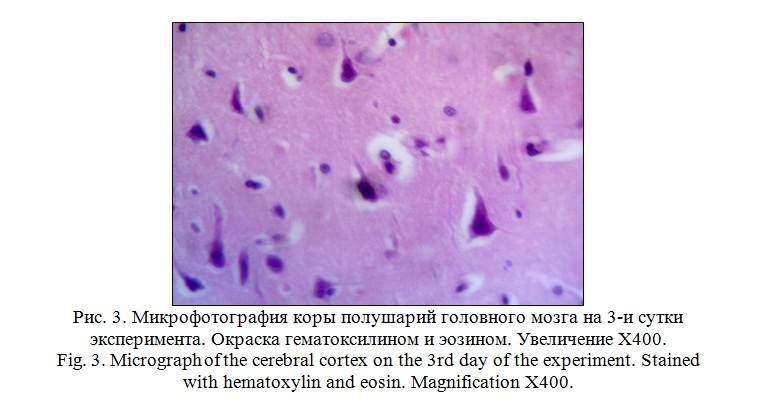
Относительно цитоархитектоники коры больших полушарий нарушений в расположении слоев не выявлено. Однако, в ганглиозном слое вокруг пирамидных нейронов наблюдается перицеллюлярный отек. Сами нейроциты, в сравнении с группой интактных животных, несколько уменьшены в размерах, их цитоплазма гомогенная, темнобазофильная (рисунок 3).
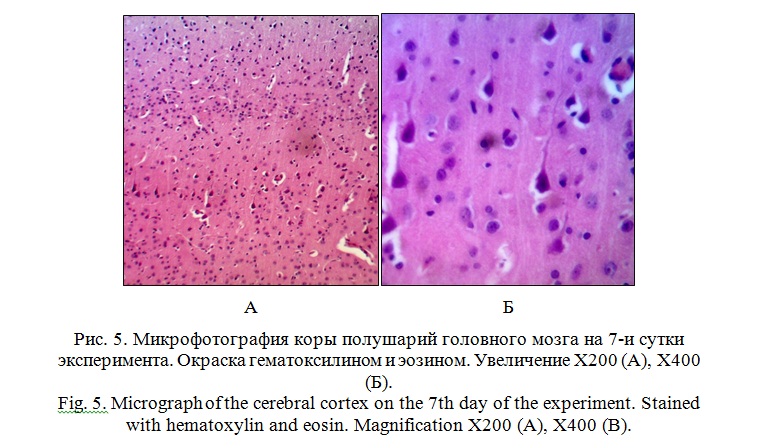
На 7-е сутки эксперимента на всем протяжении поверхности полушарий головного мозга сосудистая оболочка плотно сращена с веществом мозга, утолщена, ее сосуды полнокровные и расширенные (рисунок 4).

Вокруг всех нейроцитов наблюдается перицеллюлярный отек. Визуализируются сморщенные и гиперхромные нейроны, преимущественно в пирамидных слоях серого вещества. Плотность клеток на единице площади значительно выше, чем на 3-и сутки эксперимента (рисунок 5).
Изучение строения коры полушарий головного мозга у интактных крыс, перенесших анестезию, не выявило морфологических нарушений. У животных, перенесших экспериментальную ЧМТ напротив отмечаются значительные морфологические нарушения в зоне травмы. Данные изменения хорошо визуализируются и могут быть подвергнуты количественной и качественной оценке, а также может быть оценена их динамика.
Заключение. В результате проведенного исследования было выявлено, что наиболее информативной моделью патологии с перспективой фармакологической коррекции, является модель черепно-мозговой травмы с использованием массы груза 155 грамм. Данная модель ЧМТ позволяет повторить условия возникновения черепно-мозговой травмы у человека. Параметры данной модели (вес груза 155 грамм, высота падения 0,6 метра, область воздействия лобно-теменная), дают возможность получить разнообразную неврологическую симптоматику, которая может быть подвергнута количественной и качественной оценке, в том числе и в динамике. При этом показатель летальности в группах не превышают 30%.
Полученные результаты структурных изменений в тканях головного мозга коррелируют с данными неврологического дефицита и поведенческого статуса лабораторных животных (к 7 суткам сохраняются структурные изменения в тканях головного мозга, на фоне появления признаков репаративных процессов).
В отношении данной статьи не было зарегистрировано конфликта интересов.




















Список литературы