Вклад ген-генных взаимодействий полиморфных локусов матриксных металлопротеиназ в подверженность к первичной открытоугольной глаукоме у мужчин
Aннотация
Актуальность: Первичная открытоугольная глаукома (ПОУГ) относится к одной из самых распространенных и тяжелых форм заболеваний глаз, приводящих к слепоте и инвалидности. Глаукома у мужчин встречается в более чем половине случаев (65%). Цель исследования:Изучить вклад ген-генных взаимодействий полиморфных локусов матриксных металлопротеиназ в подверженность к первичной открытоугольной глаукоме у мужчин. Материалы и методы:Выборка для исследования включала 236 мужчин с ПОУГ (диагноз был подтвержден клиническими, инструментальными и лабораторными методами обследования) и 176 мужчин контрольной группы, не имеющих данного заболевания. Проведено молекулярно-генетическое исследование 8 полиморфных локусов генов матриксных металлопротеиназ (MMP). Изучение SNP×SNP взаимодействий, ассоциированных с развитием ПОУГ, проводилось с использованием программы АРSampler. Результаты:Установлено 16 моделей SNP×SNP взаимодействий генов MMP (4 двухлокусных, 7 трехлокусных и 5 четырехлокусных) определяющих подверженность к развитию ПОУГ у мужчин (pperm<0,05), среди которых 6 моделей являются протективными и 10 моделей – факторы риска развития ПОУГ (OR=1,80-9,26). В состав моделей входят все 8 изучаемых нами полиморфных локусов MMP: rs3918249, rs3787268, rs2250889, rs17577, rs17576, rs3918242 гена ММР-9, rs1799750 гена ММР-1, rs679620 гена ММР-3. При этом два полиморфизма (rs1799750 ММР-1 и rs2250889 ММР-9) включены в наибольшее количество моделей (10 и 8 моделей соответственно). Полиморфные локусы rs1799750 и rs2250889 имеют важное функциональное значение в организме – проявляют эпигенетические эффекты, ассоциированы с уровнем экспрессии (cis-eQTL) генов MMP1, MMP10, WTAPP1, PLTP,PCIF1, NEURL2 иуровнем альтернативного сплайсинга транскрипта гена SLC12A5, определяют несинонимическую замену в гене MMP-9 (p.Arg574Pro). Заключение:Межгенные взаимодействия полиморфных локусов ММР ассоциированы с формированием ПОУГ у мужчин.
Введение. Первичная открытоугольная глаукома (ПОУГ) относится к одной из самых распространенных и тяжелых форм заболеваний глаз, приводящих к слепоте и инвалидности. [1]. Среди всех видов глауком на долю ПОУГ приходиться от 72,3 до 96,1% [2]. ПОУГ – хроническое заболевание, характеризующееся прогрессирующей и необратимой дегенерацией клеток ганглиозного слоя, входящего в состав зрительного нерва и слоя нервных волокон сетчатой оболочки [3]. Следует отметить, что мужской пол является фактором риска развития глаукомы - данное заболевание встречается у мужчин в 65% [4]. Особенностью ПОУГ является бессимптомное течение и довольно сложная и трудоемкая диагностика на начальных стадиях, поэтому выявление данного заболевания в большинстве случаев происходит на стадиях, сопровождающихся уже необратимыми изменениями зрительного нерва [5]. ПОУГ – одна из главных причин слабовидения и слепоты среди лиц трудоспособного возраста в развитых странах [6].
Установлено, что в формировании ПОУГ важное значение имеют матриксные металлопротеиназы (далее ММР). ММР вовлечены в патогенез различных типов глаукомы [7-10], их содержание существенно выше в глаукоматозных глазах [11]. Матриксные металлопротеиназы участвуют в регуляции оттока внутриглазной жидкости [12]. По сравнению со здоровыми глазами, содержание ММР-2 и -9 существенно выше в глаукоматозных глазах. Эти изменения были обнаружены в водянистой влаге, радужно-роговичный углу и теноновой капсуле у пациентов с первичной открытоугольной глаукомой, первичной закрытоугольной глаукомой и эксфолиативной глаукоме [13, 14]. Повышение содержания металлопротеиназы-9 как в системном кровотоке, так и местно также может свидетельствовать о нарушении процессов клеточного ремоделирования в структурах глаза, что способствует формированию аутоиммунного воспаления с деструкцией тканей [15]. Наибольшее значение в формировании ПОУГ имеют ММР-1 и ММР -9 [16, 17].
Генетические исследования ПОУГ активно проводятся как зарубежными научными коллективами, так и российскими учеными [18-21]. Исследуется вовлеченность генов матриксных металлопротеиназ в формирование глаукомы. Так, в проведенном Golubnitschaja O. et. al. исследовании установлено, что экспрессия генов тканевого ингибитора матриксных металлопротеиназ ММР-9 и ММР-14 была повышена у пациентов с нормотензивной глаукомой по сравнению с контрольной группой [22]. Aung T et. al. изучали полиморфизм rs2664538 гена ММР- 9 у 217 пациентов с ПЗУГ и 83 индивидуумов контрольной группы в Китае [23]. Markiewicz L. et. al. провели анализ ассоциаций полиморфных локусов -1607 1G / 2G ММР-1, -1562 C / T ММР-9, -82 A / G ММР-12, C / T IL-1β -511 и 372 T / C TIMP1 с возникновением ПОУГ и исследовали их влияние на основные клинические признаки глаукомы [24]. В результате исследования, проведенного Micheal S. et. al. обнаружено, что у мужчин фактором риска ПЗУГ является полиморфизм rs17576 (c.836A> G) гена ММР-9, который у женщин не играл существенной роли [25]. Следует отметить, что в Российской Федерации изучение роли полиморфизма генов MMP в развитии ПОУГ до последнего времени не проводилось.
Цель исследования. Изучить вклад ген-генных взаимодействий полиморфных локусов матриксных металлопротеиназ в подверженность к первичной открытоугольной глаукомы у мужчин.
Материалы и методы исследования. Выборка для исследования включала 236 мужчин с ПОУГ (диагноз был подтвержден клиническими, инструментальными и лабораторными методами обследования) и 176 мужчин контрольной группы, не имеющих данного заболевания. Все мужчины, включенные в данное исследование, являлись уроженцами Центрального Черноземья Российской Федерации (Курская, Белгородская, Воронежская, Липецкая области), имели русскую национальность и не находились в родстве друг с другом [18, 19]. Диагноз глаукома был поставлен согласно следующих диагностических критериев: повышение ВГД, вид глаукоматозной экскавации ДЗН при офтальмоскопии, изменения периферического поля зрения, специфичные для глаукомы. Обследование обеих групп было проведено в офтальмологическом отделении ОГБУЗ Белгородской областной клинической больницы им. Святителя Иоасафа (Белгород) и офтальмологическом центре «Поколение» (Старый Оскол).
Группа контроля была сформирована из индивидуумов мужского пола, не имеющих острых и хронических заболеваний глаз, у которых отсутствовали какие-либо признаки глаукомы – ВГД было ниже 21 при пневматической тонометрии, отсутствовала глаукоматозная экскавация диска зрительного нерва и периферическое поле зрения было в пределах нормы. Также они не имели тяжелых соматических патологий, в том числе приводящих к поражениям глаз.
Все исследования пациентам проводились только после их информированного согласия на использование персональных и лечебно- диагностических данных для научно-исследовательских целей, полученных в ходе госпитализации.
Средний возраст пациентов с ПОУГ составил 70,5± 4,8 лет, контрольной группы – 69,7 ± 5,2 лет (p>0,05). Более половины больных ПОУГ (52,6%) имели сопутствующие заболевания других органов и систем, в группе контроля – 48,1%. При оценке индекса массы тела больные ПОУГ не отличались от группы контроля: у больных ПОУГ – 27,99±4,82, варьировал от 16,4 до 47,3, у пациентов из контрольной группы – 28,21±5,70, варьировал от 17,93 до 51,4 (р=0,59).
Для молекулярно-генетического исследования были отобраны 8 полиморфных локусов генов матриксных металлопротеиназ rs3918249, rs3787268, rs2250889, rs17577, rs17576, rs3918242 гена ММР-9, rs1799750 гена ММР-1, rs679620 гена ММР-3 с учетом их значимого влияния на экспрессию и регуляторный потенциал генов [26].
Анализ полиморфных маркеров осуществлялся методом полимеразной цепной реакции (ПЦР) синтеза ДНК на амплификаторе CFX96. Генотипирование проводилось в режиме реального времени методом TаqMаn зондов. Использовались наборы реагентов для генотипирования полиморфных локусов rs3918249, rs3787268, rs2250889, rs17577, rs17576, rs3918242 гена ММР-9, rs1799750 гена ММР-1, rs679620 гена ММР-3 с соответствующими олигонуклеотидными праймерами и зондами, синтезированными ООО «ТестГен» (Ульяновск).
Анализ SNP×SNP взаимодействий, определяющих подверженность к развитию ПОУГ у мужчин, проводился методом Монте-Карло марковских цепей и байесовской непараметрической статистики с использованием программного обеспечения АРSampler (http: //sources.redhat.com/cygwin). Для коррекции на множественные сравнения использовался пермутационный тест. Характер ассоциации, выявленных межгенных взаимодействий, оценивался с помощью показателя отношения шансов (OR) и его 95% доверительного интервала (95%CI) [27].
Функциональное значение исследуемых полиморфных локусов генов ММР изучалось с помощью программ HaploReg (v4.1) (http://archive.broadinstitute.org/mammals/ha ploreg/haploreg.php) (оценивались эпигенетические эффекты полиморфных локусов), GTExportal (http://www.gtexportal.org/) (изучалась связь полиморфизма генов с экспрессией генов (cis-eQTL)), PolyPhen-2 (http://genetics.bwh.harvard.edu/pph2/index.shtml) (выявлялась связь с аминокислотными заменами в кодируемом полипептиде и оценивался их предикторный потенциал).
Результаты и их обсуждение. Результаты популяционно-генетического анализа полученного нами распределения генотипов MMP в исследуемых выборках мужчин, больных ПОУГ и контрольной группы, представлены в таблице 1. Следует отметить, что по всем рассмотренным локусам генов MMP наблюдаемая гетерозиготность (Ho) соответствует теоретически ожидаемой гетерозиготности (He) (наблюдаемое распределение генотипов достоверно не отличается от ожидаемого распределения согласно равновесия Харди-Вайнберга) (>0,05).
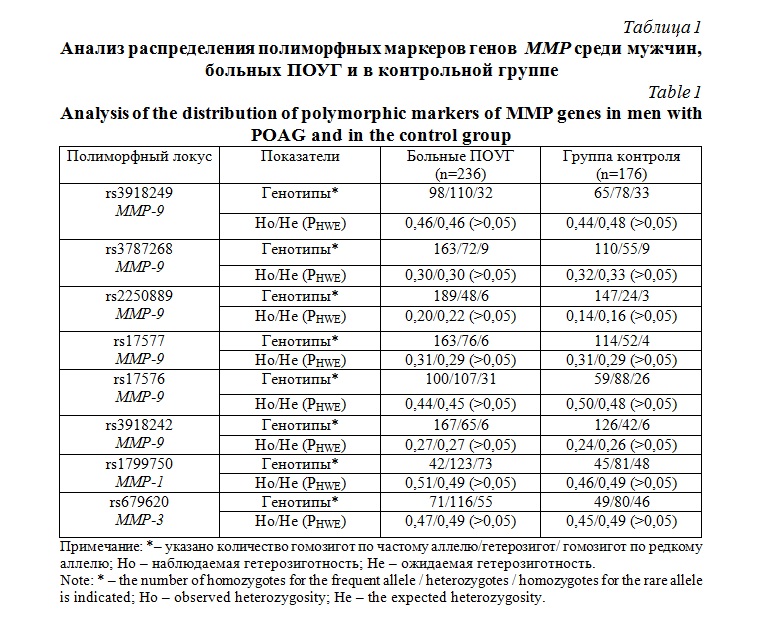
С использованием биоинформатического подхода (программа АРSampler) определены комбинации генетических вариантов полиморфных локусов генов ММР, вовлеченных в формирование ПОУГ у мужчин (табл. 2). Полученные нами данные свидетельствуют о статистических значимых ассоциациях 16 моделей SNP×SNP взаимодействий генов MMP разного уровня (4 двухлокусных, 7 трехлокусных и 5 четырехлокусных моделей) c развитием ПОУГ у мужчин (pperm<0,05). При этом, среди 16 статистически значимых моделей, связанных с формированием ПОУГ у мужчин, 6 моделей являются протективными и 10 моделей – факторы риска развития ПОУГ (OR=1,80-9,26).
Обращает на себя внимание факт того, что в состав моделей межгенных взаимодействий, определяющих подверженность к ПОУГ у мужчин, входят все 8 изучаемых нами полиморфных локусов генов матриксных металлопротеиназ: rs3918249, rs3787268, rs2250889, rs17577, rs17576, rs3918242 гена ММР-9, rs1799750 гена ММР-1, rs679620 гена ММР-3. Так же следует отметить, что в состав наибольшего количества моделей ген-генных взаимодействий, ассоциированных с формированием ПОУГ, входят полиморфные локусы rs1799750 ММР-1 (10 моделей) и rs2250889 ММР-9 (8 моделей).
Установлено, что SNP×SNP взаимодействие rs2250889 ММР-9 × rs17576 ММР-9 является основой 6 моделей, а rs3918249 ММР-9 × rs1799750 ММР-1 входит в состав 5 «значимых» моделей, связанных с формированием ПОУГ у мужчин.
На следующем этапе нашей работы были изучены эпигенетические эффекты наиболее ПОУГ-значимых полиморфных локусов генов матриксных металлопротеиназ (rs1799750 ММР-1 и rs2250889 ММР-9). С использованием программы HaploReg (v4.1) установлено, что rs1799750, расположенный в интроне гена ММР-1, имеет выраженный регуляторный потенциал: он находится в области регуляторных мотивов ДНК, взаимодействующих с регуляторными белками CFOS и GATA2, регионе гиперчувствительности к ДНКазе-1 в пяти клеточных культурах и тканях (в том числе в H1 Derived Mesenchymal Stem Cells, Fibroblast Primary Cells и др.), регионе модифицированных гистонов (H3K4me1, H3K9ac), маркирующих энхансеры в шести различных культурах клеток, тканях и органах, находится в области сайтов связывания с 21 транскрипционным фактором (AP-1_disc8, CHX10, DMRT2, Dbx1, En-1_3, Ets_disc1, Evi-1_4, GATA_known1, HMG-IY_1, Hlx1, Hoxb4, Msx-1_2, Ncx_2, Nkx6-1_2, PLZF, Pax-4_2, Pax-6_3, Pou2f2_known4, Pou3f2_4, Pou3f4, Pou6f1_2). Наряду с этим, согласно данным, представленным в онлайн базе GTExportal, полиморфизм rs1799750 ассоциирован с уровнем экспрессии трех генов (MMP1, MMP10, WTAPP1) в различных органах и тканях (pFDR≤0,05) (табл. 3).

Согласно нашим данным регуляторные эффекты полиморфного локуса rs2250889 гена ММР-9 также значимы: в соответствии с базой данных HaploReg (v4.1) он находится в эволюционно консервативном регионе ДНК, локализован в регионе модифицированных гистонов маркирующих промоторы (H3K4me3, H3K27ac) и энхансеры (H3K4me1, H3K9ac) в множестве различных культур клеток, тканях и органах (H1, H9 Derived Neuronal Progenitor Cultured Cells, H9 Derived Neuron Cultured Cells, hESC Derived CD56+ Ectoderm Cultured Cells, hESC Derived CD184+ Endoderm Cultured Cells, hESC Derived CD56+ Mesoderm Cultured Cells, H1 Derived Mesenchymal Stem Cells и др.), находится в области регуляторного мотива ДНК, взаимодействующего с регуляторным белком CTCF и расположен в регионе сайтов связывания с 2 транскрипционными факторами (NRSF_disc3 и NRSF_known2). Материалы, представленные в онлайн базе данных GTExportal, свидетельствуют о важном eQTL и sQTL значении полиморфизма rs2250889. Данный полиморфный локус ассоциирован с уровнем транскрипции гена PLTP в слизистой оболочке пищевода (β=0,49, р=7,5e-13, pFDR≤0,05), коже (β=0,42-0,45, р=6,2e-11 – 6,8e-10, pFDR≤0,05), гена PCIF1 в крови (β=-0,12, р=0,000065, pFDR≤0,05), гена NEURL2 в большеберцовом нерве (β=0,35, р=0,00012, pFDR≤0,05), а также с связан с уровнем альтернативного сплайсинга транскрипта гена SLC12A5 в гипофизе (интрон ID:46021886:46023369:clu_29529, β=1,10, p=4,7e-9, pFDR≤0,05). Наряду с этим полиморфизм rs2250889, расположенный в 10 экзоне гена MMP-9, определяет несинонимическую замену нуклеотида G на C в 1721 положении (c.1721G>C), что приводит к замене аминокислоты аргинин на аминокислоту пролин в 574 положении полипептида MMP-9 (p.Arg574Pro) (http://www.ensembl.org/). Эта миссенс мутация, согласно базы данных PolyPhen-2, имеет предикторный класс «BENIGN» (score=0, чувствительность 1,00, специфичность – 0,00).
Таким образом, полиморфные локусы rs1799750 ММР-1 и rs2250889 ММР-9, играющие наиболее существенную роль в формировании подверженности к ПОУГ у мужчин (входят в состав наибольшего количества моделей SNP×SNP взаимодействий, ассоциированных с развитием заболевания), имеют важное функциональное значение в организме (эпигенетические эффекты, eQTL, sQTL, несинонимическая замена). Полиморфизм rs1799750 ММР-1 находится в области регуляторных мотивов ДНК, взаимодействующих с регуляторными белками CFOS и GATA2, регионе гиперчувствительности к ДНКазе-1 в пяти клеточных культурах и тканях, регионе модифицированных гистонов, маркирующих энхансеры в шести различных культурах клеток, тканях и органах, находится в области сайтов связывания с 21 транскрипционным фактором, ассоциирован с уровнем экспрессии трех генов (MMP1, MMP10, WTAPP1). Полиморфный локус rs2250889 определяет несинонимическую замену в гене MMP-9 (p.Arg574Pro), локализован в эволюционно консервативном регионе ДНК, расположен в регионе модифицированных гистонов маркирующих промоторы и энхансеры в множестве различных культур клеток, тканях и органах, находится в области регуляторного мотива ДНК, взаимодействующего с регуляторным белком CTCF, расположен в регионе сайтов связывания с 2 транскрипционными факторами (NRSF_disc3 и NRSF_known2), ассоциирован с уровнем транскрипции 3 генов (PLTP, PCIF1, NEURL2) и уровнем альтернативного сплайсинга транскрипта гена SLC12A5.
Согласно литературным данным, матриксные металлопротеиназы представляют собой обширное семейство внеклеточных, цинк-содержащих протеиназ, отвечающих за рзрушение компонентов внеклеточного вещества как при физиологических, а также при патологических состояниях [28, 29, 30]. регулируемые на разных уровнях, включая транскрипцию, активацию белка и взаимодействие с эндогенными ингибиторами. MMP имеют большое значение в обмене белков соединительной ткани, в процессах развития межклеточного вещества в норме, а также при онкогенном перерождении клеток, ремоделировании внеклеточного матрикса в процессе развития и роста различных тканей, включая ткани глаз [31]. Матриксная металлопротеиназы-1 (MMP-1), также известная как интестинальная коллагеназа и коллагеназа I, синтезируется фибробластами, хондроцитами, макрофагами, кератиноцитами, эндотелиальными клетками и остеобластами [32].
Матриксная металлопротеиназа-9 (MMP-9 или желатиназа B) играет важную роль в процессах воспаления, ремоделирования ткани, репарации, регуляции связанных факторов роста и обмена цитокинов. Активность MMP-9 регулируется TIMP-3 и различными цитокинами и факторами роста, включая интерлейкины, интерфероны, эпидермальный фактор роста (EGF), фактор роста нервов (NGF), основной фактор роста фибробластов (FGFb), фактор роста сосудистого эндотелия (VEGF), тромбоцитарный фактор роста (PDGF), фактор некроза опухоли α (TNF-α), трансформирующий фактор роста β (TGF-β) и остеопонтин [18, 19]. MMP-9 отвечает за лизис белков внеклеточного межуточного вещества, а также активация различных факторов роста, таких как pro-TGF-β и pro-TNF-α [30].
В ряде ранее проведенных исследований установлено, что ММР-1 и MMP-9 были вовлечены в снижении устойчивости к оттоку внутриглазной жидкости глаза, особенно содержание ММР-9 было связано с процессом глаукомы. По сравнению со здоровыми глазами в глаукоматозных глазах концентрация ММР- 9 была достоверно выше. Эти изменения были обнаружены в водянистой влаге, радужно-роговичный углу и теноновой капсуле у пациентов с различными видами глауком, в том числе, ПОУГ [13]. Роль матриксных металлопротеиназ в регуляции оттока ВГЖ исследовалась Rönkkö S.et al. (2007). Была изучена экспрессия ММР и тканевых ингибиторов (MMP-1, -2, -3, -9, TIMP-1, -2, -3) у больных ПОУГ и эксфолиативной глаукомой (ЭГ). Концентрация ММР-1 в образцах с ПОУГ значительно превышало этот показатель при эксфолиативной глаукоме [33].
Авторы Manabe S et al. (2005) сообщают о том, что аномальная активация ММP-9 при помощи оксида азота NO вызывает внеклеточный сигнальный каскад, ведущий к апоптозу. У мышей с удаленным геном ММР-9, в той же степени, как и у животных, у которых ММР-9 фармакологически был ингибирован, ретинальные клетки не погибают от апоптоза [34].
При изучении ассоциации полиморфизмов ММР-9 с глаукомой в популяции Южного Китая установлено, что полиморфизм rs2250889 является фактором риска для развития первичной закрытоугольной глаукомы (ПЗУГ) (OR = 1,76, р = 0,004) [35], что полностью согласуется с полученными нами результатами о значимой роли данного полиморфизма в формировании ПОУГ у мужского населения России. В результате исследования, проведенного Micheal S. et al у 112 пациентов с ПОУГ, 82 пациентов с ПЗУГ и 118 здоровых людей в популяции Пакистана, выявлено, что фактором риска развития ПОУГ у женщин является полиморфизм ММР-1 rs1799750 (-1607 1G / 2G) (р<0,001), в то время как этот полиморфизм у лиц мужского пола не ассоциирован с ПОУГ (р> 0,47) [25]. Mossböck G et al. исследовали полиморфизм MMP-1-1 rs1799750 у пациентов с ПОУГ. В исследование были включены 322 пациента с ПОУГ, 202 пациентов с эксфолиативной глаукомой и 248 здоровых индивидуумов. Никаких существенных различий в распределении данного полиморфизма не было установлено между пациентами с ПОУГ и контрольной группой [36]. Следует отметить, что в нашем исследовании, показана значимая роль полиморфизма rs1799750 ММР-1 в формировании ПОУГ у мужчин.
Заключение. Межгенные взаимодействия полиморфных локусов генов ММР ассоциированы с формированием первичной открытоугольной глаукомы у мужчин. 16 моделей SNP×SNP взаимодействий генов MMP (4 двухлокусных, 7 трехлокусных и 5 четырехлокусных) определяют подверженность к развитию заболевания, из которых 10 моделей, ассоциированы с повышенным риском, а 6 моделей имеют протективную направленность. В состав наибольшего количества моделей ген-генных взаимодействий, связанных с развитием ПОУГ, входят полиморфные локусы rs1799750 ММР-1 (10 моделей) и rs2250889 ММР-9 (8 моделей). Данные полиморфные локусы (rs1799750 и rs2250889) имеют важное функциональное значение в организме (эпигенетические эффекты, eQTL, sQTL, несинонимическая замена).
В отношении данной статьи не было зарегистрировано конфликта интересов.
Благодарности
Работа выполнена при финансовой поддержке гранта Президента Российской Федерации для ведущих научных школ Российской Федерации (проект НШ-2609.2020.7).




















Список литературы