Исследование ассоциаций трёх полиморфных вариантов гена глутатионсинтазы (GSS) c риском развития ишемического инсульта
Aннотация
Актуальность: Хорошо известно, что полиморфизмы генов ферментов антиоксидантной системы вносят существенный вклад в предрасположенность к ишемическому инсульту (ИИ) и влияют на тяжесть его проявлений. Цель исследования: Целью настоящего исследования было изучение ассоциации однонуклеотидных полиморфизмов (SNP) rs13041792, rs1801310 и rs6088660 гена глутатионсинтазы (GSS), который вовлечен в первый этап биосинтеза глутатиона – одного из важнейших низкомолекулярных антиоксидантов. Материалы и методы: Материалом для исследования послужили образцы ДНК 1288 неродственных индивидов славянского происхождения (600 пациентов с диагнозом ИИ и 688 относительно здоровых индивидов). Генотипирование полиморфных вариантов гена GSS осуществлялось с использованием системы генетического анализа MassARRAY-4. Функциональное аннотирование SNPs проводилось с использованием различных онлайн-инструментов и баз данных. Результаты: Установлено, что генотип G/A rs1801310 ассоциировался с повышенным риском развития ишемического инсульта независимо от возраста (OR=1,42 95%CI 1,13-1,77, P=0,002). Анализ ассоциации, стратифицированный по полу, показал, что данный генотип был ассоциирован с повышенным риском развития ИИ исключительно у мужчин (OR=1,55 95%CI 1,15-2,10, P=0,004). Также было установлено, что SNP rs6088660 гена GSS ассоциировался с повышенным риском развития ишемического инсульта у женщин (OR=1,41 95%CI 1,09-2,83, P=0,008). Частый гаплотип rs13041792G-rs1801310G-rs6088660T (OR=1,38 95%CI 1,03-1,83 P=0,029) и редкий гаплотип rs13041792A-rs1801310A-rs6088660C (OR=9,78 95%CI 1,15-83,34 P=0,037) были ассоциированы с повышенным риском развития ишемического инсульта у женщин. Установлено, что генотип G/A SNP rs1801310 проявляет свое влияние на риск развития ИИ у мужчин независимо от фактора риска курения, тогда как у женщин независимо от генотипов SNP rs6088660 курение увеличивало риск развития болезни. Заключение: Биоинформатический анализ показал, что транскрипционная активность гена GSS может зависеть от исследованных аллельных вариантов в связи с тем, что они представляют собой мишени для регуляции экспрессии гена посредством модификации гистонов, а также транскрипционных факторов в различных тканях, в том числе тканях, имеющих патофизиологическое значение для развития ишемического инсульта.
Ключевые слова: ишемический инсульт, метаболизм глутатиона, глутатионсинтаза (GSS), однонуклеотидный полиморфизм (SNP), экспрессия гена, генно-средовые взаимодействия, половой диморфизм
Введение. Сосудистые заболевания мозга вместе с ишемической болезнью сердца и гипертонией занимают лидирующие позиции в структуре заболеваемости, причин смертности и инвалидизации населения экономически развитых стран мира, в том числе и Российской Федерации [1]. Наиболее распространенной формой сосудистых заболеваний мозга является ишемический инсульт (ИИ), развитие которого в большинстве случаев связано с атеросклерозом и атеротромбозом церебральных сосудов с формированием очага инфаркта в головном мозге. Понимание этиологии и молекулярных механизмов развития цереброваскулярной патологии открывает перспективы для разработки более эффективных средств и подходов к профилактике и лечению данного класса социально значимых болезней.
Известно, что ишемический инсульт представляет собой мультифакториальное полигенное заболевание, развитие которого определяется взаимодействием генетических и средовых факторов. На сегодняшний день установлен широкий спектр генов, полиморфные варианты которых связаны с различными звеньями патогенеза и клинического течения ишемического инсульта [2]. Одним из патогенетически значимых молекулярных механизмов цереброваскулярной патологии являются нарушения в системе редокс-гомеостаза, проводящие к формированию окислительных повреждений стенок церебральных сосудов, способствуя развитию в них атеросклероза и тромбоза, а также играющие ключевую роль в образовании зоны некроза и воспаления в ишемизированном участке головного мозга при ИИ [3, 4, 5]. Окислительный стресс – патологический процесс, развивающийся на фоне дисбаланса в системе редокс-гомеостаза, связанного с избыточной продукцией активных форм кислорода и недостаточным их обезвреживанием вследствие нарушений функционирования ферментов про и антиоксидантного действия [6, 7]. Проведенные генетико-эпидемиологические исследования продемонстрировали, что полиморфные варианты генов ферментов антиоксидантной системы могут вносить ощутимый вклад в детерминацию предрасположенности к ишемическому инсульту [8, 9, 10].
Ведущую роль в системе антиоксидантной защиты клеток от окислительного повреждения играет метаболизм глутатиона. Глутатион представляет собой внутри- и внеклеточный антиоксидант, который в центральной нервной системе играет роль основного медиатора защиты мозга от его окислительного повреждения [11]. В частности, глутатион предотвращает гибель клеток во время ишемизации мозга, уменьшая зону некроза [12, 13]. Высокая внутриклеточная концентрация глутатиона, необходимая для обеспечения оптимальной антиоксидантной защиты тканей мозга обеспечивается функционированием ферментов, катализирующий целый каскада реакций биосинтеза и катаболизма катаболизм глутатиона. Ферментом, осуществляющим первый этап биосинтеза глутатиона, а именно реакции АТФ-зависимого превращения гамма-L-глутамил-L-цистеина в восстановленный глутатион (GSH), является глутатионсинтаза (GSS), ген которого в достаточном количестве экспрессируется в артериях и различных отелах головного мозга (данные порталов BioGPS, http://biogps.org и GTEx https://www.gtexportal.org).
Таким образом, полиморфные варианты гена GSS представляют собой привлекательный объект для генетико-ассоциативных исследований сосудистых заболеваний мозга, в частности ишемического инсульта. В то же самое время, в мире до настоящего времени не проводилось исследований по поиску ассоциаций полиморфных вариантов гена GSS с риском развития ишемического инсульта.
Цель исследования. Изучение ассоциации трех частых однонуклеотидных полиморфизмов (SNP) rs13041792, rs1801310 и rs6088660 гена глутатионсинтазы с риском развития ишемического инсульта.
Материалы и методы исследования. Материалом для исследования послужила выборка 1288 неродственных индивидов славянского происхождения – уроженцев Центральной России (преимущественно русских жителей Курской области). Основная группа включала 600 больных с ишемическим инсультом. Диагноз ИИ устанавливался квалифицированными неврологами на основании данных клинического обследования и результатов компьютерной и магнитно-резонансной томографии головного мозга. Контрольная группа включала 688 относительно здоровых добровольцев без клинических проявлений сердечнососудистых и других хронических заболеваний. Сбор клинического и биологического материалов осуществлялся в неврологических отделениях БМУ «Курская областная клиническая больница» и ОБУЗ «Курская городская клиническая больница скорой медицинской помощи» в период с 2007 по 2017 гг. в рамках выполнения генетико-эпидемиологических исследований различных мультифакториальных заболеваний [14-20]. Все пациенты дали добровольное письменное согласие на участие в исследования. Протокол исследования одобрен региональным этическим комитетом Курского государственного медицинского университета (протокол № 4 от 14.04.2014).
Геномную ДНК выделяли стандартным методом фенольно-хлороформной экстракции с последующей преципитации ДНК этанолом. Генотипирование полиморфных вариантов rs13041792, rs1801310 и rs6088660 гена GSS на генетическом анализаторе MassARRAY-4 (Agena Bioscience, США) в НИИ генетической молекулярной эпидемиологии Курского государственного медицинского университета (КГМУ). Праймеры для проведения мультиплексной ПЦР были синтезированы компанией Евроген (г. Москва). Контроль качества генотипирования, выполненного на 5% случайно отобранных образцов ДНК, показал 100% воспроизводимость первичных результатов генотипирования.
Анализ ассоциаций SNPs с риском развития ИИ проводился методом множественной логистической регрессии при помощи статистического пакета SNPStats [21]. Ассоциации полиморфных вариантов гена GSS с развитием ишемического инсульта оценивались в общих группах пациентов, а также раздельно у мужчин и женщин с коррекцией на возраст пациентов с целью выявления феномена полового диморфизма во взаимосвязи исследуемого гена с развитием болезни.
C целью патофизиологической интерпретации ассоциаций проводили функциональное аннотирование SNPs посредством различных биоинформатических онлайн-инструментов и баз данных. Для выявления т.н. cisQTLs (локусов количественных признаков), ассоциированных с изучаемыми полиморфизмами, использовали базы данных: GTEx portal (https://www.gtexportal.org), eQTLGen (https://www.eqtlgen.org/cis-eqtls.html) и QTLbase (http://mulinlab.tmu.edu.cn/qtlbase/index.html). С целью оценки влияния модификаций гистонов на экспрессию гена GSS и выявления регуляторных участков его промотора использовались онлайн-инструменты функционального аннотирования однонуклеотидных полиморфизмов SNPnexus (https://www.snp-nexus.org/index.html), интегрированного с экспериментальными данными проектов ENCODE (https://www.encodeproject.org), Roadmap Epigenomics (http://www.roadmapepigenomics.org) и Ensembl Regulatory Build (www.ensembl.org).
Результаты и их обсуждение. Частоты генотипов полиморфных вариантов rs13041792 и rs6088660 гена GSS находились в равновесии Харди-Вайнберга в обеих группах пациентов, тогда как распределение частот генотипов rs1801310 показало статистически значимое отклонение от равновесия Харди-Вайнберга в группе больных ИИ (P<0,05). В таблице 1 представлены частоты аллелей и генотипов полиморфных вариантов гена GSS в группах больных ИИ и здоровых индивидов, как в общих группах, так и в группах, стратифицированных по полу.
Как можно увидеть из таблицы 1, частоты минорных аллелей (MAF) полиморфизмов гена GSS у жителей Центральной России были сопоставимы с таковыми в других европеоидных популяциях согласно популяционно-генетическими данным проекта HapMap, представляемым ресурсом Ensembl (http://www.ensembl.org): rs13041792 (MAF=0,20), rs1801310 (MAF=0,43) и rs6088660 (MAF=0,26).

Установлено, что генотип G/A rs1801310 ассоциировался с повышенным риском развития ишемического инсульта независимо от возраста (OR=1,42 95%CI 1,13-1,77, P=0,002). Анализ ассоциации, стратифицированный по полу, показал, что данный генотип был ассоциирован с повышенным риском развития ИИ исключительно у мужчин (OR=1,55 95%CI 1,15-2,10, P=0,004). Также было установлено, что SNP rs6088660 гена GSS ассоциировался с повышенным риском развития ишемического инсульта у женщин (OR=1,41 95%CI 1,09-2,83, P=0,008 log-аддитивная генетическая модель). Данный факт свидетельствует об отчетливом половом диморфизме в ассоциациях полиморфных вариантов гена GSS с развитием ишемического инсульта. Возможным объяснением данного феномена может быть известный факт того, что эстрогены сами способны подавлять экспрессию гена GSS [22].
Полиморфные варианты GSS находились в тесном неравновесии по сцеплению друг с другом: rs13041792 с rs1801310 (D'=0,907, D=-0,068, P<0,01), rs13041792 с rs6088660 (D'=0,999, D=-0,058, P<0,01), rs1801310 с rs6088660 (D'=0,999, D=-0,115, P<0,01). В таблице 2 представлены гаплотипы гена GSS среди больных ИИ и у лиц контрольной группы. Было установлено пять гаплотипов гена GSS с частотой не менее 1%. Статистически значимых различий в частотах гаплотипов между объединенными по полу группами больных ИИ и здоровых не выявлено (P>0,05). Анализ распределения гаплотипов, стратифицированный по полу показал, что у женщин обнаружены различия в частотах гаплотипов между группами ИИ и контроля (P=0,005). Частый гаплотип H2 rs13041792G-rs1801310G-rs6088660T (OR=1,38 95%CI 1,03-1,83 P=0,029) и редкий гаплотип H5 rs13041792A-rs1801310A-rs6088660C (OR=9,78 95%CI 1,15-83,34 P=0,037) были ассоциированы с повышенным риском развития ишемического инсульта у женщин независимо от возраста.

Анализ генно-средовых взаимодействия способен объяснить механизмы, посредством которые полиморфные варианты генов ассоциированы с риском развития мультифакториальных заболеваний [23]. Нами были проанализированы совместные влияния генотипов глутатионсинтазы, полиморфизмы которой ассоциированы с развитием ИИ, и курения (известного фактора риска болезни) на риск развития ишемического инсульта раздельно у мужчин и женщин (таблица 3).
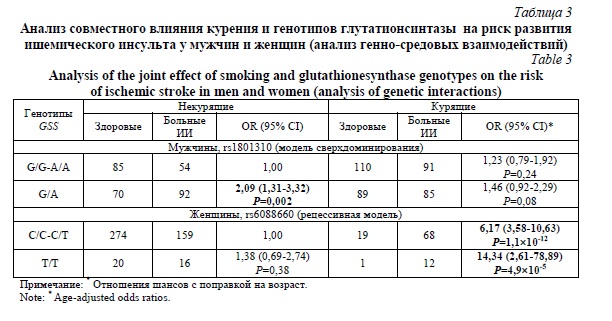
Установлено, что генотип G/A SNP rs1801310 проявляет свое влияние на риск развития ИИ у мужчин независимо от фактора риска курения, тогда как у женщин независимо от генотипов SNP rs6088660 (в наибольшей степени генотипа T/T) курение увеличивало риск развития болезни. Из литературы известнее факт, что компоненты табачного дыма способны подавлять транскрипционную активность гена глутатионсинтазы [24].
Важной задачей исследования было функциональное аннотирование SNPs с использованием биоинформатических инструментов и ресурсов. В таблице 4 представлены сводные данные результатов функционального аннотирования SNPs гена GSS
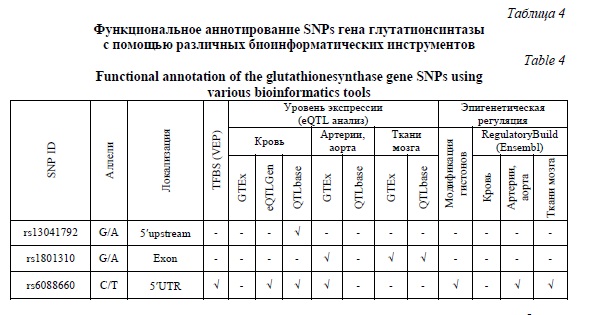
Анализ экспериментальных данных геномного и транскриптомного анализа, депонированных в интернет ресурсах GTEx portal, eQTLGen and QTLbase позволил установить, что исследуемые полиморфные варианты гена GSS имеют т.н. eQTLs или локусы, ассоциированные с экспрессией гена в различных видах тканей и типов клеток. В большей степени представляли интерес те виды клеток и тканей, которые могли бы иметь патогенетическую связь с атеросклерозом (артерии, клетки крови), а также клетки центральной нервной системы и отделы головного мозга, наиболее часто подвергающиеся ишемическому повреждению в результате окклюзии церебральных артерий. Так, согласно данным GTEx портала SNP rs13041792 не имел ни одного eQTLs в данных видах тканей, но в то же время обнаружено, что аллель A SNP rs13041792 ассоциирован со снижением экспрессии гена GSS в сердечной мышце (P=0,0002) и крови (P=2,4×10-6, данные базы QTLbase). Аллель A SNP rs1801310 ассоциировался со снижением экспрессии GSS в коре мозга (P=0,0001), мозжечке (P=0,0001) и большеберцовой артерии (P=0,0002). Аллель Т полиморфизма rs6088660 был ассоциирован с увеличением экспрессии гена GSS большеберцовой артерии (P=2,3×10-7, данные GTEx портала) и крови (P=6,0×10-7 данные базы eQTLGen).
Согласно данным проекта ENCODE SNP rs6088660 расположен в области генома, которая вследствие химических модификацией (метилирование, ацетилирование) гистонов (гистоновые маркеры H3K4me2, H3K4me1, H3K4me3, H3K9ac и H3K27ac) способна влиять на экспрессию гена GSS в астроцитах головного мозга. Известно, что модификации гистонов H3K4me1, H3K4me2, H3K4me3 (метилирование) H3K9ac и H3K27ac (ацетилирование) связаны с увеличением промоторной активности генов [25, 26].
Биоинформатически анализ также позволил установить, что SNP rs6088660 охватывает область промотора гена GSS, активность которого выражена в тканях аорты и астроцитах согласно данным Regulatory Build (Ensembl). В отношении SNP rs6088660 также было предсказано, что наличие аллеля Т сопряжено с формированием участков связывания для комплекса транскрипционных факторов PITX1::HES7 и SRF согласно результатам анализа с помощью биоинформатического инструмента Variant Effect Predictor (Ensembl). Это является дополнительным доказательством того, что аллель T может быть связан с более выраженной, чем аллель С, транскрипционной активностью гена GSS. PITX1 и SRF представляют собой транскрипционные факторы, активирующие транскрипцию различных генов. В то же время транскрипционный фактор HES7 является репрессором, способным подавлять транскрипционную активность генов-мишеней.
Заключение. В ходе настоящего исследования впервые установлено, что полиморфные варианты гена глутатионсинтазы могут представлять собой значимые факторы риска развития ишемического инсульта. Однако выявленные нами ассоциации полиморфных вариантов rs1801310 и rs6088660 с риском развития болезни оказались пол-специфичными: данные SNPs ассоциировались с повышенным риском развития ИИ у мужчин и женщин, соответственно. Причины полового диморфизма могут быть связаны с различными факторами риска болезни у представителей разного пола. Подтверждением данного факта стал находка, демонстрирующая триггерное влияние курения на риск развития ИИ у женщин, являющихся носителями различных генотипов GSS. Не смотря на то, что исследованные полиморфизмы расположены в некодирующим участках гена, они характеризуются регуляторным потенциалом. Транскрипционная активность гена GSS может зависеть от исследованных аллельных вариантов в связи с тем, что они могут быть мишенями для регуляции посредством модификации гистонов, а также транскрипционных факторов, что проявляется изменениями экспрессии гена в различных тканях, в том числе тканях, имеющих патофизиологическое значение для развития ишемического инсульта. Несомненно, для подтверждения выявленных ассоциаций с риском развития ишемического инсульта, а также гипотез о механизмах регуляции генной экспрессии необходимы дальнейшие популяционные и экспериментальные
Благодарности
Исследование выполнено при финансовой поддержке Российского научного фонда (соглашение № 15‐15‐10010).




















Список литературы