Ассоциации полиморфных вариантов rs2305948 и rs1870377 гена рецептора фактора роста сосудистого эндотелия 2 типа (KDR) с риском развития ишемической болезни сердца
Aннотация
Актуальность: По данным статистики, первое место среди причин смертности во всем мире занимают сердечно-сосудистые заболевания (ССЗ), из которых большую долю составляют случаи ишемической болезни сердца (ИБС). В связи с этим, на сегодняшний день активно ведутся исследования по изучению ее ранее неизвестных этиологических аспектов. Особенно актуальным в условиях современности представляется поиск генетических маркеров заболевания, в перспективе потенциально применимых для ранней диагностики ИБС, а также установления наследственной предрасположенности к ней. Цель исследования: Изучить ассоциации полиморфных вариантов rs2305948 и rs1870377 гена KDR с риском развития ИБС у жителей Центральной России. Материалы и методы: В исследование было включено 1390 образцов ДНК: 635 больных ИБС и 755 здоровых людей. ДНК выделяли методом фенольно-хлороформной экстракции. Генотипирование ДНК-полиморфизмов проводилось с помощью ПЦР в реальном времени (Real-time PCR) с дискриминацией аллелей с помощью TaqMan-зондов. Использовали амплификатор CFX96 и наборы Applied Biosystems. Статистическая обработка результатов осуществлялась с использованием ресурсов программы SNPstats. Функциональное аннотирование SNPs мы проводили на базе доступных биоинформатических ресурсов. Результаты: Мы обнаружили, что существует половой диморфизм в связи KDR с развитием ИБС. Нами была установлена статистически значимая ассоциация генотипа A/T rs1870377 гена KDR с риском развития ИБС у мужчин. При биоинформатическом анализе мы выявили взаимосвязь полиморфизма rs1870377 с повышенной экспрессией гена SRD5A (фермента, конвертирующего тестостерон в дигидротестостерон), что может служить одной из причин гендерных особенностей при изучении риска ИБС в данном конкретном случае. Заключение: В рамках исследования впервые в российской популяции были изучены взаимосвязи полиморфных вариантов гена KDR с риском развития ИБС. Установлено, что полиморфизм rs1870377 гена KDR статистически значимо ассоциирован с повышенным риском развития ИБС у представителей мужского пола.
Ключевые слова: ишемическая болезнь сердца, ген сосудистого эндотелиального фактора роста 2 типа (KDR), однонуклеотидный полиморфизм (SNP), анализ ассоциации, половой диморфизм
Введение. По данным Всемирной организации здравоохранения (ВОЗ) основной причиной заболеваемости и смертности населения во всём мире (55%) являются обусловленные атеросклерозом сердечно-сосудистые заболевания, более 66% из которых представлены ишемической болезнью сердца, инсультом и заболеваниями периферических артерий [1]. В Российской федерации (РФ) в общей структуре заболеваемости также доминируют ССЗ, от которых в год умирает более 1 млн человек – 56,4% (в 6 раз больше, чем в развитых странах Европы, США и Японии). Доля ИБС в структуре смертности от ССЗ составляет 56,6 % у мужчин и 40,4% у женщин [1, 2]. Прогнозируется, что в 2020 г. смертность от ССЗ составит 22–25 млн, почти 50 % из которых придется на долю ИБС [1, 3, 4, 5].
Согласно российским клиническим рекомендациям, ИБС представляет собой поражение миокарда, вызванное нарушением кровотока по коронарным артериям [1]. Исходя из классификации форм ИБС, выделяют: внезапную сердечную смерть (первичная остановка сердца), стенокардию (напряженную, впервые возникшую, стабильную, прогрессирующую), инфаркт миокарда (ИМ) крупноочаговый, мелкоочаговый, постинфарктный кардиосклероз, сердечную недостаточность, нарушения сердечного ритма, позднее в эту классификацию была добавлена «безболевая ишемия миокарда» (БИМ). Сердечная недостаточность и нарушения сердечного ритма рассматриваются как самостоятельные варианты течения заболевания и диагностируются при отсутствии других симптомов ИБС [2]. Наиболее частой причиной развития ишемической болезни сердца (до 95%) является атеросклеротическое поражение крупных и средних коронарных артерий или атеротромбоз, которое может протекать со спазмом и без него. Патогенез атеросклероза чрезвычайно сложен и многие его звенья до сих пор остаются малоизученными или имеют различную интерпретацию. Обобщенные современные представления о патогенетическом механизме развития атеросклероза заключаются в том, что основу процесса составляет последовательное взаимодействие нескольких патогенетических факторов, ведущее в конечном счете к образованию фиброзной бляшки. Различают три основные стадии формирования атеросклеротической бляшки (атерогенез): стадия липоидоза (образование липидных пятен и полосок); стадия липосклероза (образование фиброзной бляшки); формирование осложненной атеросклеротической бляшки [2]. В настоящее время доказано, что наиболее значимыми факторами риска атеросклероза являются: дислипидемия, АГ (которая также имеет изученную генетическую компоненту) [3, 4], курение, ожирение, сахарный диабет [2, 5-8].
Собственно ИБС представляет собой мультифакториальное заблевание, развитие которого обусловлено сочетанным воздействием наследственных и средовых факторов [9]. Известно, что до 60% смертности от сердечно-сосудистой патологии зависит от распространённости в популяции так называемых факторов риска (ФР). Среди ФР выделяют: немодифицируемые и модифицируемые. ФР могут накапливаться у одного человека и взаимодействовать друг с другом, оказывая множественный эффект, что особенно характерно для представителей населения с низким социальным статусом, у которых в 5-7 раз возрастает вероятность наступления смерти от ССЗ [1, 9]. В развитии ИБС выделяют следующие ФР: биологические, образа жизни, общие фиксированные и общие модифицируемые. К биологическим ФР относят: повышенное артериальное давление (гипертоническая болезнь), повышение глюкозы крови (нарушение толерантности к глюкозе или сахарный диабет 2 типа), повышение холестерина в крови (дислипидемия, избыточная масса тела, абдоминальное ожирение), неблагоприятный психосоциальный статус (стрессы). К ФР образа жизни относят: курение, нерациональное питание, злоупотребление алкоголем, низкую физическую активность. К общим фиксированным ФР относят: генетические факторы, возраст старше 55 лет у женщин и старше 45 лет у мужчин, мужской пол, этническую принадлежность. К общим модифицируемым ФР относят: низкий уровень образования, низкий уровень дохода, неблагоприятные условия жизни и работы. Протективными факторами, в свою очередь, считаются регулярное употребление фруктов и овощей, регулярная физическая активность, а также умеренное потребление алкоголя [1].
Генетическая компонента ИБС активно исследуется во всем мире и на сегодняшний день установлен широкий спектр генов, ассоциированных с развитием заболевания: гены системы свертывания крови, провоспалительных цитокинов, дисфункции эндотелия, обмена липидов, сосудистого гомеостаза, факторов адгезии [10, 11, 12]. Среди генетических маркеров развития ИБС изучаются ассоциации однонуклеотидных полиморфизмов (SNPs) генов семейства сосудистых эндотелиальных факторов роста (VEGF). Мета-анализы генетических исследований показали, что SNPs гена VEGFA связаны с развитием ИБС в различных расовых и этнических группах. В частности, наиболее исследован вклад SNPs rs699947, rs3025039, rs1570360 в развитие заболевания [13, 14, 15]. В то же время как ген рецептора фактора роста сосудистого эндотелия 2 типа (KDR) изучался в большинстве работ в качестве фактора риска развития церебрального атеротромбоза, лакунарных инфарктов, внутримозговых кровоизлияний и геморрагического инсульта [16], и в значительно меньшей степени ИБС. В частности, в исследовании авторы [17] установили, что SNP 2305948 и SNP 1870377 статистически значимо связаны с пониженной функцией связывания KDR c VEGF. Ранее в Японии была исследована ассоциация выше указанных полиморфных вариантов с поражением коронарных артерий у больных болезнью Кавасаки [18]. Кроме этого, SNPs rs2305948 and rs1870377 рассматривались как маркеры ИБС еще в нескольких исследованиях [18, 19, 20]. Однако среди населения нашей страны ни в одном регионе в качестве потенциальных маркеров риска развития ИБС до настоящего времени никем не изучались SNPs гена KDR.
Цель исследования. Изучить ассоциации двух частых полиморфных вариантов rs2305948 и rs1870377 гена KDR с риском развития ишемической болезни сердца у жителей Центральной России, учитывая половой диморфизм.
Материалы и методы исследования. Объектом исследования была цельная венозная кровь.
Работа проводилась на базе лаборатории Научно-исследовательского института генетической и молекулярной эпидемиологии Курского государственного медицинского университета Минздрава России (НИИ ГМЭ КГМУ). В исследование было включено 1390 образцов ДНК, выделенной из крови биобанка НИИ Генетической и молекулярной эпидемиологии КГМУ. Выборка была представлена 635 образцами ДНК больных с подтвержденным диагнозом ИБС (45,7%), из которых 356 мужчин (56%) и 279 женщин (44%), а также 755 образцами ДНК относительно здоровых людей, не имеющих хронических заболеваний (54,3%), из которых 393 (52%) мужчин и 362 (48%) женщин. Основная часть пациентов были представителями русской национальности (более 90% от общего количества участников исследования) и коренными жителями Курской области. Все пациенты давали свое информированное согласие на участие в научном исследовании. Протокол настоящего исследования был одобрен Региональным этическим комитетом КГМУ на плановом заседании с составлением соответствующего протокола.
Все пациенты с диагнозом ИБС находились на стационарном лечении в кардиологическом отделении больницы скорой медицинской помощи г. Курска (ОБУЗ КГКБ СМП), а также в кардиологическом отделении и в отделении сосудистой хирургии и рентгенохирургических методов диагностики областной клинической больницы г. Курска (БМУ КОКБ), в период с 2011 по 2015 годы в рамках проведения генетико-эпидемиологических исследований ряда различных сердечно-сосудистых заболеваний [21-25]. Диагноз ИБС устанавливался квалифицированными врачами-кардиологами вышеуказанных медицинских учреждений на основании комплексного клинического обследования и инструментального обследования пациентов.
ДНК выделяли из цельной венозной крови методом фенольно-хлороформной экстракции. Два частых SNPs rs2305948 и rs1870377 гена рецептора фактора роста сосудистого эндотелия 2 типа (KDR) были включены нами в программу исследования. Генотипирование ДНК-полиморфизмов гена KDR проводилось по средствам ПЦР в реальном времени (Real-time PCR) с дискриминацией аллелей с помощью TaqMan-зондов. Для работы мы использовали амплификатор CFX96 (Bio-Rad, США) и коммерческие наборы Applied Biosystems (Thermo Fisher Scientific).
Статистическая обработка полученных нами данных проводилась с использованием электронных ресурсов программы SNPstats (https://www.snpstats.net/start.htm) [26]. При расчете равновесия Харди-Вайнберга использовали точный тест Фишера. Ассоциации аллелей и генотипов гена KDR с вероятностью развития заболевания оценивались с использованием следующих показателей: отношения шансов с 95%-м доверительным интервалом (OR 95% CI) и р-уровня значимости (р≤0,05). Учитывая половой диморфизм предрасположенности к ИБС, анализ ассоциаций проводился отдельно в группах мужчин и женщин. При оценке ассоциаций во всех расчетах вводили поправку на возраст.
Функциональное аннотирование SNPs мы проводили на базе доступных биоинформатических ресурсов. Для изучения QTLs (локусов количественных признаков), имеющих взаимосвязь с SNPs, мы использовали данные электронных баз данных (https://www.snpedia.com; https://www.ensembl.org/index.html; https://www.ncbi.nlm.nih.gov/; http://mulinlab.tmu.edu.cn/qtlbase/index.html).
Результаты и их обсуждение. Распределение частот генотипов в изучаемой популяции жителей Центральной России не имело значимых отклонений от равновесия РХВ (р>0,05). Для выявления и оценки возможных гендерных особенностей вклада SNPs rs2305948 и rs1870377 гена KDR при интерпретации результатов работы, мы разделили общую выборку на две (по полу). При всех расчетах мы вводили поправку на возраст.
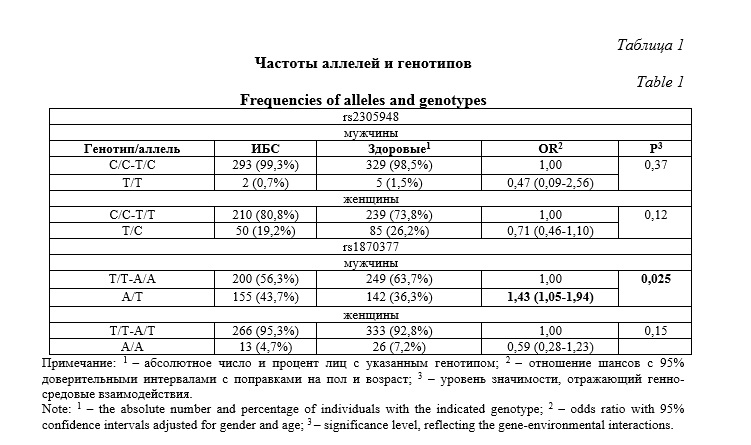
В таблице 1 представлена частота аллелей и генотипов в исследованных группах пациентов. Для rs2305948 статистически значимых ассоциаций с риском развития ИБС не наблюдалось (р ≥0,05). Однако SNP rs1870377 (генотип A/T) ассоциировался с повышенным риском развития ИБС (OR 1,43: 1,05-1,94, р=0,025). Причем, ассоциация данного SNP наблюдалась только среди представителей мужского пола. Мы проанализировали гаплотипы, образованные полиморфными вариантами rs2305948 и rs1870377 гена KDR (табл. 2). Статистически значимых ассоциаций гаплотипов гена KDR с риском развития ИБС не было установлено ни у мужчин, ни у женщин (р>0,05).

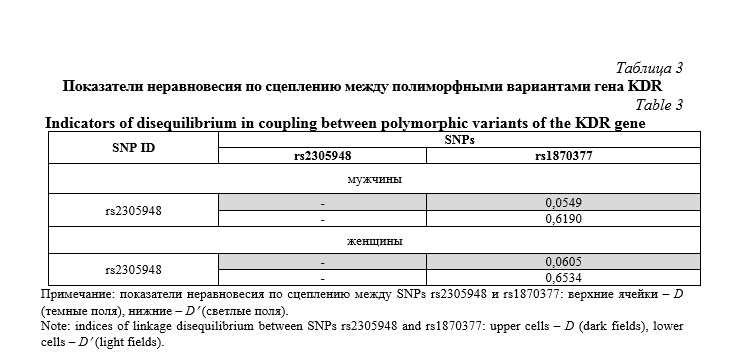
В таблице 3 представлены данные неравновесия по сцеплению (linkage disequilibrium, LD) между SNPs rs2305948 и rs1870377 гена KDR в разделенных по полу группах (P<0,05). SNPs rs2305948 находился в положительном неравновесии по сцеплению с rs1870377, как мужчин, так и у женщин.
Для функционального аннотирования SNPs нами использовались биоинформатические инструменты ресурса QTLbase (http://mulinlab.tmu.edu.cn/qtlbase/index.html), который не показал ассоциации аллелей rs1870377 с уровнем экспрессии гена KDR ни в одной из анализированных тканей. Однако было установлено, что аллель T SNP rs1870377 ассоциирован с повышенной экспрессией гена SRD5A3 в крови (P=1,51×10-4).
Продуктом экспрессии гена KDR является белок тирозинкиназа, который выполняет функцию рецептора фактора роста сосудистого эндотелия VEGF (VEGFA, VEGFC и VEGFD), таким образом, играя роль регулятора ангиогенеза, проницаемости стенки кровеносных сосудов, а также гематопоэза в эмбриональном развитии, активизирует пролиферацию, миграцию и дифференцировку эндотелиоцитов, влияет на реорганизацию актинового цитоскелета [27, 28, 29]. Изоформы 2 и 3 данного белка могут оказывать ингибирующее воздействие на VEGF, а именно изоформа 2 служит отрицательным регулятором ангиогенеза. Это обусловлено тем, что снижается количество свободных VEGFA и VEGFC, не происходит их связывания с FLT4 (рецептор тирозинкиназы для VEGFС и -D). Известно, что мутации в гене FLT4 вызывают возникновение наследственной лимфедемы [27]. Имеются данные, что снижение активности KDR коррелирует с сосудистой дисфункцией и может быть связано с развитием и прогрессированием атеросклероза. В исследовании, которое выполняла группа китайских ученых, было показано, что SNP rs2305948 и SNP rs1870377 ассоциированы со значительным снижением эффективности связывания VEGF с KDR. Предполагается, что снижение функции KDR провоцирует повреждение эндотелиоцитов, нарушение их выживаемости, а также снижение антиапоптотических эффектов VEGF и аномальное развитие сосудов [27, 28, 29]. Вышеизложенные факты могут косвенно указывать на прогрессирование атеросклеротического поражения сосудов на фоне ослабления эффекта KDR [17].
В настоящей работе мы обнаружили, что существует половой диморфизм в связи KDR с развитием ИБС у мужчин. По всей видимости, данный факт связан с особенностями развития атеросклеротического процесса у мужчин, лежащего в основе патогенеза ИБС. Известно, что существуют гендерные особенности подверженности ИБС и характера её течения [2, 8]. Среди женщин наиболее распространено поражение мелких коронарных артерий, в отличие от мужчин [2, 8]. Кроме того, у мужчин с возрастом степень поражения коронарных артерий значительно возрастает, а у женщин фактор старения не имеет ассоциации с усугублением коронарного атеросклероза. В научных исследованиях при проведении аутопсии группой ученых было доказано, что обструктивный характер поражения коронарных артерий менее распространен у женщин с ИБС (63%), чем у мужчин (77%) [2, 8, 30].
Проведенный нами биоинформатический анализ данных показал связь полиморфизма rs1870377 с повышенной экспрессией гена SRD5A. SRD5A3 – фермент полипренолредуктаза, который играет ключевую роль на ранних стадиях N-связанного гликозилирования белка, превращая полипренол в долихол (https://www.ncbi.nlm.nih.gov/pubmed/20637498). Интересно, что SRD5A3 – фермент, конвертирующий тестостерон в дигидротестостерон - самый мощный эндогенный андроген, обладающий в 2-5 раз большей способностью связываться с рецептором андрогена и в 10 раз более высокой эффективностью индуцировать передачу сигналов, опосредованную рецептором андрогена, чем тестостерон [31]. Однако для понимания феномена полового диморфизма в ассоциации rs1870377 гена KDR с развитием ИБС необходимо проведение функциональных генетических исследований пациентов различного пола с данными анатомо-морфологического строения коронарного кровообращения (результаты коронарографии).
Заключение. Таким образом, можно сказать, что проведенное нами исследование на популяции жителей региона Центральной России подтвердило обнаруженную ранее в азиатской популяции ассоциацию SNP rs1870377 гена KDR с риском развития ИБС. Вероятно, данная взаимосвязь может быть обусловлена несколькими известными причинами: снижением активности продукта экспрессии гена/снижением связываемости рецептора с VEGF, которое влечет ослабление его эффекта на сосудистую стенку и, как следствие – замедление антиапоптических процессов, нарушение восстановления поврежденного эндотелия, снижение выживаемости эндотелиоцитов и прогрессирование атеросклероза. Но необходимо подчеркнуть, что для обобщения, сравнения и анализа результатов исследований в рамках темы вклада полиморфизма гена KDR в риск развития ИБС, требуется расширение теоретической базы по данному вопросу за счет аналогичных работ на популяциях других регионов. Дальнейшие исследования могли бы пролить свет на природу полового диморфизма во взаимосвязи гена KDR с развитием коронарного атеросклероза.
Информация о финансировании
Исследование выполнено при финансовой поддержке Курского государственного медицинского университета.
Благодарности
Выражаем благодарность сотрудникам и руководству Научно-исследовательского института генетической и молекулярной эпидемиологии (НИИ ГМЭ) Курского государственного медицинского университета Минздрава России за содействие в выполнении настоящего исследования. Автор выражает благодарность профессору кафедры биологии, медицинской генетики и экологии Курского государственного медицинского университета, д.б.н., Солодиловой Марии Андреевне за научное руководство и поддержку при проведении научного исследования




















Список литературы