Полиморфизм rs34845949 гена SASH1 ассоциирован с риском развития преэклампсии
Aннотация
Актуальность: Преэклампсия (ПЭ) – мультисистемное патологическое состояние, возникающее во второй половине беременности (после 20-й недели), характеризующееся артериальной гипертензией в сочетании с протеинурией (≥0,3 г/л в суточной моче), нередко, отеками и проявлениями полиорганной/полисистемной дисфункции/недостаточности. Цель исследования: Оценить связи полиморфизма дифференциально экспрессирующихся генов плаценты с риском формирования преэклампсии. Материалы и методы: Для проведения исследования была сформирована выборка из 366 беременных с преэклампсией и 631 женщин контрольной группы. Мультиплексное генотипирование однонуклеотидных полиморфизмов (SNP) дифференциально экспрессирующихся генов плаценты было осуществлено с помощью метода массспектрометрии MALDI-TOF. Для исследования было отобрано 7 SNPs четырех генов (PAPPA2, SASH1, RDH13, PPP1R12C). Для оценки ассоциаций SNPs с риском формирования преэклампсии использовали лог-линейный регрессионный анализ в рамках трех генетических моделей (аддитивная, рецессивная, доминантная). Результаты: Установлено, что аллель С rs34845949 SASH1 связан с развитием преэклампсии в рамках аддитивной (ОШ=1,27, 95%ДИ 1,01-1,59, р=0,042) и доминантной (ОШ=1,35, 95%ДИ 1,01-1,82, р=0,043) моделей взаимодействия аллелей. Также выявлено, что rs34845949 SASH1 обладает важным регуляторным значением: расположен в сайте модифицированных гистонов в областях энхансеров в 6 тканях, в ДНКаза-гиперчувствительном сайте в 7 тканях, сайте связывания с регуляторным белком USF1, в домене связывания с двумя факторами транскрипции: Foxl1_1, Pou2f2_known11. Заключение: Аллель С rs34845949 SASH1 является фактором риска развития преэклампсии (OR=1,27-1,35) у беременных Центрально-Черноземного региона России.
Введение. Преэклампсия (ПЭ) – мультисистемное патологическое состояние, возникающее во второй половине беременности (после 20-й недели), характеризующееся артериальной гипертензией в сочетании с протеинурией (≥0,3 г/л в суточной моче), нередко, отеками и проявлениями полиорганной/полисистемной дисфункции/недостаточности [1]. Как свидетельствуют литературные данные, частота встречаемости преэклампсии во всем мире составляет 2-8 % [2]. ПЭ является одной из основных причин материнской смертности и перинатальных смертей [2, 3]. Тяжелая преэклампсия и эклампсия значительно увеличивают риск развития отслойки плаценты, ДВС-синдрома, отека легких, острой почечной и печеночной недостаточности, кровоизлияний и отеков головного мозга и др. [2]. Дети, родившиеся после преэкламптических беременностей, имеют низкий вес и высокий риск развития ряда неинфекционных хронических заболеваний [2, 4, 5].
Многочисленные исследования указывают на мультифакториальность преэклампсии, что предполагает оценку генетического компонента в её формировании. Поиск генов-кандидатов основан на их возможной роли в патогенезе преэклампсии [6, 7, 8]. Так как в формировании преэклампсии важную роль отводят развитию окислительного стресса и воспалительного процесса, приводящих к эндотелиальной дисфункции, многие исследования направлены на поиск генов-кандидатов, участвующих в этих процессах: гены эндотелиальной дисфункции [9, 10, 11], гены вазоактивных факторов [12], гены иммунных и воспалительных реакций [13], гены окислительного стресса [14, 15], гены липидного обмена [16], гены ренин-ангиотензин-альдостероновой системы [17-20], гены наследственных тромбофилий [17, 21-24].
Цель исследования. Оценить связи полиморфизма дифференциально экспрессирующихся генов плаценты с риском формирования преэклампсии.
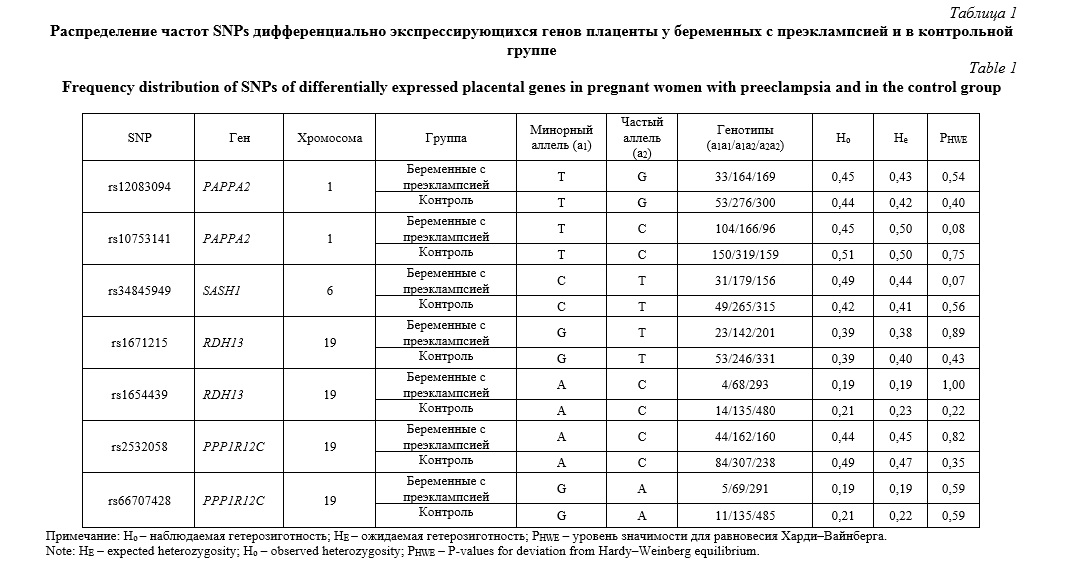
Материалы и методы исследования. Для проведения исследования была сформирована выборка из 366 беременных с преэклампсией и 631 женщин контрольной группы. В исследованные выборки вошли женщины русской национальности, родившиеся в Белгородской области, не имевшие родственных связей, и проживающие в Центрально-Черноземном регионе России [25]. Информированное согласие было получено от каждого участника до включения в исследование. Клиническое и лабораторное обследование женщин проводились в перинатальном центре Белгородской областной клинической больницы. Критериями включения в исследуемую выборку были: (а) русская национальность, (б) срок беременности 37-40 недель. Беременные с диагнозом сахарный диабет, печеночная или почечная недостаточность были исключены из исследования. Изучаемые параметры включали: возраст, вес, индекс массы тела, рост. Средний возраст беременных с ПЭ был выше на 0,75 лет в сравнении с женщинами группы контроля (27,32±5,17 лет и 26,57±4,94 лет, соответственно, р<0,05). Также в данной группе значения ИМТ были выше, чем в контроле (25,65±5,71 кг/м2 и 23,40±3,47 кг/м2, соответственно, р<0,05).
Уровень артериального давления (АД, мм. рт. ст.) измерялся трехкратно в положении пациента сидя на обеих руках с интервалом не менее минуты, среднее из двух последних измерений принималось за конечное значение АД. Данные об уровне АД до беременности были получены из амбулаторной карты каждого участника исследования. Преэклампсия определялась как наличие артериальной гипертензии (систолическое АД ≥ 140 мм. рт. ст. и/или диастолическое АД ≥ 90 мм. рт. ст.), протеинурии (≥0,3 г/л в суточной моче) и отеков.
Забор крови для выделения геномной ДНК (5 мл) осуществлялся из локтевой вены в пластиковую пробирку (Vacutainer®) с 0,5 М раствором ЭДТА. Геномная ДНК была выделена из лейкоцитов с использованием метода фенол-хлороформной экстракции, концентрация и качество выделенной ДНК оценивались при помощи спектрофотометра Nanodrop 2000 (Thermo Scientific, Inc.). Мультиплексное генотипирование однонуклеотидных полиморфизмов (SNP) дифференциально экспрессирующихся генов плаценты было осуществлено с помощью метода массспектрометрии MALDI-TOF. Для исследования было отобрано 7 SNPs четырех генов: паппализин 2 (ассоциированный с беременностью плазменный протеин А2) (rs12083094 PAPPA2, rs10753141 PAPPA2), SAM-SH3-домен-содержащий белок 1 (rs34845949 SASH1), ретинолдегидрогеназа 13 (rs1654439 RDH13, rs1671215 RDH13), субъединица 12C протеинфосфатазы 1 (rs2532058 PPP1R12C, rs66707428 PPP1R12C). Данные SNPs были включены в исследование, так как имеют важное регуляторное значение и оказывают существенное влияние на экспрессию генов [26]. С использованием онлайн-ресурсов HaploReg (v4.1) (https://pubs.broadinstitute.org/mammals/haploreg/haploreg.php) и Genotype-Tissue Expression (GTEx) GTExportal (http://www.gtexportal.org/) были изучены регуляторный потенциал исследуемых SNPs и их влияние на экспрессию генов. Оценку связей изученных SNPs с уровнем транскрипции генов проводили с помощью методики, описанной в работах [27, 28]. Для оценки ассоциаций SNPs с риском формирования преэклампсии использовали лог-линейный регрессионный анализ в рамках трех генетических моделей (аддитивная, рецессивная, доминантная). Анализ проводили с учетом коррекции на кофакторы: возраст, индекс массы тела, возраст наступления менархе, количество артифициальных абортов, количество мертворождений, количество выкидышей, артериальная гипертензия в анамнезе, преэклампсия в анамнезе, курение.
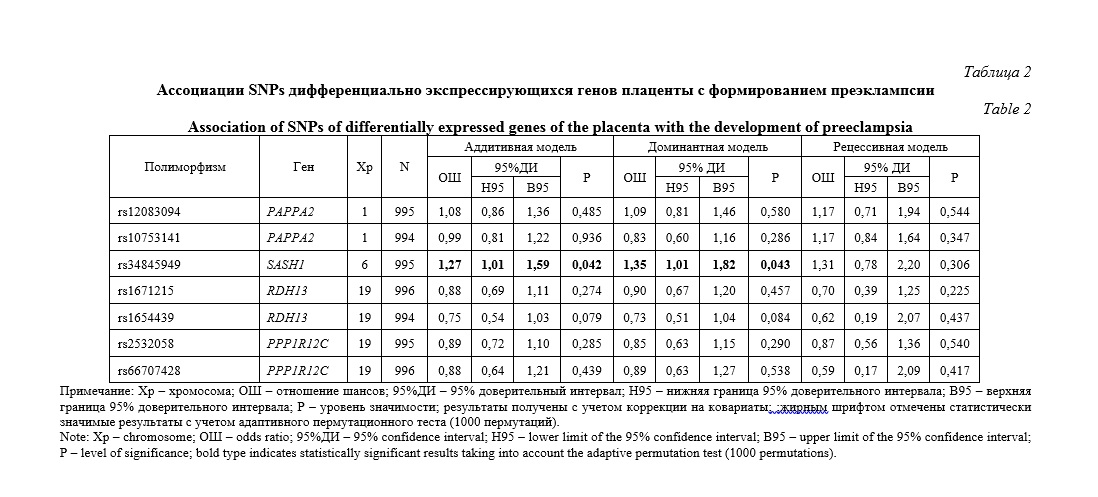
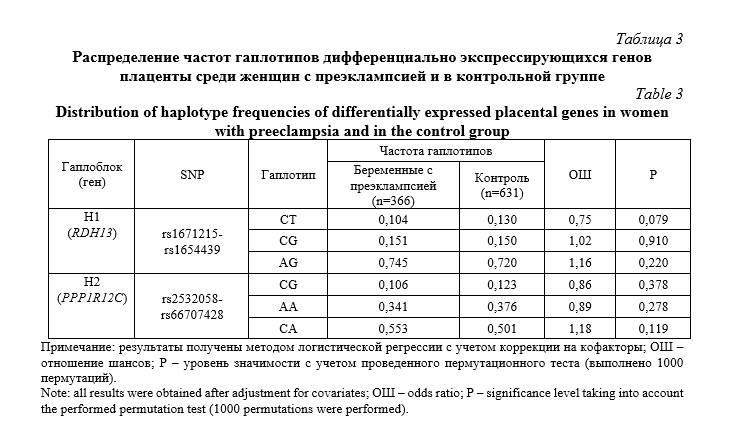
Результаты и их обсуждение. Распределение частот исследованных SNPs у беременных с преэклампсией и в контрольной группе представлены в таблице 1. Установлено, что наблюдаемое распределение частот аллелей и генотипов находились в соответствии с равновесием Харди Вайнберга (р>0,05). Ассоциации SNPs дифференциально экспрессирующихся генов плаценты с формированием преэклампсии отражены в таблице 2. Выявлено, что полиморфный локус rs34845949 SASH1 ассоциирован с формированием преэклампсии в рамках аддитивной (ОШ=1,27, 95%ДИ 1,01-1,59, р=0,042) и доминантной (ОШ=1,35, 95%ДИ 1,01-1,82, р=0,043) моделей взаимодействия аллелей. С помощью алгоритма «Confidence intervals» c уровнем коэффициента сцепления D´>0,8 определены гаплоблоки по исследованным SNPs. Выявлены гаплоблок H1, включающий rs1671215 и rs1654439 гена RDH13 (19 хромосома), и гаплоблок H2, включающий rs2532058 и rs66707428 гена PPP1R12C (19 хромосома). Анализ связей гаплотипов в выявленных гаплоблоках с формированием ПЭ показал отсутствие ассоциаций с развитием данного осложнения беременности (табл. 3).
На следующем этапе работы с использованием онлайн-ресурсов HaploReg (v4.1) и GTExportal были оценены регуляторные эффекты и влияние на экспрессию генов локуса rs34845949 SASH1, связанного с риском формирования преэклампсии. Установлено, что rs34845949 SASH1 расположен в сайте модифицированных гистонов в областях энхансеров в 6 тканях, в ДНКаза-гиперчувствительном сайте в 7 тканях, сайте связывания с регуляторным белком USF1, в TF-связывающем домене для двух TFs: Foxl1_1, Pou2f2_known11. Различия между LOD scores аллелей С и Т для Foxl1_1 – 1,0, для Pou2f2_known11 – -1,6. Следовательно, аллель С rs34845949 SASH1 обуславливает повышение аффинности к Foxl1_1, а аллель Т rs34845949 SASH1 – повышение афинности к Pou2f2_known11. Также с данным полиморфным маркером находится в неравновесии по сцеплению rs35774187 SASH1 (r2=0,99), локализованный в сайте модифицированных гистонов в областях энхансеров в 7 тканях, в ДНКаза-гиперчувствительном сайте в 11 тканях, сайте связывания с регуляторным белком STAT3.
В нашей работе обнаружены ассоциации полиморфизма rs34845949 SASH1 с формированием ПЭ, выявлено важное регуляторное значение данного SNP. Ген SASH1 кодирует SAM-SH3-домен-содержащий белок 1, участвующий в сигнальном пути толл-подобных рецепторов (TLR4), которые могут стимулировать продукцию цитокинов и миграцию эндотелиальных клеток в ответ на вторжение патогенов. Данный белок также был описан как потенциальный супрессор опухоли, который может регулировать пролиферацию, апоптоз и инвазию раковых клеток [29]. Результаты исследований показывают, что ген SASH1 может также ингибировать пролиферацию, миграцию и инвазию клеток трофобласта и способствовать их апоптозу [30, 31]. Следовательно, повышенная экспрессия SASH1 во время развития плаценты может приводить к нарушению процессов инвазии трофобластных клеток и ремоделирования спиральных артерий, что лежит в основе этиопатогенеза преэклампсии. Эти предположения согласуются с результатами исследований, в которых была выявлена более высокая экспрессия SASH1 в плаценте у женщин с преэклампсией в сравнении с контрольной группой [32, 33, 34]. Исследования по поиску ассоциаций rs34845949 SASH1 с риском развития преэклампсии были проведены только в работе Серебровой и др. (2016) [35], в которой на популяции из трех этнических групп (русские, якуты и буряты) была выявлена повышенная частота встречаемости генотипа СС rs34845949 SASH1 у якутов в группе беременных с ПЭ по сравнению контрольной группой.
Заключение. Аллель С rs34845949 SASH1 является фактором риска развития преэклампсии (OR=1,27-1,35) у беременных Центрально-Черноземного региона России. Ассоциации данного SNP с формированием преэклампсии обусловлены его важным регуляторным значением: rs34845949 SASH1 расположен в сайте модифицированных гистонов в областях энхансеров, в ДНКаза-гиперчувствительном сайте, сайте связывания с регуляторным белком, в домене связывания с факторами транскрипции.
Информация о финансировании
Работа выполнена при финансовой поддержке гранта Президента Российской Федерации для ведущих научных школ Российской Федерации (проект НШ-2609.2020.7).




















Список литературы