Ассоциация полиморфизма генов STAT3, IL10 и IL12B с вирусной нагрузкой среди женщин с вирусом папилломы человека
Aннотация
Актуальность: Инфекция ВПЧ приводит к дисбалансу про- и противовоспалительных цитокинов, что способствует долговременной персистенции вируса в инфицированных клетках. Цель исследования:Изучить связь между полиморфизмами генов STAT3 G>C (rs2293152), IL10 -1082G>A (rs1800896) и IL12B 1188A>C (rs3212227) с высокой вирусной нагрузкой вируса папилломы человека и влияние межгенных взаимодействий на длительную инфекцию вируса папилломы человека. Материалы и методы:104 женщины с высокой вирусной нагрузкой ВПЧ и 110 здоровых женщин были вовлечены в исследование случай-контроль. Генотипирование для генов IL10 -1082G>A, IL12B 1188A>C проводили методом аллель-специфичной амплификации; исследование rs2293152 гена STAT3 проводили путем анализа полиморфизма длин рестрикционных фрагментов. Анализ межгенных взаимодействий проводили с помощью алгоритма многофакторного снижения размерности (MDR). Результаты:Исследование отдельных ОНП генов STAT3 G>C (rs2293152), IL10 -1082G>A (rs1800896) и IL12B 1188A>C (rs3212227) не выявило статистически значимой разницы в частотах генотипов и аллелей среди женщин с высокой нагрузкой ВПЧ и контрольной группы. MDR анализ показал значимость межгенных взаимодействий исследуемых локусовrs2293152 - rs1800896 - rs3212227 для формирования высокой нагрузки ВПЧ (OR=2,62, 95%=1,51-4,57, p=0,0006, pbonf =0,002). Заключение:Взаимодействие генов STAT3 (rs2293152) - IL10 (rs1800896) - IL12B (rs3212227) ассоциировано с риском высокой нагрузки ВПЧ среди женщин
Ключевые слова: вирус папилломы человека (ВПЧ), цитокины, вирусная нагрузка, полиморфизм генов, STAT3, IL10, IL12B
Введение. Длительная персистенция вируса папилломы человека (ВПЧ) является основной причиной развития рака шейки матки (РШМ). Наиболее распространенными типами ВПЧ высокого риска являются 16, 18, 31, 33, 35, 45, 52 и 58. Из них два типа ВПЧ16 и ВПЧ18 вызывают от 70% до 72% инвазивного рака шейки матки [1]. По оценкам, распространенность инфекции ВПЧ среди молодых женщин в мире достигает 40-80% [2]. Однако не у всех инфицированных женщин развивается рак. Кроме того, средний период времени от инфицирования канцерогенным ВПЧ до инвазивного рака шейки матки составляет 25–30 лет или более [3]. Ключевым этапом канцерогенеза, связанного с папилломавирусом, является длительная персистенция вируса [4], что может привести к развитию инвазивного рака шейки матки [5]. Механизм контроля и управления инфекцией ВПЧ включает регулирование изменений в продукции цитокинов [6]. Воспалительный процесс, вызванный инфекцией ВПЧ, приводит к изменению уровня про- и противовоспалительных цитокинов [7, 8]. Изменение уровня продукции цитокинов в результате персистирующей инфекции ВПЧ может вызывать гиперплазию местного эпителия сосудов и активацию JAK-STAT сигнального пути [9], а также NF-κB-сигнального пути [10]. Активация STAT3 в микроокружении опухоли способствует росту неопластического эпителия, активации воспалительных реакций и подавлению противоопухолевого иммунного ответа хозяина [11]. ВПЧ постоянно активирует сигнальный путь STAT3, создавая таким образом супрессорную среду для Т-клеток [12]. Кроме того, несколько исследований показывают, что персистенция ВПЧ высокого риска способствует уменьшению активности Th1-клеток (синтезируют ИЛ-12, ИЛ-2, ИФН-гамма и ФНО‑альфа) и увеличению Th2, Th17 и регуляторных Т-клеток (Treg-клетки) (синтез ИЛ- 4, ИЛ-10, ИЛ-17, ИЛ-23 и ТРФ-β 1), что приводит к дисбалансу клеток Th1 / Th2 и Th17 / Treg и слабому клеточному иммунному ответу на ВПЧ. Таким образом, возникают условия, способствующие развитию поражений эпителия шейки матки и рака шейки матки [13]. Сигнальный белок STAT3 в основном активируется фосфорилированием консервативного остатка тирозина в положении Tyr705 или серина 727 с помощью JAK-киназ, что приводит к димеризации и транслокации в ядро и связыванию с ДНК. В результате экспрессируются гены, регулирующие пролиферацию, дифференцировку и апоптоз клеток [14]. ИЛ-10, противовоспалительный цитокин, в основном известен своим действием на регулирование баланса Th1/Th2 с преобладающим действием на субпопуляцию Th1 [15]. ИЛ-12 состоит из двух субъединиц, p35 (ИЛ-12A) и p40 (ИЛ-12B). Субъединица р40 (ИЛ-12В) также входит в состав интерлейкина 23 [16]. ИЛ-12 является важным цитокином типа Th1, модулирующим иммунный ответ, ИЛ-12 обладает противовирусной и противоопухолевой активностью [17]. Было показано, что ИЛ-23 способствует активации хелперных Т-клеток, называемых Th17 [18]. Клетки Th17 характеризуются выработкой ряда специфических цитокинов, не продуцируемых клетками Th1 или Th2, включая ИЛ-17A, ИЛ-21 и ИЛ-22 [19]. Однонуклеотидные полиморфизмы (ОНП) считаются одной из причин дисбаланса продукции цитокинов [20, 21]. Согласно базе данных NCBI ОНП, 107 ОНП были идентифицированы в гене STAT3 человека, один из которых rs2293152 расположен в 11 интроне гена STAT3. Он классифицируется как синонимический полиморфизм [22]. Существует несколько ОНП в промоторной области IL10, один из идентифицированных ОНП -1082G>A (rs1800896) играет важную роль в изменении активации транскрипции. Аллель -1082A ассоциирована со снижением транскрипционной активности промотора IL10 по сравнению с аллелем G [23]. rs3212227 является одним из полиморфизмов в гене IL12B. Данный ОНП расположен в 3'-нетранслируемой области, он не изменяет кодирующую последовательность, но связан со снижением стабильности мРНК и может нарушать сайленсеры экзонного сплайсинга [24, 25]. Папилломатоз человека, по-видимому, является полигенным заболеванием, а это означает, что частые генетические варианты с небольшими эффектами могут оказывать влияние на риск развития заболевания [26].
Цель исследования. Настоящее исследование направлено на изучение возможной ассоциации rs2293152 STAT3 G>C, rs3212227 1188A>C IL12B и rs1800870 -1082A>G гена IL10 с формированием высокой вирусной нагрузки ВПЧ.
Материалы и методы исследования. Материалом для исследования послужили образцы ДНК, выделенные из эпителиальных клеток урогенитального тракта 214 женщин. Женщины были разделены на две группы: женщины с высокой нагрузкой ВПЧ (n =104), концентрация ВПЧ – более 103 копий ДНК на 105 клеток человека) и женщины с отрицательным результатом ВПЧ-тестирования (n =110). Все женщины, включенные в исследование, были старше 30 лет. Все собранные образцы соскобов эпителиальных клеток из урогенитального тракта женщин для исследования случай-контроль были предоставлены клинико-диагностической лабораторией Наука (Ростов-на-Дону, Россия) с сентября 2016 года по ноябрь 2019 года. Все женщины подписали письменное информированное согласие на участие в исследовании. Исследование одобрено Комитетом по биоэтике Академии биологии и биотехнологии Южного федерального университета (протокол № 2 от 29 марта 2016 г). Все тесты для клинических экспериментов проводились в соответствии со стандартами и этическими принципами Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики. Тотальную ДНК выделяли из соскобов эпителиальных клеток цервикального канала женщин согласно протоколу набора реагентов ДНК-сорб-АМ (НекстБио, Россия). Для количественной оценки ДНК ВПЧ высокого риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 типы) в биологическом материале использовали тест-систему «АмплиСенс ВПЧ ВКР скрин-титр-FL». (Интер-лабсервис, Россия). Выявление аллельных вариантов генов IL10 -1082G>A (rs1800896), IL12B 1188A>C (rs3212227) проводили методом аллель-специфичной амплификации с использованием реагентов SNP-экспресс (Литех, Россия) (рисунок 1).

Для определения генотипа по rs2293152 гена STAT3 использовали анализ полиморфизма длины рестрикционных фрагментов (ПДРФ). Реакцию амплификации проводили в 25 мкл реакционной смеси, содержащей 3 мкл геномной ДНК. 2,5 мкл 2,5 мМ dNTP, 2,5 мкл 25 мМ MgCl2, 2,5 мкл буфера Б для ПЦР, 15,2 мкл ddH2O, 0,3 мкл полимеразы Taq (5 Е/мкл) и 1,0 мкл ммоль /л каждого праймера (Синтол, Россия). Режим амплификации: 95°C – 5 минут; далее 40 циклов, где денатурация – 95°C по 30 секунд, отжиг – 59°C по 30 секунд и элонгация – 72°C по 30 секунд; финальная элонгация – 72°C в течение 5 минут. Продукты амплификации подвергали воздействию рестриктазы HpaII. Рестрикционная смесь включала 17 мкл H2O, 2 мкл 10× FastDigest Green Buffer, 1 мкл рестриктазы HpaII (СибЭнзим, Россия) и 10 мкл ПЦР-продукта. Смесь инкубировали при 37 ⁰С в течение 30 минут, инактивирование рестриктазы проводили при 55 ⁰С. Анализ длин рестрикционных фрагментов проводили в 3% агарозном геле с использованием трансиллюминатора Gel Doc (BioRad, США). Гомозиготы GG по полиморфизму rs2293152 гена STAT3 не имеют сайта рестрикции для рестриктазы HpaII, соответственно на электрофореграмме выявляется один фрагмент размером 214 п.н. Для гомозигот СС на электрофореграмме выявляются два рестрикционных фрагмента длиной 132 и 82 п.н. Гетерозиготы по rs2293152 гена STAT3 (генотип GC) дают три типа продуктов (рисунок 2).

Частоты аллелей и генотипов генов STAT3 G>C rs2293152, IL10 -1082G>A rs1800896 и IL12B 1188A>C rs3212227 в группе женщин с высокой вирусной нагрузкой ВПЧ сравнивали с ВПЧ-негативными женщинами с помощью критерия хи-квадрат. Тест на соблюдение равновесия Харди-Вайнберга был проведен путем сравнения наблюдаемых частот генотипов с ожидаемыми частотами генотипов. Ассоциацию SNP с риском формирования высокой вирусной нагрузки оценивали с помощью критерия хи-квадрат, отношения шансов (OR) и его доверительного интервала. Различия считали статистически значимыми при p<0,05. Статистический анализ проводили с использованием программы GraphPad InStat 3,05. Межгенные взаимодействия между полиморфными вариантами генов STAT3 G>C rs2293152, IL10 -1082G>A rs1800896 и IL12B 1188A>C rs3212227 в ВПЧ-положительной и контрольной группах анализировали с использованием алгоритма многофакторного уменьшения размерности (MDR) (версия 3,0,2).
Для минимизации статистической ошибки первого типа при анализе межгенных взаимодействий была введена поправка на множественность сравнений (поправка Бонферрони), которая находилась делением исходного уровня значимости p (α = 0,05) на количество исследованных комбинаций генотипов рассматриваемых трех локусов равное 25. Различия считались значимыми, если соответствующие им значения p были меньше или равны 0,002.
Результаты и их обсуждение. Средний возраст женщин составил 39,9 ± 7,6 лет в группе с высокой вирусной нагрузкой ВПЧ и 41,3 ± 7,7 лет в группе контроля. Среди 104 женщин, инфицированных ВПЧ, максимальная, средняя и минимальная нагрузка ДНК ВПЧ составляли 8,5, 5,1 и 3,2 log геномов ВПЧ на 100 тысяч клеток человека соответственно. Распределение частот генотипов и аллелей для трех исследованных полиморфизмов генов STAT3 G>C rs2293152, IL10 -1082G>A rs1800896 и IL12B 1188A>C rs3212227 приведено в таблице 1.

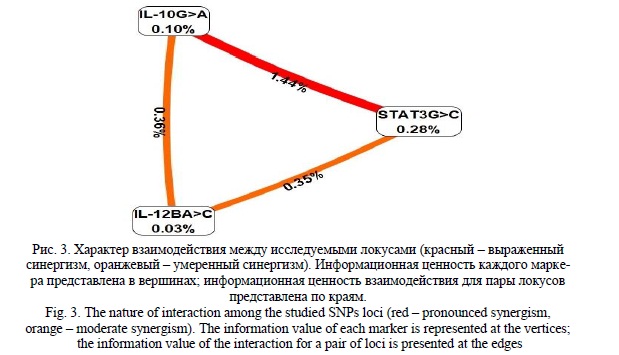
Совместное присутствие нескольких аллельных вариантов генов, кодирующих функционально связанные белковые молекулы, может приводить к формированию нового фенотипа из-за незначительных, но многочисленных взаимосвязанных изменений в геноме и функционировании протеома. Поэтому мы провели анализ межгенных взаимодействий аллельных вариантов генов цитокинов. Анализ межгенных взаимодействий показал, что трехлокусная модель взаимодействия генов STAT3 (rs2293152) - IL10 (rs1800896) - IL12B (rs3212227) ассоциирована с риском высокой нагрузки ВПЧ среди женщин (OR=2,62, 95%=1,51-4,57, p=0,0006, pbonf =0,002). Данная модель имеет точность предсказания 62% и согласованность перекрестной проверки 10/10. Между исследуемыми локусами выявлен синергизм (Рисунок 3). На рисунке 4 приведены комбинации генотипов в рамках трехлокусной модели взаимодействия генов STAT3 (rs2293152) - IL10 (rs1800896) - IL12B (rs3212227) ассоциированой с риском высокой нагрузки ВПЧ среди женщин.

Высокая вирусная нагрузка у ВПЧ-положительных женщин указывает на то, что вирус не был элиминирован и эффективно реплицируется в клетках организма в течение длительного времени [27]. Длительная персистенция вируса приводит к интеграции ДНК ВПЧ в геном человека, экспрессии онкогенных белков E6 и E7 и развитию рака [28]. Несколько исследований указали на повышенный риск прогрессирования интраэпителиального новообразования шейки матки у ВПЧ-положительных женщин с высокой вирусной нагрузкой [29, 30]. Во многих исследованиях сообщается, что экспрессия STAT3 увеличивается с прогрессированием стадии рака шейки матки. Выявлена значимая корреляция между наличием ВПЧ и экспрессией STAT3 [31]. Фосфорилирование тирозина STAT3 резко возрастает от цервикальной интраэпи-телиальной неоплазии низкой степени (CIN1) до преинвазивных (CIN3) поражений [32]. Аберрантное фосфорилирование STAT3 по тирозину 705 или серину 727 с помощью киназ приводит к гиперактивации белка STAT3 [33]. Таким образом, STAT3 может быть вовлечен в онкогенез непосредственно через стимулирование пролиферации опухолевых клеток и косвенно через подавление защитного иммунного ответа на инфекцию ВПЧ [34]. rs2293152, расположенный в 11 интроне гена STAT3, может оказывать влияние на уровень транскрипции гена или процесс сплайсинга мРНК. Результаты метаанализа, выполненного Yan с коллегами [35], показали, что европеоиды с генотипом CG или GG по полиморфизму STAT3 rs2293152 имели более высокий риск развития рака. В нашем исследовании не выявлено ассоциации полиморфизма rs2293152 гена STAT3 с формированием высокой вирусной нагрузки ВПЧ. ИЛ-10 является общей мишенью для многих вирусов, пытающихся обойти иммунную систему человека [36]. Кроме того, повышенная экспрессия IL10 у пациентов с плоскоклеточными интраэпителиальными поражениями и раком шейки матки отражает локальное состояние иммуносупрессии в эпителии шейки матки [37]. Полиморфизм -1082G>A изменяет эффективность связывания промоторного участка с фактором транскрипции и влияет на транскрипционную активность промотора IL10 [38]. В нашем исследовании связи полиморфизма -1082G>A (rs1800896) с высокой вирусной нагрузкой ВПЧ не обнаружено. Полученные нами данные согласуются с данными литературы. В частности, Farzaneh с коллегами и Chagasa с коллегами [39, 40] не выявили различий в частоте полиморфизма IL10 -1082G>A у женщин Великобритании и Бразилии, соответственно, инфицированных ВПЧ и неинфицированных ВПЧ. В то же время в нескольких исследованиях сообщается о взаимосвязи между наличием аллеля -1082A и низким уровнем экспрессии IL10, что увеличивает риск рака шейки матки [41, 42]. Основная противоопухолевая активность ИЛ-12 зависит от его способности стимулировать Th1-иммунитет и ответы цитотоксических Т-лимфоцитов. Более того, ИЛ-12 может нарушать механизм ангиогенеза в опухолях, подавляя проангиогенные сигналы [43]. Сообщалось о противоположной роли ИЛ-23 в канцерогенезе по сравнению с ИЛ-12. В то время как ИЛ-12 облегчает инфильтрацию опухоли CD8+ Т-клетками, ИЛ-23 снижает CD8+ T-клетки в опухоли и способствует ангиогенезу опухоли [44]. Передача сигналов STAT3 в микроокружении опухоли индуцирует проканцерогенный цитокин, ИЛ-23, в то же время ингибируя центральный антиканцерогенный цитокин ИЛ-12, тем самым смещая баланс опухолевого иммунитета в сторону канцерогенеза [45]. Было показано, что полиморфизм 1188А>С (rs3212227) гена IL12B является функционально значимым, поскольку аллель C связан с более низкой стабильностью мРНК [46], и более низкой продукцией полипептида p40, что может приводить к изменению уровня ИЛ-12 и ИЛ-23 [47]. В нашем исследовании связи полиморфизма IL12B 1188A>C с высокой нагрузкой ВПЧ не обнаружено. Полученные нами данные согласуются с данными литературы. Han с коллегампи [48] не выявили разницы в частоте полиморфизма IL12B 1188A>C у пациентов из Кореи с инвазивным раком шейки матки (n = 154) и контрольной группы без рака (n=191). В то же время в нескольких исследованиях сообщалось о взаимосвязи между полиморфизмом IL12B 1188A>C и повышенным риском рака шейки матки [49, 50]. К благоприятным условиям для персистенции вируса относится сочетание множественных замен полиморфных локусов в генах, кодирующих факторы иммунной системы человека. В нашей работе MDR анализ показал значимость взаимодействия исследуемых локусов для формирования высокой вирусной нагрузки. Это обусловлено функциями кодируемых белков и может быть связано с изменением уровня транскрипции генов цитокинов, возможным нарушением процессов сплайсинга, изменением баланса про- и противовоспалительных цитокинов, что, в и тоге, приводит к снижению иммунного ответа при ВПЧ-инфицировании. В результате увеличивается вирусная нагрузка ВПЧ и повышается риск злокачественной трансформации эпителиальных клеток. Во время инфекции ВПЧ через Stat3 реализуется один из основных сигнальных путей. Экспрессия ИЛ-10 и ИЛ-12 связана со STAT3. Генотип по полиморфизму rs2293152 STAT3 может влиять на степень активации воспалительного сигнального пути. В свою очередь, соотношение уровней провоспалительных и противовоспалительных цитокинов определяет вероятность «ухода» ВПЧ-пораженных клеток из-под иммунологического контроля [51]. В нескольких исследованиях сообщалось, что одновременное присутствие аллелей G и C для STAT3 увеличивает риск рака шейки матки [52]. Аберрантная активация STAT3 подавляет противоопухолевый иммунитет, ингибируя экспрессию многих цитокинов (например, ИЛ-12, который важен для стимуляции противоопухолевого иммунитета), и увеличивая синтез нескольких иммуносупрессивных факторов, включая ИЛ-10, ИЛ-23, трансформирующий фактор роста бета (TGF-β) и фактор роста сосудистого эндотелия (VEGF) [53]. В этом случае возможен дисбаланс факторов иммунной системы, нарушение регуляции JAK / STAT-воспалительного пути, и соответственно, повышение риска формирования высокой вирусной нагрузки при инфекции ВПЧ. У этого исследования было несколько ограничений. Во-первых, для подтверждения наших результатов необходимы дальнейшие исследования этих полиморфизмов на более крупной выборке. Во-вторых, наше исследование не включало все полиморфные варианты STAT3, IL10 и IL12B. Было бы интересно провести крупномасштабное популяционное исследование случай-контроль для анализа всех полиморфных вариантов для исследуемых генов. В-третьих, в этом исследовании отсутствовали измерения уровней STAT3, ИЛ-10 и ИЛ-12β в локальной среде инфицированных ВПЧ клеток. В-четвертых, не учитывалось влияние эпидемиологических факторов риска, таких как курение, употребление алкоголя и сексуальное поведение на характер течения ВПЧ инфекции. Было бы интересно проанализировать, связан ли уровень экспрессии STAT3, ИЛ-10 и ИЛ-12β с подобными факторами.
Заключение: для отдельных ОНП генов STAT3 G>C, IL10 -1082G>A и IL12B 1188A>C не выявлено статистически значимой разницы в частотах генотипов и аллелей между исследуемыми группами женщин. В то же время MDR анализ выявил значимость межгенных взаимодействий исследуемых локусов. Это подтверждает тот факт, что развитие инфекции ВПЧ не определяется одним геном, а зависит от функционирования комплекса генетических факторов, контролирующих работу иммунной системы человека.
Информация о финансировании
Исследование было проведено на оборудовании Центра коллективного пользования «Высокие технологии» (Южный федеральный университет).
Конфликт интересов
Автор заявляет об отсутствии конфликта интересов.




















Список литературы