Взаимосвязь полиморфизма генов IL1B и IL6 с эозинофилией крови и гистологической картиной полипов у пациентов с хроническим полипозным риносинуситом
Aннотация
Актуальность: Проблема хронического полипозного риносинусита – одно из самых частых заболеваний в современной оториноларингологии с невыясненным до конца этиопатогенезом. Широко изучаемой теорией формирования полипоза носа на сегодняшний день является генетическая. Считается, что некоторые гены-кандидаты, как например, гены цитокинов, могут оказывать влияние не только на возникновение самого заболевания, но и на его клинические проявления, такие как эозинофилия крови и гистологическая структура полипозной ткани, поскольку нередко эта патология сопровождается атопией с повышением уровня эозинофилов. Цель исследования:Изучить ассоциации полиморфизма генов IL1B (rs1143627) и IL6 (rs1800796) с эозинофилией крови и гистологическими типами полипов у пациентов с хроническим полипозным риносинуситом. Материалы и методы:Проведен объективный осмотр не отличающихся по расово-этническим характеристикам пациентов с полипозом носа в возрасте от 18 до 60 лет, среди которых в исследовании участвовало 151 (37%) женщин и 257 (63%) мужчин. Выполнялось анкетирование с акцентом на социально-биологический статус больного, жалобы, анамнез жизни и заболевания, данные клинических и лабораторных обследований, особенности течения заболевания. После забора венозной крови из локтевой вены стандартным методом фенол-хлороформной экстракции выполнялось выделение ДНК и затем генотипирование rs1143627 и rs1800796. По величине отношения шансов (OR) и 95% доверительного интервала (95% CI) оценивали наличие ассоциаций генотипов, о соответствии распределения частот генотипов равновесию Харди-Вайнберга судили по p-уровню значимости. Результаты:Выявлена ассоциация носительства генотипа G/G (OR=0,31; 95 CI 0,10-0,92; p=0,037) гена IL1В (rs1143627) с пониженной вероятностью образования полипов железистого типа. Ассоциаций полиморфных вариантов исследуемых генов с эозинофилией крови не обнаружено. Функциональных эффектов rs1143627 и rs1800796 в тканях верхних дыхательных путей, полипах носа и околоносовых пазух не обнаружено. Выявлено отсутствие влияния rs1800796 на экспрессию гена IL6. Заключение:Таким образом, выявленная взаимосвязь полиморфизма G/G гена IL1В (rs1143627) с пониженной вероятностью формирования железистых полипов у пациентов с хроническим полипозным риносинуситом может являться доказательством генетической обусловленности этого заболевания, однако данная гипотеза требует дальнейшего изучения
Введение. В современной оториноларингологии и врачи, и пациенты все чаще сталкиваются с риносинуситами ввиду большой распространенности и длительного, часто тяжело поддающегося лечению, течения. Термин «риносинусит» детерминируется как воспалительный процесс в слизистой оболочке носа и его придаточных пазухах длительностью больше 12 недель, с наличием двух и более симптомов, причем одним из них является затруднение носового дыхания или отделяемое из носа, болезненные ощущения или давление в области лица, а так же гипосмия [1]. Согласно Европейскому соглашению по риносинуситам от 2020 года (EPOS 2020), хронический риносинусит у взрослого населения – это заболевание длительностью более 12 недель, с наличием двух или более симптомов, при этом одним из них является либо заложенность носа, либо отделяемое из носа, иногда сочетающиеся с давлением в области лица и снижением обоняния. По современной классификации, разработанной EPOS 2020, ХРС может быть первичным и вторичным, а также делится на локализованный и диффузный. Варианты первичного локализованного – аллергический грибковый и изолированный синуситы, а диффузный бывает эозинофильным и неэозинофильным. Высказывалось предложение о введении термина «эозинофильный грибковый синусит» вместо «аллергического грибкового», однако не получило одобрения ввиду того, что аллергическая реакция на грибковые агенты при ХРС не доказана [2]. В России же в клинической практике используют другую классификацию этого заболевания в зависимости от признака: по характеру течения ХРС бывает лёгкой, среднетяжелой и тяжелой формы; по этиологии – бактериальным, грибковым, смешанным; по морфологическим особенностям – катаральным, гнойным, гнойно-полипозным и полипозным [3]. Сегодня особый интерес у практикующих оториноларингологов и врачей общей практики представляет хронический полипозный риносинусит (ХПРС) – заболевание мультифакториальной этиологии с невыясненным до сих пор окончательно механизмом патогенеза, но поражающее огромное количество пациентов во всем мире. Выделяют много теорий возникновения этой патологии, но ни одна из них не получила окончательного подтверждения. Например, по теории хронического воспаления считается, что ввиду повторяющихся инфекционных процессов, способствующих нарушению транспорта жидкости, формируется постоянный отек слизистой, который в результате может привести к к росту полипозной ткани [4]. Согласно инфекционной теории, энтеротоксин золотистого стафилококка, часто выявляемого микроорганизма у пациентов с ХПРС, обладает способностью вызывать иммунологические процессы с Т-хелперами 2 типа, тем самым выступает как суперантиген, способствующий формированию полипов [5]. С позиции грибковой теории патогенез ХПРС объясняется выработкой эозинофилами токсических белков на фоне грибкового поражения пазух. Это приводит к образованию густого муцина, который способствует повреждению слизистой созданию благоприятных условий для формирования назального полипоза [6]. В 2019 г. Г.З. Пискунов предложил в зависимости от предполагаемого патогенеза назальный полипоз разделить на 4 группы: полипоз, возникший ввиду нарушения аэродинамики носа и околоносовых пазух; возникающий в результате хронического воспаления слизистой; формирующийся из-за грибковой инфекции; образующийся ввиду нарушения метаболизма арахидоновой кислоты и, наконец, возникающий при муковисцидозе и синдроме Картагенера [7]. Также не отвергается и теория эозинофильного аллергического воспаления. Некоторые формы назального полипоза, сопровождающиеся аллергией, БА, непереносимостью аспирина и его аналогов обладают более агрессивным клиническим течением, резистентностью к лекарственной терапии, высокой частотой рецидивов. Такие однородные с клинической точки зрения разновидности ХПРС получили название «фенотип», однако в клинической практике данная классификация не получила официального распространения [8]. Тем не менее детерминация эндотипов, основанных на биомеханических процессах при полипозе носа, имеет весьма важное значение в прогнозе течения заболевания и выборе наиболее эффективной схемы лечения. [9]. В 2016 году Dennis et al. предложил классифицировать ХПРС в зависимости от эндотипа на 4 группы: основанный на действии цитокинов воспаления с участием Т-хелперов 2-го типа; опосредованный эозинофилами; связанный с иммуноглобулинами и, наконец, ХПРС, связанный с деятельностью цистеинил-лейкотриенов [10]. Однако ввиду того, что один эндотип может состоять из нескольких фенотипов, а один фенотип может быть основан на нескольких молекулярных механизмах, иностранные ученые сделали вывод, что эндотипы зависят от субпопуляций Т-клеток, цитокинов и функции эпителиального барьера [11].
Всё вышесказанное ещё раз подтверждает мультифакториальность ХПРС и неоднозначность его патогенеза. Надо отметить, что в современных реалиях все чаще ученые обращают внимание на генетическую предрасположенность полипоза носа. Существует много генов-кандидатов, предположительно участвующие в формировании наследственности при ХПРС – в частности, это гены цитокинов. Но ни отечественные, ни зарубежные исследователи до сих пор не смогли выделить определенные полиморфизмы генов, которые могли бы быть ассоциированы с теми или клиническими проявлениями при ХПРС, например, с нередко возникающей эозинофилией а также типом патоморфологического строения самой полипозной ткани.
Поэтому целью нашей работы является определение ассоциаций полиморфизма генов IL1B и IL6 с вероятностью образования различных гистологических вариантов полипозной ткани и эозинофилии крови у пациентов с ХПРС.
Материалы и методы исследования. Исследование одобрено Региональным этическим комитетом ФГБОУ ВО КГМУ (Протокол №8 от 10 октября 2016 г.). За 2016-2019гг. на базе лор-отделений областной клинической больницы и городской клинической больницы №1 им. Н.С. Короткова г. Курска с письменного информированного добровольного согласия нами было обследовано 408 пациентов с ХПРС, среди которых 151 (37%) женщин и 257 (63%) мужчин. Возрастной диапазон составил 18-60 лет. Все исследуемые являлись жителями Курска и Курской области, по расовому и национальному признаку различий не было. Критериями включения пациентов в исследование служили наличие подтвержденного диагноза ХПРС, согласия на участие в исследовании, отсутствие тяжелых соматических патологий (декомпенсация сердечно-сосудистой деятельности, дыхательная и почечная недостаточность, онкология, сахарный диабет, тяжелое течение риносинусита). Диагноз ставился на основании жалоб на затруднение носового дыхания, данных объективного осмотра (наличие полипов в носу при передней риноскопии и эндоскопии полости носа с помощью эндоскопа фирмы STORZ), КТ-картины или рентгенографии придаточных пазух носа, а также на основании гистологической картины удаленной в ходе оперативного лечения полипозной ткани. Со всеми пациентами был произведен опрос по специально созданной тест-анкете. В опросе обращали внимание на социально-биологический статус больного, истории жизни и заболевания, жалобы, данные клинических и лабораторных обследований, особенности течения заболевания. Уровень эозинофилов отмечался по данным общего анализа крови, который выполнялся всем пациентам при поступлении на оперативное лечение. После анкетирования для молекулярно-генетического анализа был произведен забор 6 мл венозной крови из локтевой вены в пластиковые пробирки с ЭДТА, которые хранились в биобанке НИИ генетической и молекулярной эпидемиологии Курского государственного медицинского университета (директор – д.м.н., профессор Полоников А.В.) при -20 градусах. На первом этапе молекулярно-генетического анализа осуществлялось выделение ДНК из цельной крови исследуемых стандартным методом фенол-хлороформной экстракции. Сначала осажденные центрифугированием лейкоциты лизировались в ТЕ-буфере с помощью протеиназы К; затем полученную смесь инкубировали в термостате 12 часов при температуре 37 градусов. После этого проводилась экстракция сначала фенолом, затем фенолом и хлороформом, и, наконец, снова хлороформом. Далее ДНК преципитировали 96% этанолом, высушивали и хранили при минус 20 градусах. На втором этапе проводилась амплификация фрагментов ДНК методом полимеpазной цепной pеакции (ПЦР) в 10 мкл реакционной смеси, в которую добавляли по 1 мкл геномной ДНК каждого образца. Для гена IL1B использовались праймеры F 5′-CCCCTTTCCTTTAACTTGATTGTG-3′ и R 5′- AGGTTTGGTATCTGCCAGTTTCTC-3′, TaqMan-зонды 5′- FAM- TTTGAAAGCCATAAAAA-RTQ1-3′ и 5′- ROX- TTTGAAAGCTATAAAAACAG-BHQ-3′; для гена IL6 праймеры F: 5′- GCCTTGAAGTAACTGCACGAAATT-3′ и R: 5′- CCAGTCATCTGAGTTCTTCTGTGTT-3′, а также TaqMan-зонды 5′-FAM- AACAGCCGCTCACAG-RTQ1-3′ и 5′-ROX- TACAACAGCCCCTCACAG-BHQ2-3′. В работе использовался амплификатор CFX96 (Bio-Rad, США).
Анализ ассоциаций генотипов с риском формирования того или иного гистологического варианта полипов осуществляли по отношению шансов (OR) и 95% доверительному интервалу (95% CI). Для оценки распределения частот генотипов каждого полиморфизма равновесию Харди-Вайнберга учитывали p-уровень значимости (точный критерий Фишера). Расчеты проводились при помощи ресурса SNPStats (https://www.snpstats.net/start.htm), при этом оценивалась кодоминантная модель с поправкой на пол, возраст, наличие БА и аллергии. Для оценки функциональных эффектов полиморфизмов использовался биоинформатичеcкий ресурс GTExPortal (https://gtexportal.org).
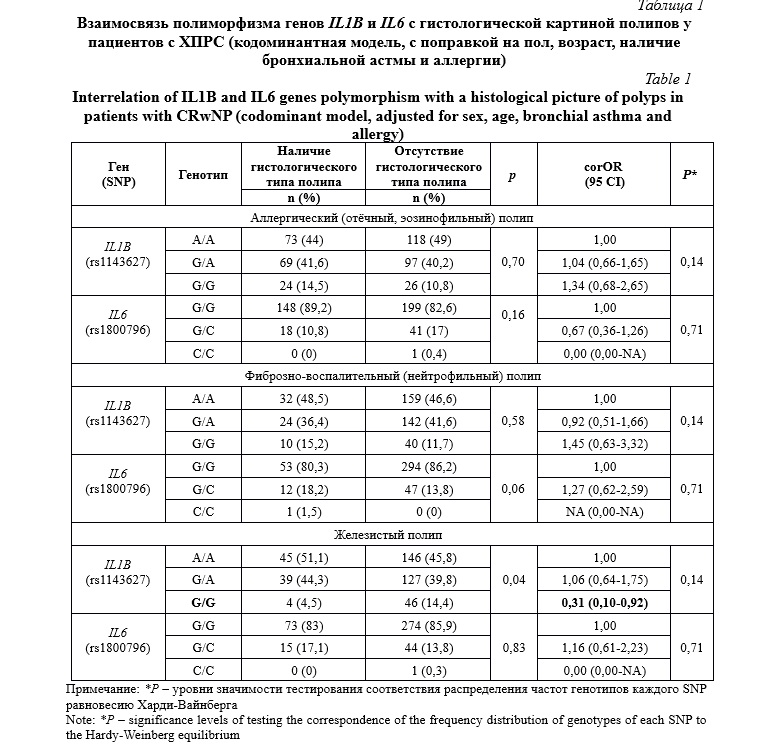
Результаты и их обсуждение. Анализ Р-уровней значимости тестирования соответствия распределения частот генотипов каждого однонуклеотидного полиморфизма (SNP) равновесию Харди-Вайнберга (точный критерий Фишера) продемонстрировал отсутствие статистически значимых различий, так как p=0,05 (таблица 1). При оценке ассоциаций полиморфных вариантов генов IL1B и IL6 с риском формирования различных гистологических вариантов полипозной ткани у пациентов с ХПРС нами была выявлена статистически значимая взаимосвязь носительства генотипа G/G (OR=0,31; 95 CI 0,10-0,92; p=0,04) гена IL1В (rs1143627) с пониженной вероятностью образования полипов железистого типа (таблица 1). Данный статистический анализ был произведен с поправкой на пол, возраст, наличие бронхиальной астмы и аллергии.
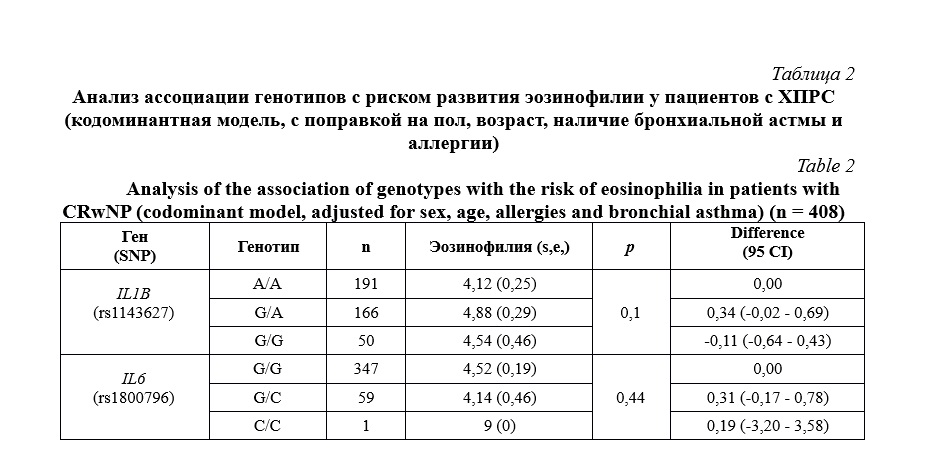
На следующем этапе мы оценили взаимосвязь полиморфизма исследуемых генов с уровнем эозинофилов периферической крови у пациентов с ХПРС. Учитывая поправки при расчетах, полученные переменные независимы от возраста, пола, наличия БА и аллергии. Выявлено отсутствие статистически значимой взаимосвязи полиморфных вариантов генов IL1B и IL6 с повышенным уровнем эозинофилов в крови (таблица 2).
В заключение мы провели анализ функционального эффекта каждого из исследуемых полиморфизмов с помощью ресурса GTExPortal (https://gtexportal.org). По данным этого ресурса нет функциональных эффектов rs1143627 в тканях верхних дыхательных путей, полипах носа и околоносовых пазух, упоминается лишь эффект аллеля А (rs1143627), связанный со снижением экспрессии гена IL1B в тестикулярной ткани (p=1,2*10-24). Также по данным GTExPortal отсутствует действие rs1800796 на экспрессию гена IL6, однако отмечено, что эффект аллеля С (rs1800796) приводит к повышению экспрессии гена FAM126A в культивированных фибробластах (p=7,7*10-7) По данным литературы, мутации в этом гене связаны с процессами гипомиелинизации в тканях периферической и центральной нервной системы [12]. Сведения о функциональном эффекте вышеуказанного полиморфизма в полипозной ткани носа и околоносовых пазух, а также в тканях верхних дыхательных путей в литературе и в GTExPortal отсутствуют.
Как известно, согласно широко применяемой гистологической классификации, полипы носа бывают 4 типов: отечные, эозинофильные (аллергические); фиброзно-воспалительные (нейтрофильные), железистые и полипы с атипией стромы. Все эти варианты различаются по клеточному составу. При отечном, эозинофильном полипе наблюдается утолщение базальной мембраны, отёк стромы, гиперплазия бокаловидных клеток и массивная инфильтрация эозинофилами. Характерным признаком фиброзно-воспалительных полипов является преобладание в строме фибробластов, но отсутствие отёка и гиперплазии бокаловидных клеток. Для железистых полипов характерно присутствие большого количества серомуцинозных желез в рыхлой отечной строме. Этот тип полипов носа имеет несколько общих признаков с эозинофильным гистологическим вариантом. Самый редкий вариант – это полипы с атипией стромы, характеризующийся наличием нетипичных стромальных клеток с отсутствием митозов [13]. В нашем исследовании количество пациентов, у которых была выявлена атипия стромы при гистологическом исследовании удаленной полипозной ткани, оказалось ничтожно малым, поэтому анализ ассоциаций генотипов с этим типом патоморфологии не проводился. Предполагается, что отёчные и фиброзно-воспалительные полипы являются маркерами процессов пролиферации при полипозе носа [14].
Эозинофилы часто являются неотъемлемым проявлением полипоза носа, особенно при рецидивах. При этом эозинофилия крови часто коррелирует с эозинофилией тканей носа [15]. Многие учёные обнаружили участие эозинофилов в патологических процессах при носовом полипозе, поскольку они принимают участие в перестройке слизистых оболочек посредством действия цитотоксических белков. Миграция эозинофилов в ткани носа из периферической крови основано на сложных взаимодействиях эпителия носа, врожденными лимфоидными клетками и приобретенными иммунными агентами, продуцирующими цитокины, хемокины и алармины, что регулируется Т-хелперами 2 типа и в большинстве стран принимается за основной иммунологический процесс при ХПРС [16]. Это подтверждается существенной ролью клеток CD4+ и наличием изменений в системном и местном иммунных ответах у пациентов с ХПРС, а также превалированием T-хелпер-2-зависимых цитокинов, которые обуславливают эозинофильный характер хронического воспаления в слизистой носа [17]. Цитокины – это белки, которые оказывают влияние на взаимодействие между клетками. В научных источниках можно встретить различные определения таких белков, при этом самыми распространенными являются понятия «лимфокин», «хемокин», «монокин» и «интерлейкин» [18]. При ХПРС возникает активация Т-клеток, приводящая к увеличению секреции цитокинов, которые воздействуют на иммуннокомпетентные клетки, вследствие чего формируется воспалительный процесс и разрастание ткани [19]. В патогенезе ХПРС принимают участие различные интерлейкины, но, поскольку в настоящее время генетические аспекты ХПРС являются весьма актуальным вопросом, в данном исследовании мы обратили внимание на гены таких цитокинов, как IL1B и IL6. IL1 при полипозе носа модулирует ранний каскад воспалительного ответа, принимает участие в активации моноцитов и Т-лимфоцитов, повышает экспрессию молекул адгезии. Существует 3 формы этого цитокина: IL1A, IL1B и антагонист рецептора IL1 [20]. Гены семейства IL1 располагаются в области локуса 2q13-2. [21]. С аллергическими проявлениями и бронхиальной астмой, которые часто сопровождают назальный полипоз, связан IL1В. Он способствует выживанию Т-клеток, повышает продукцию антител из В-клеток, участвует в пролиферации В-клеток и увеличивает синтез цитокинов Т-хелперов 2 типа [22]. Недавно иностранными исследователями было выявлено, что эозинофилы в качестве иммуномодулирующего цитокина конституитивно высвобождают именно IL1В [23]. В нашем исследовании мы выявили, что носительство генотипа G/G (OR=0,31; 95 CI 0,10-0,92; p=0,037) гена IL1В (rs1143627) ассоциировано с низким риском формирования железистых полипов. Аналогичных работ в иностранных и отечественных ресурсах нами не встречено. Однако при анализе взаимосвязи полиморфизма гена IL1В с эозинофилией нами не было обнаружено статистически значимых ассоциаций.
IL6 – цитокин, который принимает участие в разных воспалительных процессах. Его значимая роль заключается в индукции окончательной дифференцировки В-клеток в плазматические, способствованию пролиферации Т-клеток. Концентрации IL6 при ХПРС были изучены отечественными коллегами, которые сравнили уровни этого цитокина у пациентов с полипозом носа, астматической триадой и группой контроля. Оказалось, что концентрация этого цитокина среди пациентов с ХПРС была сравнительно выше, чем в двух других группах [24]. Экспрессия IL6 эозинофилами была подтверждена ранее другими иностранными учеными. Они выявили, что in vitro продукция этого цитокина была отмечена эозинофилами как у пациентов с атопией, так и без нее [25]. Ген IL6 локализован на хромосоме 7 [26]. В нашей работе не выявлено статистически значимых ассоциаций полиморфизма гена IL6 с эозинофилией и с различными гистологическими вариантами полипозной ткани. В иностранных ресурсах информации об ассоциации полиморфизма этого гена с риском формирования эозинофильных, фиброзных, железистых и с атипией стромы полипов нами не найдено. Что касается взаимосвязи с эозинофилией, то в российских и иностранных ресурсах подобных научных работ также не обнаружено.
Заключение. Таким образом, мы выявили, что генотип G/G гена IL1В (rs1143627) статистически ассоциирован с пониженным риском формирования железистых полипов (OR=0,17; 95 CI 0,04-0,78; P=0,02) у пациентов с ХПРС без аллергии, а ассоциаций полиморфных вариантов генов IL1В и IL6 с эозинофилией крови в нашей работе не обнаружено. Учитывая, что ХПРС – заболевание мультифакториальное и его генетическая предрасположенность изучается все плотнее, для оптимизации профилактических, диагностических и лечебных мероприятий в будущем следует продолжать изыскания в заданном направлении.




















Список литературы