РАЗРАБОТКА И ВАЛИДАЦИЯ МЕТОДИКИ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ИМАТИНИБА В ПЛАЗМЕ КРОВИ МЕТОДОМ ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ С МАСС-СПЕКТРОМЕТРИЧЕСКИМ ДЕТЕКТИРОВАНИЕМ
Aннотация
Разработан метод количественного определения противоопухолевого средства – ингибитора протеинкиназы в плазме крови с помощью высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием. Аналитический диапазон метода составил от 0,03 до 3,83 мкг/мл в плазме крови. Метод применен для изучения биоэквивалентности воспроизведенного лекарственного препарата, содержащего в качестве активного фармацевтического ингредиента иматиниб, в сравнении с референтным.
Ключевые слова: иматиниб, плазма крови, высокоэффективная жидкостная хроматография, масс-спектрометрический детектор, валидация
Иматиниба мезилат – ингибитор протеинтирозинкиназы (рис. 1). В основе клинической эффективности иматиниба лежит ингибирование BCR-ABL-киназы. На первых этапах доклинических и клинических исследований была доказана эффективность фармацевтической субстанции, а впоследствии и референтного препарата, для лечения Ph-позитивного хронического миелоидного лейкоза в любой фазе. Впоследствии препарат был одобрен для лечения больных с KIT (CD117)-позитивными неоперабельными и/или метастатическими стромальными опухолями желудочно-кишечного тракта [3, 4]. В настоящее время FDA одобрило новое показание к применению препарата Гливек – для лечения детей с впервые выявленным острым лимфобластным лейкозом с положительной филадельфийской хромосомой (Ph +) [6]. В связи с клинической значимостью рассматриваемого препарата, разработка и вывод на фармацевтический рынок воспроизведенных лекарственных препаратов, содержащих иматиниб, является актуальным.
Рис. 1. Иматиниб
Fig. 1. Imatinib
В связи с ФЗ «Об обращении лекарственных средств», одним из разделов регистрационного досье, подаваемого для регистрации воспроизведенного лекарственного препарата, должен быть отчет о проведении исследований его биоэквивалентности [2]. В настоящее время метод высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием (ВЭЖХ-МС/МС) является эталонным для качественной и количественной оценки аналита в плазме при проведении данного исследования.
В связи с изложенным целью работы явилась разработка и валидация методики количественного определения иматиниба методом высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием.
Экспериментальная часть.
В работе использовали следующие реактивы: иматиниб, дазатиниб (ф. Sigma), ацетат аммония (ф. Merk), метанол (ф. Merk), ацетонитрил для градиентной хроматографии (ф. Merk), вода очищенная и деионизированная с помощью системы «Gene Pure» (Thermo Scientific, США).
Определение иматиниба в биологической жидкости (плазма крови человека) проводили на жидкостном хроматографе UltiMate 3000 RS LC (Thermo Fisher Scientific, США), оснащенным вакуумным дегазатором, градиентным насосом, автосемплером, термостатом колонок. Детекцию аналита проводили на масс-спектромтере Velos Pro (Thermo Scientific, США) с ионизацией в нагреваемом электроспрее (H-ESI-II).
Пробоподготовка.
С применением стандартных образцов дазатиниба и иматиниба (ф. Sigma) были приготовлены их исходные растворы в 20% растворе ацетонирила в 0,1% муравьиной кислоте в концентрациях 0,0016% и 0,04%, соответственно. Путем серийного разведения исходного раствора иматиниба были получены его рабочие растворы для построения калибровочной кривой (в концентрациях от 0,03 мкг/мл до 3,83 мкг/мл в плазме) и образцов контроля качества (0,1 мкг/мл; 1,8 мкг/мл и 3 мкг/мл в плазме).
Для приготовления указанных растворов к 600 мкл плазмы прибавляли по 50 мкл 1% водного раствора муравьиной кислоты, 50 мкл раствора внутреннего стандарта, 50 мкл соответствующего исходного раствора иматиниба и 700 мкл ацетонитрила. Для приготовления бланка к плазме вводили 50 мкл 1% водного раствора муравьиной кислоты и 700 мкл ацетонитрила.
ВЭЖХ-МС/МС.
Хроматографическое разделение осуществляли на колонке размером 50×2,1 мм, заполненной обращённо-фазовым сорбентом С18 с размером частиц 1,7 мкм (ACQUITY UPLC BEH C18) при температуре 45˚С. Хроматографический анализ проводили с использованием системы UltiMate 3000 RS LC сопряженной с масс-спектрометрическим детектором в изократическом режиме при следующих хроматографических условиях:
Параметры ВЭЖХ | |
Колонка: | ACQUITY UPLC BEH размером 50×2,1 мм, заполненная обращённо-фазовым сорбентом С18 с размером частиц 1,7 мкм |
Температура колонки (˚С): | 45 |
Объем пробы (мкл): | 2 мкл |
Подвижная фаза: | метанол:0,01М раствор ацетата аммония в воде (1:1) |
Скорость потока (мл/мин): | 0,4 |
Ориентировочные времена удерживания (мин): | Иматиниб − 2; Дазатиниб − 3.
|
Время инжекции (мин): | 6 |
Исследуемые аналиты в плазме детектировали с применением масс-спектрометрического детектора Velos Pro – двухкамерная линейная квадрупольная ионная ловушка низкого и высокого давления с ионизацией в нагреваемом электроспрее (H-ESI-II) с технологией двойной десольвационной зоной. Сканирование осуществляли по селективно выбранным ионам (SIM). Параметры работы детектора представлены ниже:
Параметры масс-спектрометра: | |
Инструмент: | Velos Pro (Thermo Scientific, США) |
Тип ионизации: | H-ESI |
Полярность: | Иматиниб «+»; Дазатиниб «+». |
Переход масс: | Иматиниб 494.3 →394.3; Дазатиниб 488.0→401.2. |
Энергия коллизии: | Иматиниб – 29; Дазатиниб ‒ 35. |
Напряжение на источнике (V): | Иматиниб – 4500; Дазатиниб – 5500. |
Температура источника (°C): | Иматиниб – 300 ; Дазатиниб – 300. |
Температура капилляра (°C): | Иматиниб – 350; Дазатиниб – 350. |
Sheath gas pressure (Arb): | Иматиниб – 40; Дазатиниб – 40. |
Aux gas pressure (Arb): | Иматиниб – 15; Дазатиниб – 15 |
S-lens RF level (%): | Иматиниб – 63,5; Дазатиниб – 60,6. |
Результаты и обсуждение:
Применение в методике колонки ACQUITY UPLC BEH размером 50 × 2,1 мм, заполненной обращённо-фазовым сорбентом С18 с размером частиц 1,7 мкм позволило получить удовлетворительную форму пиков иматиниба и дазатиниба. Хроматографическая система считалась пригодной при выполнение следующих критериев: относительное стандартное отклонение отношения площадей определяемых пиков к пику внутреннего стандарта, рассчитанное по шести последовательным хроматограммам раствора одной концентрации – не более 7 %; фактор асимметрии пиков иматиниба и дазатиниба – не более 2,2; эффективность хроматографической колонки, рассчитанная по пику иматиниба– не менее 1000 теоретических тарелок; соотношение сигнал/шум для раствора на уровне нижнего предела количественного определения (НПКО) не менее 10:1. Хроматограммы дазатиниба (внутренний стандарт) и иматиниба с концентрацией в плазме на уровне НПКО (0,03 мкг/мл в плазме) представлены на рис. 2.
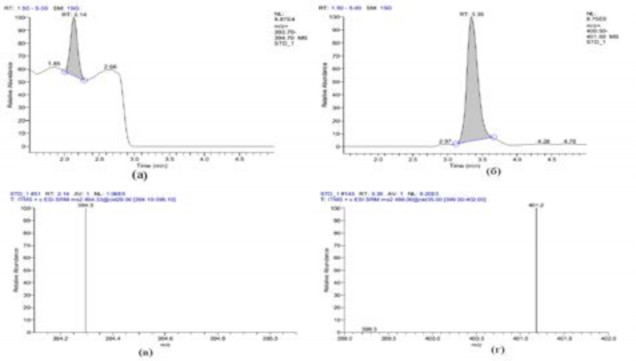
Рис. 2 - Хроматограммы и масс-спектры иматиниба (рис. 2а и 2в) и дазатиниба (рис. 2б и 2г) в плазме
Fig. 2 - Chromatography and mass spectra of imatinib (Fig. 2a and 2b) and dasatinib (Fig. 2b and 2d) in plasma
Валидацию аналитического метода проводили в соответствии с отечественными и зарубежными требованиями, предъявляемыми к биоаналитическим методикам по следующим показателям: селективность, матричный эффект, линейность, нижний предел количественного определения, линейность, специфичность, прецизионность, воспроизводимость [1, 4].
Для того, чтобы избежать нарушения линейности градуировочной зависимости, связанной с влиянием компонентов биологической матрицы на ионизацию в масс-спектрометрии одним из важных этапов при разработке и валидации методик в плазме крови, является изучение матричного эффекта. Указанный показатель исследовали на шести образцах биологической матрицы различных доноров. Значения коэффициента вариации (CV) нормализованных матричных факторов для шести различных матриц на нижнем и верхних уровнях концентраций не превышало 15% и, составили 12,8% и 5,1%, соответственно.
Для построения градуировочной кривой (рис. 3) использовали рабочие растворы на семи уровнях концентраций в трех повторностях, бланк (чистая матрица) и бланк с внутренним стандартом (матрица без введения аналита, но с добавлением внутреннего стандарта).
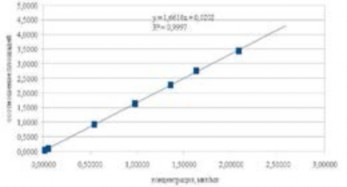
Рис. 3 – Линейность методики определения иматиниба в диапазоне концентраций от 0,03 до 3.8 мкг/мл
Fig. 3 - Linearity methods for determining imatinib concentrations ranging from 0.03 to 3.8 mcg / ml
Извлеченные стандарты иматиниба из плазмы позволили получить линейную калибровочную кривую в динамическом диапазоне от 0,03 до 3,83 мкг в 1 мл биологического объекта с коэффициентом R2 равным 0,9997. Ни одна из ошибок не превышала допустимых пределов – не более 20% для раствора НПКО, и не более 15% - для остальных концентраций.
Правильность методики оценивали на образцах биологической матрицы с добавлением известных количеств аналита на уровнях концентраций: НПКО, нижний контроль качества (НКК), средний контроль качества (СКК) и верхний контроль качества (ВКК), которые получали независимо от растворов, приготовленных для подтверждения линейности методики. Правильность выражали в процентах от номинального значения иматиниба. Результаты представлены в табл. 1.
Таблица 1
Правильностьопределенияиматинибавплазме
Table 1
The correctness of the definition of imatinib plasma
Цикл 1 | Цикл 2 | Цикл 3 | Цикл 4 | ||||||
Сввед, мкг/мл | Снайд, мкг/мл | СV, % | Снайд, мкг/мл | СV, % | Снайд, мкг/мл | СV, % | Снайд, мкг/мл | СV, % | |
НПКО | 0,030 | 0,0277 | 9,7 | 0,0304 | 9,0 | 0,0270 | 5,0 | 0,0332 | 2,0 |
0,0316 | 0,0311 | 0,0302 | 0,0339 | ||||||
0,0300 | 0,0258 | 0,0292 | 0,0349 | ||||||
0,0333 | 0,0295 | 0,0278 | 0,0333 | ||||||
0,0260 | 0,0331 | 0,0303 | 0,0338 | ||||||
НКК | 0,100 | 0,1054 | 8,4 | 0,0968 | 3,9 | 0,0885 | 1,8 | 0,0934 | 3,1 |
0,0919 | 0,0895 | 0,0884 | 0,0948 | ||||||
0,1132 | 0,0870 | 0,0885 | 0,0931 | ||||||
0,0946 | 0,0918 | 0,0902 | 0,0998 | ||||||
0,1008 | 0,0916 | 0,0922 | 0,0930 | ||||||
СКК | 1,80 | 1,8385 | 2,2 | 1,9570 | 3,6 | 1,8740 | 3,1 | 1,7862 | 2,2 |
1,7426 | 1,7764 | 1,9424 | 1,7001 | ||||||
1,8330 | 1,8527 | 1,9452 | 1,7612 | ||||||
1,7980 | 1,8449 | 1,9052 | 1,7258 | ||||||
1,7811 | 1,8252 | 1,8051 | 1,7847 | ||||||
ВКК | 3,00 | 2,9017 | 2,8 | 2,9674 | 4,8 | 2,7971 | 3,8 | 2,8513 | 2,7 |
2,9098 | 3,0135 | 2,7798 | 2,9256 | ||||||
2,7624 | 2,7706 | 2,6126 | 2,7188 | ||||||
2,7584 | 2,6888 | 2,6625 | 2,8653 | ||||||
2,9072 | 2,9214 | 2,8663 | 2,8373 | ||||||
Для проведения теста прецизионность проводили шесть повторных измерений концентрации (НПКО, НКК, СКК, ВКК) иматиниба в одном и том же образце по вышеописанной методике в четырех разных цикла. Все результаты были близки между собой (табл. 2).
Таблица 2
Прецизионность методики определения иматиниба в плазме
Тable 2
Precision of methods for determining imatinib in plasma
Раствор | Снайд ср, мкг/мл | Снайд ср, мкг/мл | Снайд ср, мкг/мл | Снайд ср, мкг/мл | СV,% | Критерий приемлемости |
день 1 | день 2 | день 3 | день 4 | |||
НПКО | 0,0297 | 0,0300 | 0,0289 | 0,0338 | 7,2 | не более 20 % |
НКК | 0,1012 | 0,0914 | 0,0896 | 0,0948 | 5,4 | не более 15 % |
СКК | 1,7986 | 1,8513 | 1,8944 | 1,7516 | 3,4 | не более 15 % |
ВКК | 2,8479 | 2,8723 | 2,7437 | 2,8397 | 2,0 | не более 15 % |
Таким образом, разработанная методика количественного определения иматиниба в плазме крови человека методом высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием проста в исполнении, соответствует требованиям валидационных характеристик и достоверно позволяет определять иматиниб в плазме крови в концентрациях от 0,03 мкг/мл до 3,83 мкг/мл.




















Список литературы