ИЗУЧЕНИЕ БИОФАРМАЦЕВТИЧЕСКИХ СВОЙСТВ НАНОВОЛОКОН ДЛЯ ЛЕЧЕНИЯ ВИРУСНЫХ КОНЪЮНКТИВИТОВ
Aннотация
В статье представлены результаты изучения метода электроформования для разработки офтальмологических лекарственных форм. Методом электроформования получены два типа волокон с активными компонентами: ацикловиром, ципрофлоксацином и цианокобаламином, а также комбинации этих субстанций. Один тип волокон, используется как гидрофильный (поливинилпирролидон, ПВП), нитеобразующий полимер, в то время как второй тип волокон - поликапролактон (ПСЛ), использовался как медленно деградирующий полимер. В ходе изучения высвобождения лекарственных веществ испытывали в валидированной модели глаза, и обнаружили, что это расширяет возможности применения этого метода для оценки влияния при биофармацевтических испытаниях. Мы предполагаем, что электроформованные матрицы, полученные в этой работе, могут быть потенциально использованы в качестве интравитреальных имплантов, высвобождающих активные фармацевтические субстанции пролонгированно.
Введение
В настоящее время в мировом научном сообществе общепризнанным критерием наноматериала, или наноструктуры, или наноустройства является критерий «<100 нм», когда, по крайней̆ мере, один из размеров объекта не превышает 100 нм. В тоже время в промышленности этот критерий имеет более широкий̆ диапазон и достигает 300 нм, а порой̆ и 500 нм, что в научной̆ среде классифицируется уже как субмикронный диапазон [5,6,7].
Цель работы: разработка состава и технологии нановолкон для лечения вирусных конъюнктивитов
Материалы исследования: ацикловир USP 30, PVP USP 30, PCL USP 30, ципрофлоксацин USP 30, цианокобаламин USP 30.
Методы исследования: технологические, статистические
Задачи исследования:
1. Разработать состав нановолокон
2. Разработать методику получения нановолокон
3. Изучить биофармацевтические характеристики нановолокон на модели глаза PK-EYE.
Учитывая все вышесказанное, становится ясной̆ актуальность разработки методов получения нановолокон, в том числе, и полимерных. С одной̆ стороны, такие волокна представляют самостоятельный̆ интерес для различных применений, т.к. имеют улучшенные физические свойства (прочность, эластичность и др.) по сравнению с их «толстыми» аналогами [23]. Любой процесс получения волокон включает три обязательные стадии: перевод формуемого материала в вязко-текучее состояние, формование волокон и их отверждение. Вязко-текучее состояние определяет способность материала к волокнообразованию и характеризуется определенными значениями вязкости и поверхностного натяжения, согласованными между собой [16, 17]. В разных методах формования волокон значения вязкости и поверхностного натяжения этих материалов варьируются по-разному: за счет изменения температуры, или концентрации (при формовании растворов полимеров [18, 19]. Соответственно проводится за счет удаления растворителя (путем его испарения или замещения).
Электроформование (ЭФ) – это процесс, приводящий к формированию нановолокон в результате действия электростатических сил на электрически заряженную струю полимерного раствора или расплава [32]. Электрическое напряжение от единиц до ста киловольт (типично: 10-60 кВ) прикладывается к раствору (расплаву) полимера, который при помощи дозатора подается через капилляр. Высокое напряжение индуцирует в растворе полимера одноименные электрические заряды, которые, в результате кулоновского электростатического взаимодействия, приводят к вытягиванию раствора полимера в тонкую струю [32].
Полученные струи отверждаются за счет испарения растворителя или в результате охлаждения, превращаясь в волокна, и под действием электростатических сил дрейфуют к заземленной подложке, имеющей противоположное значение электрического потенциала.
В последнее время в фармации используется прием улучшения растворимости фармацевтических субстанций путем получения дисперсных систем. В качестве носителей широко исследованы полиэтиленгликоли с различной степенью полимеризации. Характерной особенностью данного полимера является его хорошая растворимость в воде.
К группе коллидонов (монополимеров N-винилпирролидинона) относят растворимые повидоны и нерастворимые кросповидоны. Коллидон марки 12 PF и коллидон марки 17 PF представляют собой низкомолекулярные марки повидонов, способные к формированию растворимых комплексов активного ингредиента и повидона, представлены в виде апирогенных порошков, пригодных для применения в составе растворов для инъекций. Марки коллидона 25, 30 и 90 F могут применяться в офтальмологических препаратах, марки 25 и 30 используют в составе глазных капель. Уникальная особенность повидонов представлена их свойством комплексообразования, благодаря чему они могут улучшать растворимость многих лекарственных веществ [2]. Однако, в современной литературе встречаются данные об улучшении растворимости ацикловира в ходе проведения экспериментов различными группами ученых [27, 28, 29].
Так же имеются данные о том, что активные противовирусные свойства ацикловира в сочетании с БЦД не теряют своей фармакологической активности, и даже её увеличивают, что было подтверждено в ходе доклинических испытаний на крысах Koevary et all [14]. Группой индийских ученых рассматривались последствия использования наиболее широко используемых солюбилизаторов для достижения растворимости ацикловира (БЦД, ПЭГ-6000, К-25, ДМСО) [9, 10, 11]. Главным результатом стало обнаружение возможности увеличения растворимости соответствующих растворов и дисперсий в 2-4 раза [19, 25, 26]. Такие результаты позволяют добиваться заявленных значений растворимости при меньших расходах веществ, что увеличивает экономическую эффективность производственного процесса [12, 13]. Особенно важно, что стабильность дисперсий после обработки их компонентов оставалась прежней [31, 33]. Таким путем можно свести количества вспомогательных материалов в составе лекарственной формы до минимума.
Однако механохимические процессы в растворах ацикловира с солюбилизаторами, подвергнутыми механохимическим превращениям, изучены мало [20, 21, 22].
На базе UCL School of Pharmacy была разработана модель глаза PK-EYE Sahar Awwad, которая позволяет проводить исследования с доказанной степенью [30] эффективности, моделируя прохождение активными компонентами глазных капель через орган зрения. Модель глаза состоит из двух камер, между которыми установлена полунепроницаемая мембрана. При инстилляции в переднюю камеру частиц волокна и буферных растворов, моделирующих состав биологических жидкостей, происходит наблюдение за высвобождением компонентов и последующим анализом проб методом ВЭЖХ с построением кривых, соответствующих высвобождению компонентов.
Ацикловир был добавлен внутрь волокон с PCL и PVP. Когда оба типа волокон тестировались в PK-Eye со скоростью 2.0 мкл/мин, при pH 7.4 в задней полости, моно-экспоненциальное уменьшение наблюдалось на первой кривой. PVP-ACY волокна наблюдались около 0.95 ±0.12 дней (примерно 23 часа) в модели с наивысшей концентрацией 48.5 ± 23.5 мг/мл около 23 часов. Наименьшая концентрация вещества была установлена 0.028 ± 0.004 мг/мл и после примерно 197 часов (~8 дней).
Двойная доза ацикловира в PCL волокнах (PCL-ACY) показала время высвобождения около 3.67 ± 1.4 дней, с наибольшей концентрацией около 40.4 ± 21.6 мг/мл. Наименьшая концентрация была обнаружена в системе с волокнами с концентрацией около 5.8 ± 3.3 мг/мл после примерно 32 часов.
Во время испытания других противовирусных препаратов (например, ганцикловира) на предварительных этапах PK-Eye, период полураспада составлял несколько часов, предполагалось, что у субстанций с небольшой молекулярной массой время полураспада зависит от модели.
Результаты этого исследования является перспективными, особенно в модели PCL-ACY, а это предполагает, что волокна были в состоянии задержать высвобождение ацикловира на длительное время.
Ципрофлоксацин обладает широким спектром действия на грамотрицательные бактерии и используется при лечении различных клинических инфекций. Это подтверждает эффективность лечения внутриглазных инфекций и профилактику, что также было показан в нетоксичном действии на сетчатку кролика.
Ципрофлоксацин имеет молекулярный вес около 331.3 г/моль и период жизни около 4.0-5.0 дней в глазе кролика, что отражено в некоторых статьях, хотя другие пишут о периоде жизни около 2.2 часов и 1 часе в нормальном афакальном глазе. Как и ацикловир, ципрофлоксацин плохо растворяется при низком рН. Он также почти нерастворим в нейтральной среде, однако растворимость повышается с возрастанием рН. (примерно 30 мг/мл около pH 11) [3].
Исходный раствор 500 мг/мл ципрофлоксацина был приготовлен с 2% уксусной кислотой в воде и с серийными разведениями были сделаны концентрации около 0.49 мг/мл. Калибровочная кривая имела R2 значение 0.991 и это было использовано для расчета кинетики ципрофлоксацина в модели.
Оба варианта PVP-CIP и PCL-CIP волокон показали расширение периода полураспада, которые следовали кинетике первого порядка. PK-Eye. PVP-CIP показал время высвобождения около 1.36 ± 0.4 дней, с наибольшей еонцентрацией около 0.61 ± 0.35 мг/мл и 32 часов. Это заняло около 190 часов (~8 дней) для вещества без обнаружения методом ВЭЖХ. PCL-CIP показал небольшое время увеличения высвобождения PK-Eye по сравнению с PVP-CIP, с временем высвобождения около 2.1 ± 0.68 дней.
Максимальная концентрация, обнаруживаемая методом ВЭЖХ из этих волокон, составила 1.06 ± 0.47 мг/мл около 24 часов и составила около 190 часов (~8 дней), 99.3 ± 1.17 % субстанции высвобождалось.
Исходный раствор 1,0 мг/мл было приготовлен с рН 7,4[92, 93], подготовили серийные разведения до 0,49 мкг/мл. Калибровочная кривая имела R2 значение 0,9997, и это было использовано для вычисления неизвестных концентраций в различные моменты времени.
PVP-B12 и B12-PCL оба имели высокую концентрацию около 30 часов (2,01 ± 0,79 мкг / мл) и 21 часов (8,21 ± 4,7 мкг / мл), соответственно. B12 в обоих волоконах моноэкспоненциально снижался. Для сравнения, PVP-В12 имелo более медленноe высвобождение, чем PCL-B12, с наблюдаемым временем 2,32 ± 0,78 дня и 0,80 ± 0,21 дня соответственно.
Все три субстанции были помещены внутрь одного из волокон PVP или PCL соответственно и были протестированы PK-Eye (Рис. 1). Неизвестная концентрация для каждой субстанции была определена методом ВЭЖХ, доложенным ранее [4, 5].
Концентрация в волокнах из PVP составляла 355.3 ± 6.4 мг/мл, 91.8 ± 3.5 мг/мл и 199.5 ± 1.5 мг/мл ацикловира, B12 и ципрофлоксацина соответственно. В результате, наивысшая концентрация ацикловира, B12 и ципрофлоксацина была 46.4 ± 10.2 мг/мл (~25 часов), 21.3 ± 7.4 мг/мл (~ 25 часов) и 3.5 ± 0.08 мг/мл (~233 часов). Индивидуальное время высвобождения каждого вещества из PVP волокон регистрировалось 1.36 ± 0.08 дней, 5.85 ± 0.3 дней and 2.8 ± 0.15 дней соответственно. Ацикловир и B12 высвобождались из модели моноэкспотенциально, а ципрофлоксацин высвобождался линейно.
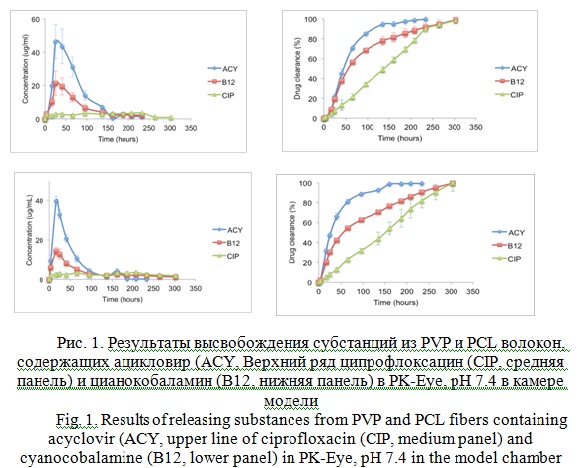
Ципрофлоксацин показал самую медленную и продолжительную высвобождаемость из волокон с PVP. Это высвобождение было постоянным, с поддерживающейся концентрацией ~1.0-3.5 мг/мл. Высвобождение веществ из волокон с PCL имело похожие результаты, как и у PVP волокон. Максимальная концентрация ацикловира, B12 и ципрофлоксацина был зарегистрирована в модели 39.7 ± 2.4 мг/мл (~17 часов), 14.3 ± 1.9 мг/мл (~17 часов) and 3.6 ± 0.12 мг/мл (~208 часов) соответственно.
Количество ацикловира, B12 и ципрофлоксацина, содержащегося в этих PCL волокнах, составила 208.7 ± 12.4 мг/мл, 94.0 ± 8.01 мг/мл и 125.6 ± 0.8 мг/мл соответственно.
Время высвобождения для ацикловира, В12 и ципрофлоксацина и составляло 1.4 ± 0.08 дней, 6.16 ± 0.6 дней и 2.99 ± 0.19 дней соответственно. По сравнению с PVP волокнами, время высвобождения из этих волокон было наиболее продолжительным.
Таблица 1
Определение кинетических параметров, определяющих использование PK-EYE модели
Table 1
Kinetic parameters determining the use of PK-EYE model
Состав | Масса высвободившейся субстанции / µg | Скорость высвобождения, UNITS | Период высвобождения / d | % высвободившейся субстанции | |
PVP-ACY | 248.4 ± 27.7 | 0.031 ± 0.004 | 0.95 ± 0.12 | 71.1 | |
PVP-CIP | 3.82 ± 0.05 | 0.022 ± 0.008 | 1.36 ± 0.4 | 3.51 | |
PVP-B12 | 19.1 ± 1.9 | 0.014 ± 0.005 | 2.32 ± 0.8 | 26.2 | |
PVP-ABC | ACY | 355.3 ± 6.4 | 0.02 ± 0.001 | 1.36 ± 0.08 | 104 |
CIP | 91.8 ± 3.5 | 0.33 ± 0.016 | 5.85 ± 0.3 | 89.6 | |
B12 | 199.5 ± 1.5 | 0.01 ± 0.0006 | 2.80 ± 0.15 | 292 | |
PCL-ACY | 543.7 ± 40.4 | 0.009 ± 0.004 | 3.67 ± 1.4 | 81.7 | |
PCL-CIP | 8.15 ± 0.1 | 0.015 ± 0 | 2.02 ± 0.7 | 3.75 | |
PCL-B12 | 34.3 ± 4.1 | 0.038 ± 0.010 | 0.80 ± 0.2 | 23.3 | |
PCL-ABC | ACY | 208.7 ± 12.4 | 0.021 ± 0.02 | 1.4 ± 0.08 | 33.2 |
CIP | 94.0 ± 8.01 | 0.32 ± 0.03 | 6.16 ± 0.6 | 49.8 | |
B12 | 125.6 ± 0.8 | 0.01 ± 0.0006 | 2.99 ± 0.19 | 99.9 | |
Таким образом, как видно из таблицы 1, при испытании в модели PK-Eye ацикловир высвобождается из волокон с PVP полностью, и показывает худшие результаты в волокнах с PCL. Ципрофлоксацин и цианокобаламин также показывают лучшую высвобождаемость в волокнах с PVP, что является оптимальным при разработке состава и технологии перспективной лекарственной формы.




















Список литературы
(date of access: August 15, 2016).