Экспрессия белков MMP при старении миокарда в норме и при дилатационной кардиомиопатии
Aннотация
Актуальность: Матриксные металлопротеиназы (MMP), их ингибитор TIMP, молекулы адгезии, сиртуины и маркеры апоптоза являются одними из сигнальных молекул, имеющих важное значение при прогнозировании развития дилатационной кардиомиопатии. Цель исследования: Изучить экспрессию белков MMP при старении миокарда в норме и при дилатационной кардиомиопатиии. Материалы и методы: Исследование проведено с использованием аутопсийного материала миокарда людей разных возрастных групп с дилатационной кардиопатией и без сердечно-сосудистой патологии. Материал получали в условиях стерильности на базе операционного блока. Образец ткани после отделения сразу опускали в стерильную емкость, содержащую физиологический раствор. Контролем служила культура нормальных кардиомиоцитов человека (линия GirardiHeart), полученная из коллекции клеточных культур Института цитологии РАН (Санкт-Петербург). Для иммуноцитохимического исследования культур и иммуногистохимического анализа аутопсийного материала применяли следующие первичные моноклональные антитела: ММР-2 (Dako, США) и ММР-9 (Dako, США). Морфометрическое изучение полученных структур проводили при помощи системы компьютерного анализа микроскопических изображений. Результаты: Установлено, что изменения площади экспрессии MMP-2, ММР-9 в аутопсийном материале миокарда в норме не наблюдалось. При ДК площадь экспрессии MMP-2 увеличивалась в 5,7 раза у пациентов средней возрастной группы, в 6 раз – у людей в пожилом возрасте, в 6,8 раза – у лиц старшего возраста относительно подобного показателя в норме. Содержание ММР-9 в миокарде у пациентов с ДК всех возрастных групп повышалась в 4,5 раза по сравнению с соответствующей возрастной нормой. В культурах нормального миокарда при их старении экспрессия ММР-9 достоверно не изменялась. Заключение: Ключевыми маркерами, характеризующими наличие дилатационной кардиомиопатии у людей разного возраста в аутопсийном и культуральном материале являются матриксные металлопротеиназы.
Введение. Патологии сердца и сосудов стоят на лидирующих позициях в списке заболеваний, характеризующихся высокой степенью риска летального исхода [1].
По результатам статистического анализа Всемирной организации здравоохранения (ВОЗ), 35 и более процентах случаев смертность лиц старших возрастных групп обусловлена патологией сердца и сосудов. Среди заболеваний сердечно-сосудистой системы у пациентов, имеющих возраст более 50 лет, достаточно часто встречается дилатационная кардиомиопатия (ДК) [2, 3, 4, 5]. Предпосылками ДК являются дилатация сердечных камер, систолическая дисфункция, отмечаемые в большинстве случаев в левом желудочке [6, 7, 8].
В настоящее время поиск сигнальных молекул для выявления у людей разного возраста ДК имеет важное медико-социальное значение. Матриксные металлопротеиназы (MMP), их ингибитор TIMP, молекулы адгезии, сиртуины и маркеры апоптоза рассматриваются как перспективные сигнальные молекулы, изучение которых позволит расширить возможности по диагностике и прогнозированию развития ДК. ММР являются ферментами, обладающими протеолитической функцией. Эти соединения активно участвуют в процессах ремоделирования и репарации тканей соединительного типа, составляющей основу сердечно-сосудистой и дыхательной систем [9, 10, 11, 12, 13].
Цель исследования – изучить экспрессию белков MMP при старении миокарда в норме и при дилатационнойкардиомиопатиии.
Материалы и методы исследования. Работа проведена на аутопсийном материале, полученном из сердечной мышцы пациентов разных возрастных групп с ДК, а также людей без сердечно-сосудистой патологии. Образцы получали из СПб ГБУЗ «Городская больница святого великомученика Георгия» (С.-Петербург). Все пробы разделяли на группы согласно возрастной классификации ВОЗ: 1 – люди среднего возраста (45-59 лет), 2 – люди пожилого возраста (60-74 года), 3 – люди старческого возраста (75-89 лет).
Нормальный аутопсийный материал был получен от людей, не имевших сердечно-сосудистой патологии и погибших от других причин.
Ткань миокарда человека для создания культур (диаметр 0,2 см, 4 фрагмента) была забрана от 3-х пациентов мужского пола среднего возраста (52,3±2,6) с ДК при биопсии сердца, полученных в Клинике сердечно-сосудистой хирургии Военно-медицинской академии им. С.М. Кирова (С.-Петербург).
Извлечение образцов ткани осуществляли в стерильных условиях на базе операционного блока. После получения материала клетки сразу опускали в стерильную емкость, содержащую физиологический раствор. Контролем служила культура нормальных кардиомиоцитов человека (линия GirardiHeart, полученная из коллекции клеточных культур Института цитологии РАН (С.-Петербург)). Культуральная среда для кардиомиоцитов состояла из 86,5% ЕМЕМ, 10% FBS, 1% NEAA, 1,5% НЕРЕS, 1% PES, L-глутамина. Все культуры выращивали на протяжении 3 пассажей («молодые» клеточные культуры) и 10 пассажей («старые» клеточные культуры). 10 пассаж был выбран в качестве «старых» культур экспериментально, т.к. при последующих пересевах большая часть клеток культуры вступала в апоптоз.
К работе приступили спустя 4 часа после получения образцов миокарда, хранение осуществлялось в холодильнике при +6°С.
В стерильных условиях ламинарного шкафа образцы были извлечены из транспортировочной емкости и помещены в чашку Петри, которая имела диаметр 7 см. Образцы обрабатывали сбалансированным раствором Хенкса (HBSS), содержащим соли и антибиотики, такие как пенициллин, стрептомицин (в концентрации 5 мг/мл), в течение 3 раз, чтобы смыть присутствующие изначально кровь и секрет.
С использованием стерильных ножниц материал измельчали до небольших кусочков объемом 1-2 мм3. Образцы помещали в пробирки для центрифугирования, имеющие объем 15 мл, сюда же добавляли 10 мл HBSS, содержащей 0,2% раствор коллагеназы I (Gibco, активность 205 ед/мг). Около 30 секунд пробы откручивали с использованием вортекса. Далее ткань ставили на инкубацию в термостат при 37°С на 20 минут. Образовавшиеся при этом агрегаты клеток диспергировали путем пропускания образцов через пипетку (пипетировали). 8 мл супернатанта с клетками осаждали в течение 5 минут, затем центрифугировали на протяжении 5 минут при 400g. Далее убирали надосадочную жидкость, осадок ресуспедировали в среде М199 (объемом 2 мл), содержащей 10% эмбриональную бычью сыворотку и антибиотик. Выделение проводили циклически, повторяя процедуру 3 раза. Растворенный осадок помещали в отдельную емкость. Жизнеспособности клеток оценивали с использованием трипанового синего. Краситель добавляли к аликвоте объемом 2 мл, взятой из пробирки с 6 мл накопленных клеток, в равных пропорциях. Считали процентное содержание живых клеток с использованием гемоцитометра (камеры Горяева).
Первичную клеточную культуру выделяли в предварительно обработанных раствором фибриногена (Gibco) чашках Петри (Sarstedt). Далее культивировали материал в обработанных флаконах объемом по 50 мл (Sarstedt 25 см2). Культивирование проводили при добавлении во флаконы по мл культуральной среды. В чашки Петри диаметром 3,5 см вливали по 3 мл культуральной среды. При использовании 24-луночного планшета в каждую лунку помещали по 1 мл среды. Стадии монослоя первичная клеточная культура достигала на 5-7 день, в это время ее пересеивали. После наступления состояния монослоя через 3 дня на 4-й сутки осуществляли пассирование. Культивирование клеток проводилось до 3 и 10 пассажа.
С целью иммуноцитохимического исследования культур и иммуногистохимического изучения образцов аутопсийного материала применяли следующие моноклональные антитела первичного типа: ММР-2 (Dako, США) и ММР-9 (Dako, США). Окрашивание препаратов проводилось по стандартному протоколу.
Морфометрическое изучение полученных структур проводили с использованием специального компьютерного комплекса для обработки изображений, полученных с помощью микроскопа. Комплекс включал в себя следующие элементы: микроскоп Olympus BX40, цифровую камеру Olympus, персональный компьютер, базирующийся на IntelPentium 5, программное обеспечение «VidеotestMorphology 5.2». В каждой пробе обрабатывали не менее 5 полей зрения при увеличении х200.
Экспрессию для маркеров с цитоплазматическим действием оценивали по площади, равной отношению площади покрытого иммунопозитивными клетками участка к общей площади клеток, расположенных в поле зрения. Для маркеров с ядерным выражением площадь экспрессии рассчитывали как отношение площади участка, содержащего иммунопозитивные ядра, к общей площади ядер, встречающихся в поле зрения. Площадь экспрессии измеряли в процентном отношении.
Полученные результаты обрабатывали методами вариационной статистики использованием программы Statistica 11.0. Вычисляли по каждой выборке среднее арифметическое, стандартное отклонение, доверительный интервал. Для каждой выборки доказано нормальное распределение значений. Статистическую однородность разных выборок проверяли с помощью критерия Крускала-Уоллиса (непараметрического однофакторного дисперсионного анализа). По критерию Стьюдента критический уровень достоверности нулевой гипотезы об отсутствии различий считали равным 0,01.
Результаты исследования и их обсуждение. В результате эксперимента было установлено, что площадь экспрессии молекул ММР-2 в аутопсийных образцах сердечной мышцы у пациентов средней, пожилой и старческой возрастной группы составила 0,74±0,18%, 0,82±0,22% и 0,80±0,20% соответственно, достоверных отличий не выявлено. При развитии ДК выраженность данного маркера значительно повысилась – в 5,7 раз у лиц средней возрастной группы, в 6 раз – у пожилых пациентов, в 6,8 раз – у пациентов старческого возраста. При ДК площадь экспрессии MMP-2 не зависела от возраста (рис. 1).

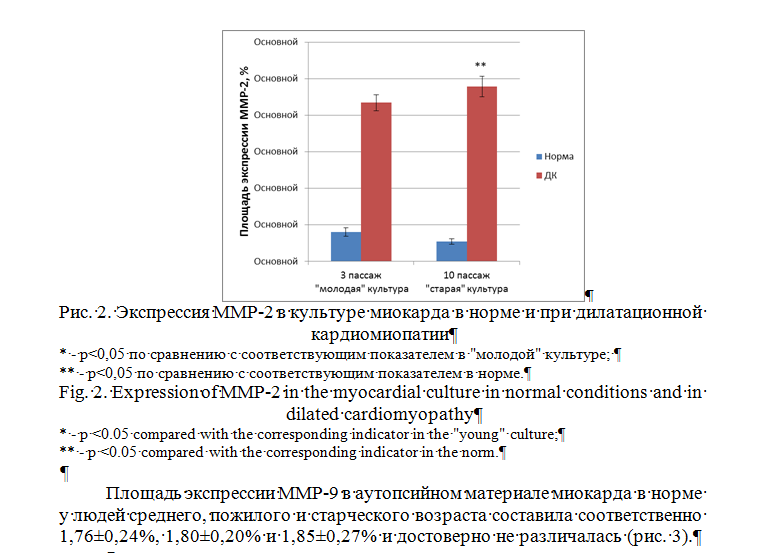
Экспрессия ММР-2 в «молодой» культуре миокарда в норме составила 0,40±0,06%. В «старой» культуре миокарда в норме этот показатель уменьшился в 1,5 раза и был равен 0,27±0,04%. При оценке экспрессии сигнальной молекулы ММР-2 при развитии ДК установили, что показатель ее площадь возрос в 5,4 раза в «молодых» клеточных культурах (2,17±0,11%), в 8,9 раз – в «старых» клеточных культурах (2,39±0,14%) по сравнению с нормой (рис.2).

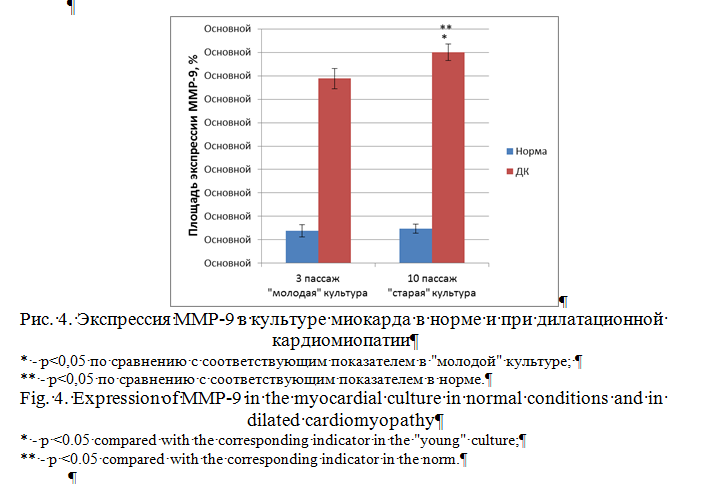
Выявлено увеличение в 4,5 раза экспрессии молекул ММР-9 при развитии ДК у пациентов всех возрастов. С возрастом площадь выражения молекул ММР-9 при ДК достоверно не изменялась.
Площадь экспрессии ММР-9 в «молодой» культуре миокарда в норме составила 0,69±0,13%. В «старой» культуре экспрессия этой сигнальной молекулы достоверно не изменилась и была равна 0,74±0,10%. Экспрессия ММР-9 в культурах, полученных от пациентов с ДК, увеличилась в «молодых» культурах в 5,7 раза по сравнению с соответствующей нормой и составила 3,94±0,22%, а в «старых» культурах – в 6 раз до 4,50±0,18% (рис.4). Изменение площади экспрессии MMP-9 в аутопсийном материале миокарда и в культуре миокарда имеет схожую тенденцию в норме и при ДК.

Установлено, что изменения площади экспрессии MMP-2, ММР-9 в аутопсийном материале миокарда в норме не наблюдалось. При ДК площадь экспрессии MMP-2 увеличивалась в 5,7 раза у людей средней возрастной группы, в 6 раз – у пожилых пациентов, в 6,8 раза – у людей старческой\го возрастного периода относительно соответствующего показателя в норме. Кроме того, наблюдалось увеличение экспрессии маркера ММР-2 в 1,5 раза при старении культуры кардиомиоцитов в норме. При этом в кардиомиоцитах, полученных от пациентов с ДК, в «молодых» культурах экспрессия ММР-2 повышалась в 5,4 раза, а в «старых» культурах – в 8,9 раза по сравнению с нормой. Полученные нами данные хорошо согласуются с результатами, описанными другими исследователями. Известно, что при ДК происходит повышение синтеза MMP-2 [14, 15].
Экспрессия ММР-9 в миокарде у пациентов с ДК всех возрастных групп повышалась в 4,5 раза по сравнению с соответствующей возрастной нормой. В культурах нормального миокарда при их старении экспрессия ММР-9 достоверно не изменялась. В культурах миокарда, полученного от пациентов с ДК, экспрессия ММР-9 повышалась в 5,7 и 6 раз соответственно для «молодых» и «старых» культур. В предыдущих исследования по данным литературы было обнаружено, что отмечалась повышенная экспрессия MMP-9 при наличии сердечно-сосудистых патологий, в том числе при развитии ДК, что соответствует полученными нами результатам [14, 16, 17]. Предполагается, что усиление экспрессии молекул MMP-2 и ММР-9 обусловлено тем, что данные металлопротеиназы относятся к полифункциональным протеинам и играют важную роль в таких процессах, как ангиогенез и апоптоз, которые патологически изменяются при развитии ДК [18, 19, 20].
Заключение. Ключевыми маркерами, характеризующими наличие дилатационнойкардиомиопатииу людей разного возраста в аутопсийном и культуральномматериале являются матриксные металлопротеиназы.




















Список литературы