Экспрессия мРНК IL-2, IL-10, IL-12 и IL-23 в децидуальной ткани у пациенток с неразвивающейся беременностью и самопроизвольными выкидышами ранних сроков
Aннотация
Актуальность: Невынашивание является одним из самых частых осложнений I триместра беременности и составляет около 15% среди всех диагностированных случаев беременности. Однако иммунные причины невынашивания изучены недостаточно. Цель исследования: Изучить особенности экспрессии мРНК IL-2, IL-10, IL-12 и IL-23, участвующих в дифференцировке Th1, Treg и Th17, в децидуальной ткани пациенток со спорадическим прерыванием беременности в I триместре (неразвивающейся беременностью и самопроизвольными выкидышами) на сроке 6-10 недель. Материалы и методы: 34 пациентки с неразвивающейся беременностью, 34 пациентки с самопроизвольными выкидышами и 57 пациенток с прогрессирующей беременностью (контрольная группа), поступивших для проведения медицинского аборта, были обследованы на сроке 6-10 недель беременности. Критериями исключения были: наличие тяжелых экстрагенитальных заболеваний, антифосфолипидного синдрома, эндокринных причин невынашивания, анатомических аномалий матки, подтвержденных хромосомных аномалий эмбриона и плода. Материалом для исследования являлась децидуальная ткань, полученная при выскабливании полости матки. Экспрессию мРНК IL-2, IL-10, IL-12 и IL-23 определяли с помощью обратнотранскриптазной количественной ПЦР. Статистический анализ проводили в программе Statistica 13.2 (Statsoft, USA) c использованием критерия Манна-Уитни. Результаты: Экспрессия мРНК IL-12 у пациенток с сампроизвольными выкидышами ранних сроков была достоверно выше, чем у пациенток контрольной группы. У пациенток с неразвивающейся беременностью экспрессия мРНК IL-12 достоверно не отличалась от контрольной группы. IL-12 обеспечивает дифференцировку Th1-лимфоцитов и стимулирует натуральные киллеры. Экспрессия мРНК IL-2, IL-10 и IL-23 в децидуальной ткани не имела достоверных различий с группой контроля как у пациенток с неразвивающейся беременностью, так и с самопроизвольными выкидышами ранних сроков. IL-2 обеспечивает дифференцировку регуляторных Т-лимфоцитов (Treg). IL-10 является противовоспалительным цитокином, секретируемым преимущественно Th2-лимфоцитами и Treg, и ингибирующим дифференцировку Th17-лимфоцитов. IL-23 обеспечивает дифференцировку Th17. Заключение: Таким образом, у пациенток c самопроизвольными выкидышами в децидуальной ткани наблюдается увеличение экспрессии мРНК IL-12, обеспечивающего дифференцировку Th1 лимфоцитов, по сравнению с контрольной группой. Так как и у пациенток с неразвивающейся беременностью, и с самопроизвольными выкидышами не было выявлено достоверных различий в экспрессии в децидуальной ткани мРНК IL-2, IL-10 и IL-23, регулирующих баланс Treg/Th17, необходимы дальнейшие исследования для оценки роли данных цитокинов в патогенезе невынашивания беременности.
Ключевые слова: невынашивание, неразвивающаяся беременность, самопроизвольный выкидыш, децидуальная ткань, эндометрий, мРНК, IL-2, IL-10, IL-12, IL-23
Введение. Невынашивание является одним из самых частых осложнений I триместра, составляя около 15% среди всех диагностированных случаев беременности [1].
Известно, что в норме в децидуальной ткани основной субпопуляцией Т-лимфоцитов являются Th2, в то время как количество Th1 лимфоцитов, активирующих клеточное звено иммунитета, снижается. При невынашивании беременности происходит сдвиг соотношения Th1/Th2 в сторону Th1 лимфоцитов [2]. Роль Th17 лимфоцитов и регуляторных Т-лимфоцитов (Treg) в невынашивании беременности ранних сроков изучена недостаточно [3].
Ранее мы показали, что у пациенток c неразвивающейся беременностью и самопроизвольными выкидышами ранних сроков в децидуальной ткани происходит увеличение экспрессии мРНК маркеров Th1, в то время как экспрессия маркера Th17 не отличается от группы контроля (женщин с прогрессирующей беременностью) [4]. В группе пациенток c самопроизвольными выкидышами ранних сроков также наблюдается увеличение экспрессии маркера Treg [4], что, по-видимому, происходит под влиянием простагландина E2 [5].
Целью работы было оценить экспрессию мРНК интерлейкина-2 (IL-2), интерлейкина-10 (IL-10), интерлейкина-12 (IL-12) и интерлейкина-23 (IL-23), участвующих в дифференцировке Th1, Th17 и Treg, в децидуальной ткани у пациенток со спорадическим прерыванием беременности в I триместре (неразвивающейся беременностью и самопроизвольными выкидышами ранних сроков).
Материалы и методы исследования. В проспективном исследовании было обследовано 125 женщин. Основную группу составили 68 пациенток со спорадическим самопроизвольным прерыванием беременности на сроке 6-10 недель: с неразвивающейся беременностью – 34 женщины (I группа), c самопроизвольным выкидышем – 34 пациентки (II группа). В качестве группы контроля были обследованы 57 здоровых женщин, поступивших для проведения искусственного аборта на тех же сроках, с нормально протекающей беременностью (III группа). Диагноз был установлен на основании клинических данных и результатов эхографического исследования и в дальнейшем подтвержден данными гистологического исследования. Критериями исключения были: доказанный эндокринный генез невынашивания беременности, антифосфолипидный синдром, наличие тяжелых экстрагенитальных заболеваний, анатомические изменения внутренних половых органов, подтвержденные хромосомные аномалии эмбриона и плода. Все пациентки подписали информированное добровольное согласие на проведение научных исследований и публикацию результатов без указания персональных данных.
Были проанализированы клинические и анамнестические данные беременных: возраст, социально-экономическое положение, профессиональные вредности, характер менструальной функции, морфометрические показатели.
Экспрессия в децидуальной ткани мРНК IL-2, IL-10, IL-12 и IL-23 была изучена методом обратнотранскриптазной количественной ПЦР в соответствии с руководством MIQE [6]. Материалом для исследования являлась децидуальная ткань, полученная при выскабливании полости матки. Характер ткани был подтвержден гистологически.
Образцы помещали в консервирующий раствор RNAlater («Ambion», США). Для выделения РНК из образцов пробирки размораживали при комнатной температуре, затем центрифугировали при 12000 об. («Eppendorf-5418R», Германия) в течение 5 – 10 минут, надосадочную жидкость удаляли. Полученный осадок представлял собой взвесь эпителиальных клеток, которые были пригодны для выделения РНК. Выделение РНК проводили методом фенол-хлороформной экстракции с использованием реагента «Тризол» («Invitrogen», США) согласно инструкции производителя. Качество РНК проверяли методом электрофореза в течение 15 минут при напряжении 10V/см по интенсивности свечения полос рибосомальной РНК в 1,1% агарозном геле с бромистым этидием. Для удаления геномной ДНК образцы были обработаны ДНКазой DNAse I RNAse free («Thermo Fisher Scientific», США) согласно инструкции производителя.
Обратная транскрипция была проведена с использованием oligoDT («Евроген», Россия) и набора «Обратная транскриптаза Mint» («Евроген», Россия) на амплификаторе «Терцик» («ДНК-технология», Россия). В реакцию вносили 500 нг РНК, предварительно прогретой до 55 градусов (концентрацию РНК проверяли на спектрофотометре Nanodrop («Thermoscientific», США)) и 4 мкл oligoDT (20 мкМ). Обратную транскрипцию проводили согласно инструкции производителя. Качество полученной кДНК оценивали с помощью гель-электрофореза в 1,1% агарозном геле с бромистым этидием. Для дальнейшей ПЦР использовали разведение полученной кДНК со стерильной водой в объеме 1:25.
Количественная ПЦР была выполнена на амплификаторе CFX96 («BioRad», США) с использованием набора qPCRmix-HS SYBR («Евроген», Россия). Подбор праймеров генов был выполнен с помощью базы данных BLAST (www.ncbi.nlm.nih.gov). В качестве генов-нормировщиков были использованы пептидилпролилизомераза А и β-актин.
Для приготовления смеси на одну пробирку вносили 2 мкл кДНК, по 2 мкл прямого и обратного праймера, 5 мкл смеси qPCRmix-HS SYBR, 14 мкл стерильной воды. Амплификацию проводили в следующем режиме: предварительная денатурация - 1 цикл 95 градусов Цельсия 5 мин, денатурация – 1 цикл 95 градусов Цельсия 30 с; отжиг при соответствующей каждому праймеру температуре – 30 с; элонгация при 68 градусах Цельсия – 30 с. Количество циклов – 45. Последовательности праймеров и температура амплификации указаны в таблице 1. Дополнительным этапом после амплификации была добавлена кривая плавления (melt curve) от 55 до 95 градусов Цельсия по 6 c для детекции возможных димеров праймеров.

Полученные результаты выражали в относительных единицах (отн. ед.), экспрессию генов вычисляли по формуле:
R= 2 - (Cq target-(Cq ref1+ Cq ref2)/2) ,
где R – нормализованная экспрессия мРНК исследуемого гена, Cq ref1 и Cq ref2 – Cq генов-нормировщиков, Cq target – Cq исследуемого гена [7].
Статистическая обработка результатов производилась с помощью программы «Statistica 13.2» (Statsoft, США). Нормальность распределения определяли с помощью критерия Колмогорова-Смирнова. Достоверность различий оценивали с помощью критерия Манна-Уитни, результаты представляли как медиану (нижний квартиль; верхний квартиль). Различия считали статистически достоверными при уровне значимости p≤0,05.
Результаты и их обсуждение. Исследуемые группы не имели достоверных различий по возрасту, сроку беременности, морфометрическим показателям (росту, весу, индексу массы тела). Все женщины являлись жительницами города Белгорода, имели среднее и высшее образование. Профессиональные вредности при сборе анамнеза выявлены не были. Не было установлено достоверных различий в возрасте менархе и продолжительности менструального цикла.
Экспрессия мРНК IL-12 в децидуальной ткани была достоверно выше у пациенток c самопроизвольными выкидышами по сравнению c группой контроля (табл. 2). У пациенток c неразвивающейся беременностью не было выявлено достоверных различий в экспрессии мРНК IL-12 по сравнению c контрольной группой.
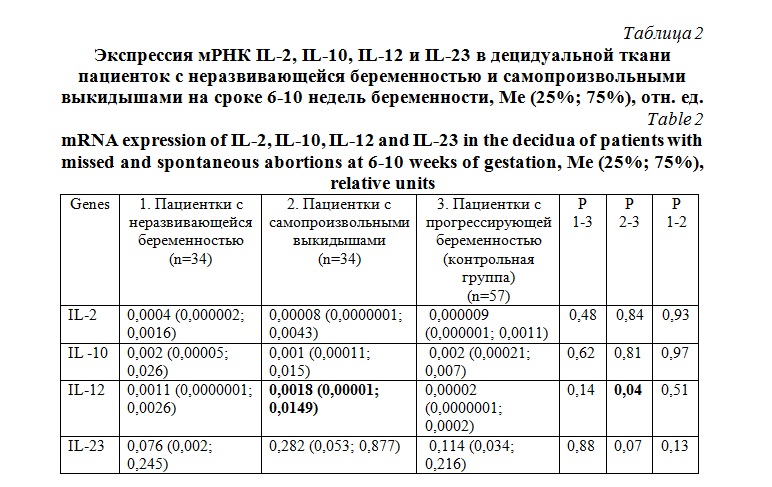
Экспрессия мРНК IL-2, IL-10 и IL-23 в децидуальной ткани у пациенток c неразвивающейся беременностью и самопроизвольными выкидышами ранних сроков не имела достоверных различий c группой контроля.
IL-12 обеспечивает дифференцировку Th1-лимфоцитов и активирует натуральные киллеры. IL-2 обеспечивает дифференцировку регуляторных Т-лимфоцитов Treg. IL-10 является противовоспалительным цитокином, который секретируется преимущественно Th2-лимфоцитами и Treg, и ингибирует дифференцировку Th17. IL-23 обеспечивает дифференцировку Th17 [8].
Несмотря на большое количество работ, посвященных роли цитокинов IL-2, IL-10, IL-12 и IL-23 в патогенезе невынашивания беременности ранних сроков, полученные в них данные являются разнородными и противоречивыми. Были изучены уровни вышеуказанных цитокинов в сыворотке крови, способность мононуклеарных клеток крови секретировать цитокины invitro, а также экспрессия цитокинов в децидуальной ткани на уровне мРНК и белка как во время беременности у пациенток со спорадическими выкидышами и привычным невынашиванием беременности, так и вне беременности у пациенток c невынашиванием в анамнезе.
В нашей работе мы не выявили достоверных различий в экспрессии мРНК IL-12 и IL-2 в децидуальной ткани пациенток с неразвивающейся беременностью, а также IL-2 у пациенток c самопроизвольными выкидышами. Однако экспрессия мРНК IL-12 у пациенток c самопроизвольными выкидышами была достоверно выше, чем в группе контроля.
Данные литературы об особенностях экспрессии IL-12 и IL-2 в децидуальной ткани, а также об их уровне в сыворотке крови у пациенток с невынашиванием достаточно противоречивы.
В сыворотке крови пациенток со спорадическими самопроизвольными выкидышами не было выявлено достоверных различий в концентрации IL-12 по сравнению женщинами, имевшими прогрессирующую беременность [9]. В сыворотке крови пациенток c неразвивающейся беременностью было выявлено как увеличение уровня IL-12 [10], так и отсутствие достоверных различий c женщинами, имевшими прогрессирующую беременность [11].
В исследовании Wilson R. et al. (2004) была проведена оценка уровня IL-12 в сыворотке крови у пациенток c прогрессирующей беременностью раннего срока, имевших привычное невынашивание в анамнезе. Далее пациентки были разделены на две группы: женщин, у которых произошла потеря данной беременности в I триместре, и пациенток, у которых беременность завершилась рождением ребенка. В первой группе пациенток уровень IL-12 был достоверно выше, чем во второй группе, а также выше, чем в группе здоровых беременных женщин c неотягощенным анамнезом [12]. Однако у пациенток c привычным невынашиванием, поступивших во время прерывания данной беременности, не было выявлено достоверных различий уровня IL-12 в сыворотке крови по сравнению c контрольной группой (прогрессирующая беременность) [9].
Работы, посвященные особенностям экспрессии IL-12 в децидуальной ткани, являются единичными. У пациенток, поступивших со спорадическими самопроизвольными выкидышами, не наблюдалось достоверных различий экспрессии IL-12 на уровне белка в лимфоцитах, моноцитах и гранулоцитах, полученных из децидуальной ткани, по сравнению c группой контроля (прогрессирующая беременность) [13]. Однако в данной работе авторы исключили из исследования образцы, в которых имелись гистологические признаки воспаления.
Вне беременности были изучены особенности экспрессии IL-12 и IL-2 в эндометрии, а также уровни данных цитокинов в сыворотке крови у пациенток c привычным невынашиванием. В фолликулярную фазу менструального цикла у данной группы пациенток не было выявлено достоверных различий в уровне IL-12 и IL-2 в сыворотке крови по сравнению c группой здоровых небеременных женщин [14]. Однако в середине секреторной фазы менструального цикла у пациенток c привычным невынашиванием в анамнезе методом ИФА было выявлено увеличение IL-12 и в эндометрии, и в сыворотке крови по сравнению c пациентками c неотягощенным акушерским анамнезом [15]. В другом исследовании в периимплантационный период у пациенток c привычным невынашиванием в анамнезе было обнаружено увеличение экспрессии мРНК IL-12 и IL-2 в эндометрии по сравнению c женщинами, имевшими прогрессирующую беременность. Однако на уровне белка различий в экспрессии IL-12 выявлено не было [16].
В нашей работе не было выявлено достоверных различий в экспрессии мРНК IL-10 в децидуальной ткани у пациенток c неразвивающейся беременностью и c самопроизвольными выкидышами ранних сроков по сравнению c контрольной группой (прогрессирующая беременность). Однако, по данным литературы, уровень IL-10 в сыворотке крови у пациенток c неразвивающейся беременностью был достоверно ниже, чем у пациенток c прогрессирующей беременностью [17]. У пациенток с привычным невынашиванием неустановленного генеза, обследованных во время прерывания данной беременности, в мононуклеарных клетках крови было выявлено снижение секреции IL-10 [18, 19] и увеличение IL-2 по сравнению c пациентками, имевшими прогрессирующую беременность [18, 19, 20].
В децидуальной ткани у пациенток c неразвивающейся беременностью наблюдалось значительное снижение IL-10 на уровне белка по сравнению c пациентками c прогрессирующей беременностью [21]. У беременных c привычным невынашиванием, поступивших c прервавшейся беременностью, экспрессия IL-10 в децидуальной ткани на уровне мРНК и белка была достоверно ниже, чем у женщин c прогрессирующей беременностью [22, 23].
У небеременных женщин c привычным невынашиванием в анамнезе наблюдалось снижение экспрессии IL-10 в пролиферативную фазу цикла [24], однако в секреторную фазу цикла не было выявлено достоверных различий по сравнению c пациентками без отягощенного анамнеза [24, 25].
В нашей работе не было выявлено достоверных различий в экспрессии мРНК IL-23 у пациенток c неразвивающейся беременностью и c самопроизвольными выкидышами ранних сроков по сравнению c контрольной группой. По данным литературы, не было выявлено достоверных различий в концентрации IL-23 в сыворотке крови и у пациенток со спорадическими самопроизвольными выкидышами, и у пациенток c привычным невынашиванием, поступивших во время прерывания данной беременности, по сравнению c группой контроля (прогрессирующая беременность) [9].
Однако в других работах у пациенток с привычным невынашиванием неустановленного генеза, обследованных во время прерывания данной беременности, было выявлено увеличение IL-23 в сыворотке крови, а также в децидуальной ткани и на уровне мРНК [26], и на уровне белка [23, 26].
У небеременных женщин с привычным невынашиванием неустановленного генеза в анамнезе в середине секреторной фазы менструального цикла в мононуклеарных клетках крови экспрессия мРНК IL-23 была выше, чем у пациенток с неосложненным репродуктивным анамнезом [27].
Таким образом, данные литературы об особенностях экспрессии IL-2, IL-10, IL-12 и IL-23 в децидуальной ткани, мононуклеарных клетках крови, а также о содержании данных цитокинов в сыворотке крови при невынашивании беременности являются противоречивыми. В нашей работе было выявлено увеличение экспрессии мРНК IL-12 в децидуальной ткани у пациенток с самопроизвольными выкидышами, что подтверждает полученные ранее данные о сдвиге соотношения Th1/Th2 в сторону Th1 лимфоцитов. Так как мы не выявили достоверных различий в экспрессии мРНК IL-2, IL-10 и IL-23 в децидуальной ткани у пациенток с неразвивающейся беременностью и самопроизвольными выкидышами, а данные других исследований являются противоречивыми, требуются дальнейшие исследования для оценки роли Treg и Th17 в патогенезе невынашивания беременности ранних сроков.
Заключение. В нашей работе было выявлено увеличение экспрессии мРНК IL-12 в децидуальной ткани у пациенток c самопроизвольными выкидышами, что подтверждает наличие сдвига соотношения Th1/Th2 в сторону Th1. Так как достоверных различий в экспрессии мРНК IL-2, IL-10 и IL-23 в децидуальной ткани у пациенток с неразвивающейся беременностью и самопроизвольными выкидышами выявлено не было, а ранее мы также не выявили достоверных различий в экспрессии мРНК маркеров Treg и Th17, необходимы дальнейшие исследования для оценки роли данных субпопуляций Т-лимфоцитов в патогенезе невынашивания беременности ранних сроков.
В отношении данной статьи не было зарегистрировано конфликта интересов.
Благодарности
Работа выполнена при поддержке гранта Президента РФ МД-2326.2017.7«Разработка молекулярных методов индивидуального прогнозирования невынашивания беременности ранних сроков».




















Список литературы