Популяционный анализ полиморфного маркера rs1002149 гена глутатионредуктазы у жителей Республики Башкортостан и Абхазии
Aннотация
Актуальность: Занимая одно из центральных позиций в клеточной антиоксидантной защите, глутатионредуктаза (GSR) определяет окислительный статус клетки. Уровень ее активности изменяется в определенных физиологических и патологических условиях. Полиморфный локус rs1002149 гена GSR, ассоциированный с уровнем активности фермента, является потенциальным молекулярно-генетическим маркером сложно-наследуемых признаков (старение, многофакторные заболевания). Так как глутатионовая система отвечает за характер взаимодействия с факторами внешней среды, важно учитывать особенности работы компонентов этой системы, в частности GSR, в популяциях, проживающих в условиях среды с разной техногенной нагрузкой. Цель исследования:Цель работы состояла в популяционно-генетическом анализе аллельного состояния по полиморфному маркеру rs1002149 гена GSR в разных этнических группах, проживающих в контрастных экологических условиях – у русских, башкир, татар (жителей Республики Башкортостан) и коренных жителей Абхазии. Материалы и методы:Материалом послужили образцы ДНК 1649 мужчин и женщин в возрасте от 21 до 89 лет, не родственных между собой, представителей четырех этнических групп – русские (N=443), башкиры (N=453), татары (N=615), абхазы (N=138). Идентификацию аллельных вариантов гена GSR выполняли методом РТ-ПЦР с использованием TaqMan-зондов. Для статистического анализа результатов исследования использовали компьютерные программы SPSS (v. 13.0), GENEPOP и Arlequin 3.0. Этническую гетерогенность оценивали с помощью теста Фишера. Результаты:Все четыре этнические группы показали отсутствие статистически значимых различий в спектре распределения генотипов (Р>0,05). Аллель T в этнической группе татар встречается чаще, чем в этнической группе башкир (22,68% против 18,65%, Р=0,024). Частоты генотипов у русских и башкир (но не у татар и абхазов) соответствует таковым у народов Европы. Все четыре этнические группы не отличаются от жителей Южной Америки. Наблюдается существенная гетерогенность (за исключением японцев, бенгальцев и нигерийцев) изучаемых нами четырех этнических групп с популяциями Восточной, Южной Азии и Африки. Заключение:Минорный аллель T, ассоциированный с более высокой активностью фермента глутатионредуктазы, в этнической группе татар встречается чаще, чем в этнической группе башкир.
Ключевые слова: экологическая адаптация, этническая группа, метаболизм ксенобиотиков, глутатионредуктаза, ген GSR, генетический полиморфизм
Введение. Качество жизни человека во многом определяется способностью его организма успешно приспосабливаться к определенным условиям окружающей среды. Такие показатели, как особенности онтогенеза, средняя продолжительность жизни (ПЖ), репродуктивный потенциал, являются адаптивными характеристиками организма и зависят от факторов окружающей среды (место проживания, экология и др.), образа жизни (степень традиционности культуры, особенности питания и т.д.), генетической конституции [1, 2].
Генетическая предрасположенность к формированию определенного фенотипа, будь то заболевание, адаптация к экологическим условиям, устойчивость к фармацевтическому препарату или долголетие, в большинстве случаев определяется сочетанием аллелей многих генов. Для выявления таких аллелей в качестве маркеров используют сцепленные с ними полиморфные локусы генома. Одним из наиболее распространенных типов генетического полиморфизма в геноме человека является однонуклеотидный полиморфизм (Single Nucleotide Polymorphism, SNP). Так, определение индивидуальной генетической предрасположенности к той или иной патологии с применением SNP-маркеров может быть использовано в клинической практике для выявления лиц, входящих в группу повышенного риска развития заболевания [3]. Выявление маркеров «генетической устойчивости» к тому или иному лекарственному препарату позволяет подобрать индивидуальную тактику лечения пациента. Кроме того, знание особенностей функционирования метаболических путей, которые имеют во многом генетическую предпосылку, может сориентировать человека на определенный тип физической активности и питания, что обеспечит его организму лучшую адаптацию к внешним условиям жизни.
Ведущее место в определении характера реакции внутренней среды организма на внешние агенты занимает система детоксикации ксенобиотиков [4]. К настоящему времени определено множество SNP-маркеров генов ферментов, участвующих в метаболизме ксенобиотиков, ассоциированных с целым рядом мультифакторных заболеваний, ограничивающих ПЖ [5-8]. Также изучается вопрос о роли полиморфных вариантов генов системы детоксикации в развитии старения [4, 9, 10].
Важную роль в метаболизме ксенобиотиков и побочных продуктов эндогенного происхождения играет глутатионовая система. Глутатион (GSH) регулирует редокс-потенциал клетки, обеспечивает антиоксидантную защиту организма, а также нейтрализует токсичные продукты, возникающие в процессе метаболизма ксенобиотиков. Данный белок присутствует в клетке в двух формах – восстановленной (GSH) и окисленной (GSSG). Окисленный глутатион восстанавливается под действием фермента глутатион-дисульфидредуктазы (или глутатионредуктазы) - GSR, который постоянно находится в клетке в активном состоянии. GSR индуцируется в условиях повышенного фона активных форм кислорода. Таким образом, уровень данного фермента в клетке является достоверным индикатором окислительного стресса.
Уровень активности GSR изучается как на модельных объектах, так и у людей при некоторых физиологических и патологических состояниях. В исследованиях на крысах было показано, что активность GSR была снижена в сетчатке животных с диабетом [11]. У людей с возрастной макулярной дегенерацией также была обнаружена значительно более низкая активность GSR в крови по сравнению с контролем [12]. Однако в работе [13], напротив, повышение экспрессии GSR было ассоциировано с хронической обструктивной болезнью легких (ХОБЛ). Работ, посвященных изучению транскрипционной активности гена GSR у лиц разного возраста, обнаружено немного, и результаты их противоречивы [12, 14, 15].
Ген GSR расположен на хромосоме 8p21.1 и состоит из 13 экзонов, охватывающих 50 кб. Согласно сведениям электронной базы данных GeneCards, данный ген содержит более 12 тысяч SNP-полиморфных сайтов [https://www.genecards.org/cgi-bin/carddisp.pl?gene=GSR#snp]. Для некоторых из них показаны ассоциации с распространенными заболеваниями [8, 16-18].
Один из значимых полиморфных локусов – rs1002149 – находится в области промотора, и его аллельное состояние может влиять на уровень экспрессии гена GSR [19]. Частота редкого аллеля T, ассоциированного с повышенной активностью фермента [18], варьирует в популяциях мира и отражена на сайте проекта Ensembl [https://grch37.ensembl.org/index.html].
Для изучения адаптации к условиям среды важно исследование групп разного происхождения, проживающих в сходных условиях, а также групп общего происхождения, проживающих в контрастных условиях [20]. И поскольку система метаболизма ксенобиотиков в целом, и его глутатионовый кластер в частности, отвечает за характер взаимодействия с факторами окружающей среды, интересно проследить особенности работы компонентов именно этой системы, у индивидов, принадлежащих к разным этническим группам, и проживающих в условиях среды, по-разному испытывающих техногенную нагрузку. На территории Республики Башкортостан (РБ) находится достаточное количество промышленных объектов, которые негативно влияют на ее экологию. Абхазия же, напротив, – республика с благоприятными для ее населения экологическими условиями. В доступных нам публикациях и электронных базах данных не обнаружено сведений по частотам молекулярно-генетического маркера rs1002149 гена GSR в основных этнических группах, населяющих территорию Республики Башкортостан, а также у коренных жителей Абхазии.
Цель исследования. Цель работы состояла в популяционно-генетическом анализе аллельного состояния по полиморфному маркеру rs1002149 (-386C>A) гена GSR в разных этнических группах, проживающих в контрастных экологических условиях – у русских, башкир, татар и абхазов.
Материалы и методы исследования. В исследование включили 1649 человек в возрасте от 17 до 89 лет, мужчин и женщин, не родственных между собой. Выборка состоит из представителей четырех этнических групп, три из которых проживают на территории РБ – русские (443 человека), башкиры (453 человека), татары (615 человек); четвертая группа – коренные жители Абхазии (138 человек). Этническую принадлежность определяли путем индивидуального опроса с уточнением национальности по обеим родительским линиям до третьего поколения. Анкетирование и забор биологического материала (8 мл крови из локтевой вены) проводили после получения информированного добровольного согласия исследуемых на использование биологического материала и демографических сведений.
Образцы геномной ДНК выделяли с помощью метода фенол-хлороформной экстракции из лимфоцитов цельной венозной крови. Идентификацию аллелей гена GSR проводили методом полимеразной цепной реакции (ПЦР) с детекцией результатов в режиме реального времени в формате FLASH (Fluorescent Amplification-based Specific Hybridization) с использованием коммерческих комплементарных полиморфному участку ДНК флуоресцентных TaqMan-зондов и наборов реагентов в соответствии с протоколом фирмы-изготовителя (http://evrogen.ru//) на амплификаторе StepOnePlus производства компании “Applied Biosystems” (США). Для статистического анализа результатов исследования использовали компьютерную программу GENEPOP, а также пакет программ SPSS (v. 13.0). Этническую гетерогенность оценивали с помощью теста Фишера в программе Arlequin 3.0.
Результаты и их обсуждение. В четырех этнических группах, проживающих в разных эколого-географических условиях (РБ и Абхазия) охарактеризован полиморфный локус rs1002149 гена GSR. Эмпирически наблюдаемое распределение частот генотипов находится в соответствии с теоретически ожидаемым равновесным распределением Харди-Вайнберга (P>0,05, табл. 1) во всех исследованных группах.
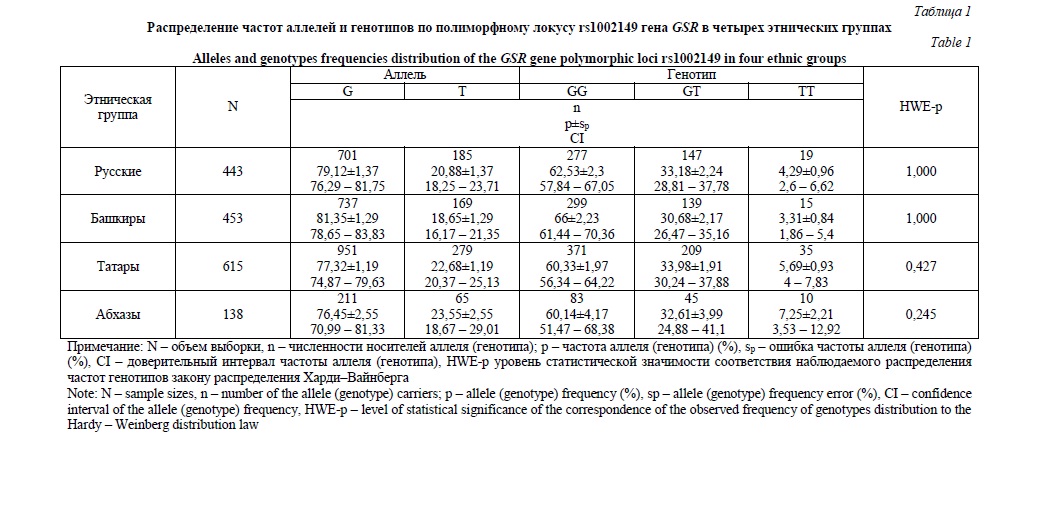
Результаты этнической гетерогенности анализируемых групп представлены в табл. 2. По спектру распределения частот аллелей и генотипов наиболее схожими между собой оказались этнические группы татар и абхазов: частоты аллелей G и T в этих двух группах составили соответственно 77,32% и 22,68% среди татар и 76,45% и 23,55% среди абхазов (Р=0,751). Частоты аллелей и генотипов в этнической группе русских также мало отличаются от всех остальных исследованных групп – башкир (Р=0,260 для аллелей и 0,509 для генотипов), татар (Р=0,338 для аллелей и 0,555 для генотипов) и абхазов (Р=0,357 для аллелей и 0,386 для генотипов). Этнические группы башкир и абхазов показали отсутствие статистически значимых различий в спектре распределения аллелей (Р=0,084) и генотипов (Р=0,111). В то же время попарное сравнение частот аллелей и генотипов показало, что со значимостью на уровне тенденции среди абхазов чаще, чем у башкир, встречаются аллель Т (23,55% против 18,65%, Р=0,084) и генотип Т/Т (7,25% против 3,31%, Р=0,054). Показатель гетерогенности этнических групп башкир и татар по распределению генотипов в анализируемом полиморфном локусе оказался близок к статистическому уровню значимости отличий (Р=0,065). Это обусловлено снижением на уровне тенденции частоты генотипа G/G среди татар по сравнению с башкирами (60,33% против 66%, Р=0,063) и повышением, также на уровне тенденции, частоты генотипа T/T в соответствующих этнических группах (5,69% против 3,31%, Р=0,078). Частоты аллелей G и T, составляющие 77,32% и 22,68% в группе татар и 81,35% и 18,65% в группе башкир, статистически значимо отличаются друг от друга (Р=0,024).
Таким образом, выявлены различия в характере распространения частот аллелей у представителей разных этнических групп, проживающих на одной территории: минорный аллель T, ассоциированный с более высокой активностью фермента глутатионредуктазы, в этнической группе татар встречается чаще, чем в этнической группе башкир. Несмотря на то, что эти этнические группы относятся к одной языковой семье – тюркской, популяционно-генетические исследования выявили достаточную гетерогенность между татарами и башкирами [21]. Возможно, что в формировании генетического профиля изучаемых в данной работе этносов могут быть затронуты достаточно древние адаптационные механизмы, формирующиеся на фоне определенного образа жизни и пищевого поведения.
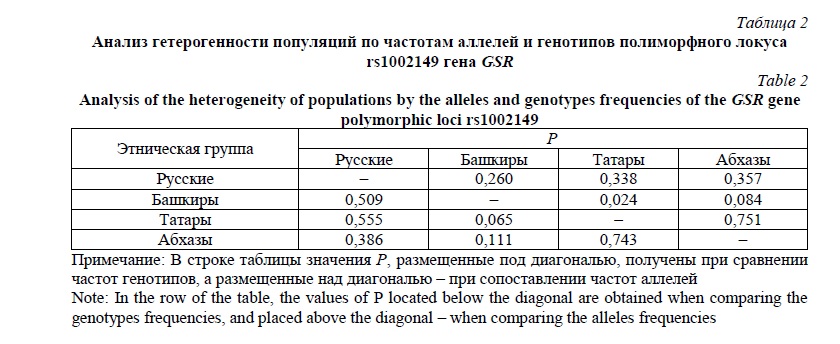
Для более полного понимания и возможности анализа результатов нашего исследования важно сопоставить их с данными, полученными в популяциях других народов. С этой целью мы воспользовались ресурсом проекта Ensembl [https://grch37.ensembl.org/index.html]. Согласно результатам этой базы данных, частоты аллелей и генотипов по полиморфному маркеру rs1002149 гена GSR в популяциях разных народов мира имеют межэтнические и межрасовые различия. В популяциях народов европеоидной принадлежности частота минорного аллеля T в среднем составляет 15,6% и варьирует от 13,7% у британцев до 17,2% у коренных жителей северной и западной Европы (Utah). Средняя частота аллеля T в популяциях народов Восточной Азии составляет 14,9%; однако при этом необходимо отметить широкую вариабельность частоты данного аллеля даже внутри одной этнической группы. Так, у ханьцев, проживающих на разных территориях, она изменяется в два раза, от 10,5 до 20,9%. У жителей Америки частота аллеля T в среднем составляет 20,3%. С существенно более высокой частотой данный аллель представлен в популяциях негроидного происхождения (28,1% в среднем) и у представителей народов, населяющих Южную Азию (средняя частота – 30,5%).
Сведения о спектре распределения частот аллелей и генотипов по генетическому маркеру rs1002149 гена GSR в некоторых этнических группах мира и оценка степени гетерогенности этих выборок с этническими группам русских, татар и башкир из РБ и абхазами представлены в табл. 3. Среди народов мира, имеющих единое расовое происхождение, а также территориально и культурно схожих, отмечается высокий уровень гетерогенности. Это отразилось на полученных нами результатах сравнения распределения частот аллелей и генотипов по изучаемому локусу. Так, русские и башкиры оказались схожи с представителями европейских популяций и жителями Южной Америки; последние также не отличаются ни от татар, ни от абхазов. В то же время у татар и абхазов спектр частот по генетическому маркеру rs1002149 гена GSR отличается от такового у народов Европы. Представители индийского этноса закономерно отличаются от изученных этнических групп РБ по частоте минорного аллеля, однако бенгальцы оказались схожи со всеми четырьмя группами, вошедшими в данную работу. Схожая картина наблюдается при сопоставлении изучаемых нами этнических групп с популяциями Восточной Азии и Африки. Если южные ханьцы и вьетнамцы (Восточная Азия) и гамбийцы и лухья (Африка) проявили существенную гетерогенность по отношению к жителям РБ и Абхазии, то японцы и нигерийцы оказались схожи со всеми четырьмя этническими группами.
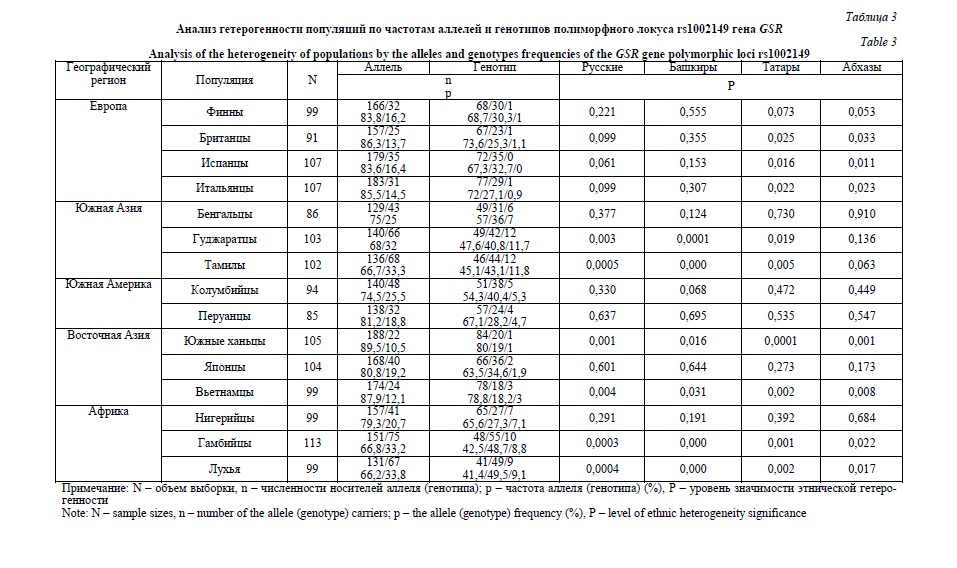
Таким образом, высокий уровень гетерогенности распределения частот аллелей в сайте -386C>A гена GSR у представителей разных этнических групп мира свидетельствует о возможном участии глутатионредуктазы в адаптации к определенным условиям жизни. Однако, сложно однозначно сказать, какие именно внешние факторы могли служить пусковым механизмом для формирования определенного молекулярно-генетического профиля по гену GSR в разных этносах. Возможно, что определенное сочетание климато-географических и экологических условий, включая, в частности, техногенную нагрузку, пищевой рацион, уровень инсоляции, способны модулировать чувствительность глутатионовой системы организма, что закономерно сказывается на работе фермента GSR, конвертирующего окисленный глутатион в его восстановленную форму. Как было установлено, активность GSR стимулируется в условиях окислительного стресса на фоне повышенного уровня свободных радикалов. При нормальных физиологических реакциях возрастание доли активных форм кислорода наблюдается при увеличении концентрации кислорода в воздухе, повышении степени инсоляции. В связи с этим можно предположить, что у населения более южных регионов земли повышенный уровень GSR может считаться адаптивным механизмом для проживания в среде с достаточно высокой степенью солнечной радиации. Принимая во внимание тот факт, что аллель T ассоциирован с усиленной активностью фермента, наблюдаемая в этнических группах жителей Африки и Южной Азии высокая частота данного аллеля – вполне закономерное явление, которое можно рассматривать как пример генетической адаптации. Среди жителей высокогорья, теоретически, активность GSR может быть менее интенсивна в силу снижения концентрации кислорода с увеличением высоты. Однако, скорее всего, это изменение не столь велико для тех популяций, которые живут на высоте, являющейся формальной границей высокогорья и не превышающей 2500 м (в том числе и для изучаемой в данной работе этнической группы абхазов) [22]. Для выяснения роли активности данного фермента в адаптации к высокогорью необходимо изучить те этнические группы, представители которых живут на высоте свыше 3-4 тысяч метров над уровнем моря, где концентрация кислорода изменяется настолько, что может играть существенную роль для формирования генетической адаптации.
Достижение человеком долголетия является ярким примером успешной адаптации. Поэтому при анализе популяционно-генетических исследований нам представляется важным учитывать возрастной аспект. Возраст является одним из факторов, инициирующих повышение уровня свободных радикалов в клетке. Однако работ по изучению возможной ассоциации уровня экспрессии и полиморфного состояния гена GSR с данным физиологическим фактором совсем немного. Так, еще в работе 1998 года было выявлено значительное повышение активности GSR в эритроцитах долгожителей, в сравнении с группой пожилых людей [14]. В более позднем исследовании показано, что возраст не влиял на уровень GSR, хотя в старшей группе наблюдалась тенденция к повышению активности фермента [15]; здесь необходимо отметить, что это исследование проводилось на выборке из индивидов в возрасте от 27 до 45 лет, то есть на лицах только зрелого возраста, поэтому сложно сделать однозначные выводы в отношении активности фермента у лиц старшего возраста. Была установлена связь полиморфного маркера rs1002149 гена GSR с таким возраст-ассоциированным клиническим фенотипом, как снижение минеральной плотности костной ткани в постменопаузе [16]. Также было показано, что редкий аллель T гена GSR отрицательно коррелирует с выживаемостью среди супердолгожителей (лиц старше 110 лет) [19].
Таким образом, согласно данным литературы, минорный аллель T ассоциирован с более высокой активностью фермента глутатионредуктазы, является аллелем риска для некоторых сложно-наследуемых заболеваний и его частота, вероятно, коррелирует с возрастом. В нашей работе частота данного аллеля увеличивается в ряду «башкиры-русские-татары-абхазы» (для пары групп татары и башкиры Р=0,024). Такой результат вписывается в предполагаемые параметры распределения частоты аллеля T в мире, определяющими факторами которого могут выступать широтный фактор, уровень инсоляции. Влияние уровня техногенной нагрузки на характер распределения частот генотипов по полиморфному маркеру rs1002149 гена GSR в данном исследовании установить не удалось.
Выводы. Анализ гетерогенности некоторых популяций мира с этническими группам русских, татар и башкир из РБ и абхазами выявил соответствие спектра частот у русских и башкир (но не у татар и абхазов) таковому у народов Европы. Анализируемые группы не отличаются от жителей Южной Америки. Наблюдается существенная гетерогенность (за исключением японцев, бенгальцев и нигерийцев) изучаемых нами этнических групп с популяциями Восточной, Южной Азии и Африки. Все четыре этнические группы показали отсутствие статистически значимых различий в спектре распределения генотипов (Р>0.05). В то же время в характере распространения частот аллелей у представителей разных этнических групп, проживающих на одной территории, выявлены различия: аллель T в этнической группе татар встречается чаще, чем в этнической группе башкир (22,68% против 18,65%, Р=0,024). Достаточно высокая частота аллеля T и генотипа Т/Т обнаружена у абхазов – 23,55% и 7,25%. Минорный аллель T ассоциирован с более высокой активностью фермента глутатион-сульфоксидредуктазы. Возможно, повышенная частота данного аллеля у татар и абхазов является эволюционно-адаптивным генетическим механизмом к некоторым экологическим факторам, таким, как, например, уровень инсоляции (у абхазов), характер пищевого поведения и образа жизни.
В отношении данной статьи не было зарегистрировано конфликта интересов.
Благодарности
Исследование выполнено при финансовой поддержке РФФИ и АНА в рамках научного проекта № 19-54-40007; биологический материал (ДНК) для исследования взят из коллекции биологических материалов человека ИБГ УФИЦ РАН, поддержанной программой биоресурсных коллекций ФАНО России (соглашение №007-030164/2); работа проведена с использованием оборудования ЦКП "Биомика" и УНУ "КОДИНК" (ИБГ УФИЦ РАН).




















Список литературы