Роль полиморфных вариантов гена контактин-ассоциированно-подобного белка-2 (CNTNAP2) в формировании различий в уровнях тревожности
Aннотация
Актуальность: Изучение многофакторной природы формирования тревожности обусловлено ее участием во многих аспектах развития человека: физического и психического здоровья, функционировании эмоциональной сферы и общения, учебной деятельности и других. В свою очередь, излишняя тревожность может приводить к развитию различных психопатологий, включая депрессивное, суицидальное, аддиктивное поведение, что обуславливает ее социальную значимость. Кроме классических путей моноаминергической нейротрансмиссии в формирование индивидуальных различий в уровне тревожности могут быть вовлечены нейробиологические механизмы, обуславливающие вариации в синаптической пластичности и нейротрофике. Контактин-ассоциированно-подобный белок-2 (contactin associated protein-like 2, Caspr2, кодируется геном CNTNAP2, 7q35) является важным элементом, вовлеченным в регуляцию этого процесса. Изменения в последовательности гена CNTNAP2 связывают с формированием ряда психопатологий и аффективных фенотипов. Цель исследования:Целью настоящего исследования являлась оценка основного эффекта полиморфных вариантов rs2530310, rs2710102 и rs10251794 гена CNTNAP2 и гаплотипического эффекта в формировании индивидуальных вариаций в уровне ситуативной и личностной тревожности у психически здоровых индивидов 17-24 лет разной этнической принадлежности. Материалы и методы:Уровень ситуативной и личностной тревожности был оценен с помощью опросника Спилбергера-Ханина у 523 психически здоровых индивидов (75,7% женщин) из Республики Башкортостан (средний возраст 20,99±3,32 лет) разной этнической принадлежности. Генотипирование полиморфных локусов rs2530310, rs2710102 и rs10251794 в гене CNTNAP2 проведено с помощью ПЦР. Оценка основного эффекта полиморфных локусов и гаплотипов гена CNTNAP2 в вариации уровня тревожности осуществлялась в ходе линейного регрессионного анализа (PLINK v.1.09). Результаты:Была выявлена ассоциация полиморфного локуса rs10251794 гена CNTNAP2 с вариациями в уровне ситуативной тревожности как в общей выборке (β = 1,97; P = 0,002; PFDR = 0,007), так и среди мужчин (β = 3,14; P = 0,011; PFDR = 0,032) при рассмотрении аддитивного (A/A vs. A/T vs. T/T в локусе rs10251794) и доминантного эффекта аллеля (A/A + A/T vs. T/T в локусе rs10251794). Заключение:Полученные данные указывают на возможную вовлеченность гена контактин-ассоциированно-подобного белка-2, участвующего в регуляции синаптической пластичности и нейрогенеза, в формирование индивидуальных различий в эмоциональной сфере.
Ключевые слова: тревожность, контактин, синаптическая пластичность, анализ ассоциаций, психогенетика, полиморфный локус
Введение. В течение нескольких последних десятилетий российскими и зарубежными специалистами в области психогенетики и смежных дисциплин активно исследуются различные формы тревожности и сопутствующих аффективных расстройств (депрессии, суицидального поведения, биполярного расстройства, агрессии, и др.). Такой интерес обусловлен влиянием тревоги на многие аспекты развития человека: физическое и психическое здоровье, развитие эмоциональной сферы и общение, учебную деятельность и т.д. Именно тревожность лежит в основе целого ряда психологических трудностей, в том числе многих нарушений развития [1]. Известно, что тревожность у человека определяется как комплексный феномен, характеризующийся специфическими когнитивными, аффективными и поведенческими реакциями на уровне целой личности в зависимости от степени выраженности в индивидуальном эмоциональном пространстве объективных и субъективных источников угрозы [2]. С эволюционной точки зрения тревожность была необходима индивиду для того, чтобы избежать опасности [3]. Однако, излишняя тревожность может приводить к развитию различных психопатологий, включая депрессию, СП, АП, аддиктивное поведение, что обуславливает ее социальную значимость. Излишняя тревожность в детском возрасте препятствует нормальному усвоению школьной программы, проблемам в социальной адаптации, что впоследствии может привести к развитию девиантного (кондуктивного) поведения, с одной стороны, и попыткам суицида, с другой.
Формирование тревожности имеет многофакторную природу, поскольку обусловлено вовлеченностью как генетического (эпигенетического), так и средового компонента. Согласно данным близнецовых исследований, коэффициент наследуемости уровня тревожности составляет 30-41% [4], что способствовало проведению многочисленных молекулярно-генетических исследований, выявивших взаимосвязь между определенными вариантами генов нейромедиаторных систем мозга, серотонинергической системы, в частности, и индивидуальными различиями в уровне тревожности [5]. Кроме классических путей моноаминергической нейротрансмиссии в формирование индивидуальных различий в уровне тревожности могут быть вовлечены нейробиологические механизмы, обуславливающие вариации в синаптической пластичности и нейротрофике [6]. Последний механизм представляет собой способность синапсов к функциональным и морфологическим перестройкам в процессе синаптической активности. Нарушение регуляции синаптической пластичности было связано с различными психическими и неврологическими [7], а также когнитивными нарушениями [8]. С другой стороны, индивидуальные свойства личности тесно связаны с определенными нейробиологическимим механизмами, включая синаптическую пластичность [9].
Одним из важных элементов, участвующих в синаптической пластичности, является контактин-ассоциированно-подобный белок-2 (contactin associated protein-like 2, Caspr2, кодируется геном CNTNAP2, 7q35), который взаимосвязан с калиевыми каналами и другими молекулами адгезии, способствует созданию функциональных субдоменов миелинизированных аксонов. Делеции в гетерозиготном состоянии в гене CNTNAP2 приводят к изменениям в регуляции генов, вовлеченных в нейрональное развитие и нейрональную активность [10]. Согласно анализу сигнальных путей, ассоциированных с формированием различных психологических и психиатрических фенотипов, ген CNTNAP2 участвует в регуляции поведения [11]. В частности, ген CNTNAP2 вовлечен в развитие расстройств аутистического спектра (РАС) [12, 13], которые, с одной стороны, характеризуются нарушениями социальной активности и лингвистических способностей, а, с другой стороны, характеризуются излишней тревожностью [14]. Таким образом, ген CNTNAP2 может рассматриваться в качестве кандидата при изучении не только дефицита социально-обусловленных свойств личности, но и свойств личности, характеризующих ее аффективную составляющую. Стратегия поиска взаимосвязи гена с вариацией признака основывается на выявлении ассоциации между полиморфными вариантами кандидатного гена и фенотипом. К настоящему времени наиболее изученными в гене CNTNAP2 являются полиморфные локусы rs7794745 и rs2710102, которые рассматриваются как функционально-значимые [15, 16]. В частности, с помощью метода функциональной магнитно-резонансной томографии (фМРТ) была показана активация префронтальных регионов мозга наблюдалась у индивидов-носителей «рискового» аллеля локуса rs2710102 в ответ на выполнение лингвистического задания [15]. Однако, опубликованные результаты противоречивы. Поскольку ген CNTNAP2 затрагивает более 2,5 Мб в регионе 7q35–36.1, имеет смысл рассмотреть вовлеченность других дистальных полиморфных локусов этого гена в вариацию уровня тревожности. В частности, несмотря на то, что интрон 3 гена CNTNAP2 не содержит известных функциональных элементов, делеции в этой области гена связывают с рядом психических признаков [17]. Кроме того, ранее полиморфный локус rs10251794, находящийся в интроне 3, был ассоциирован с некоторыми индивидуальными личностными свойствами на уровне полногеномного анализа ассоциаций [18]. С другой стороны, известно, что изменения в 3’-нетранслируемой области гена могут регулировать экспрессию гена вследствие изменения сродства связывания регуляторных микроРНК с таргетными участками гена-мишени. В связи с этим, в рамках данного исследования помимо функционального локуса rs2710102 были изучены однонуклеотидные полиморфные маркеры rs2530310 и rs10251794 в гене CNTNAP2, расположенные в 3’-нетранслируемой области и интроне 3, соответственно.
Цель исследования. Поскольку многочисленные молекулярно-генетические исследования указывают на вовлеченность гена CNTNAP2 в развитие некоторых психических расстройств, и, основываясь на «гипотезе универсальных генов», мы предположили, что варианты гена CNTNAP2 могут быть связаны с формированием тревожных состояний.
Целью настоящего исследования являлась оценка как основного эффекта полиморфных вариантов rs2530310, rs2710102 и rs10251794 гена CNTNAP2, так и гаплотипического эффекта в формировании индивидуальных вариаций в уровне ситуативной и личностной тревожности у психически здоровых индивидов 17-24 лет разной этнической принадлежности.
Материалы и методы исследования. В исследовании приняли участие 523 психически здоровых индивида (75,7% женщин) из Республики Башкортостан (средний возраст 20,99±3,32 лет) разной этнической принадлежности (русские – 119, татары – 143, башкиры – 94, индивиды смешанной этнической принадлежности – 167). Все индивиды являлись студентами ВУЗов без наследственной отягощенности по психическим заболеваниям. От всех участников было получено добровольное согласие на участие в данном исследовании.
Для оценки уровней ситуативной и личностной тревожности предлагался бланк самооценки Ч. Спилбергера, адаптированный Ханиным. Методика позволяет выявить индивидуальный уровень ситуативной и личностной тревожности. Шкалы ситуативной и личностной тревожности состоят из 20 вопросов. Определение показателей ситуативной и личностной тревожности производится с помощью ключа [19].
Молекулярно-генетические методы включали выделение ДНК из лимфоцитов периферической крови стандартным методом фенольно-хлороформной экстракции. Полиморфные локусы rs2530310, rs2710102 и rs10251794 в гене CNTNAP2 выявляли при помощи полимеразной цепной реакции (ПЦР) с использованием олигонуклеотидных праймеров (табл. 1). После начальной денатурации (94 °C, 4 мин) выполняли 33 цикла амплификации в следующем режиме: денатурация 94 °C – 30 сек.; отжиг праймеров 58 °C – 30 сек.; синтез ДНК 72 °C – 30 сек. Затем пробы выдерживали 7 мин при 72 °C и охлаждали. Для выявления аллелей изученных полиморфных локусов 10 мкл реакционной смеси обрабатывали 3 ед. акт. Соответствующей эндонуклеазы рестрикции (Сибэнзим, Россия) в течение 16 ч. В результате рестрикции и последующего разделения в 7%-ном полиакриламидном геле проводилась детекция аллелей (табл. 1).

Для оценки основного эффекта полиморфных локусов генов-кандидатов, эффекта гаплотипов, в вариации уровня тревожности был проведен линейный регрессионный анализ в программе PLINK v.1.09. В качестве независимых переменных в линейном регрессионном анализе выступали генотипы, а в качестве зависимой переменной – уровень ситуативной и личностной тревожности. Анализ был проведен как в общей выборке, так и отдельно среди женщин, мужчин, индивидов русской, татарской, башкирской этнической принадлежности. Кроме того, такие факторы как «пол» и «этнос» были включениы в модель линейной регрессии в качестве ковариат. Гаплотипические блоки были сконструированы на основе метода доверительных интервалов; оценка неравновесия по сцеплению между маркерами (на основании критерия Левонтина, D’) проведена с использованием программы Haploview 4.2. В качестве коррекции на множественность сравнений была проведена процедура FDR (False Discovery Rate) (PLINK v.1.09).
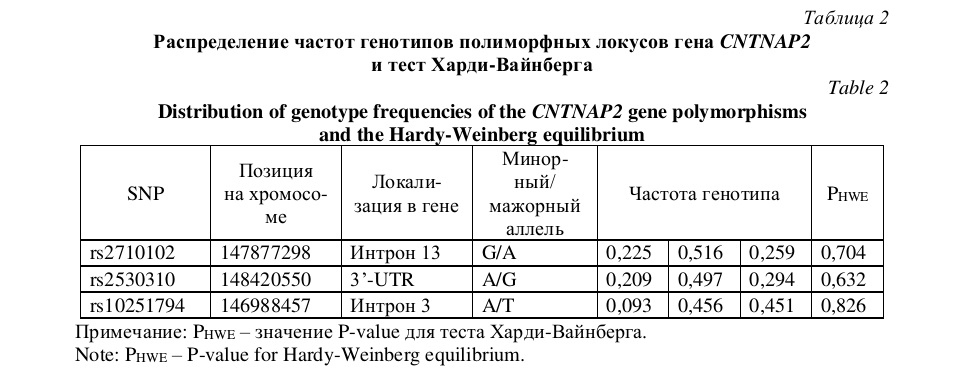
Результаты и их обсуждение. Результаты оценки распределения частот аллелей и генотипов полиморфных локусов rs2710102, rs2530310 и rs10251794 гена CNTNAP2 соответствовали распределению Харди-Вайнберга (Р = 0,704, Р = 0,632 и Р = 0,826, соответственно). Оценка распределения частот генотипов для всех локусов, а также позиции локусов на хромосоме показаны в таблице 2. Значения показателей по шкалам личностной и ситуативной тревожности в изученной выборке подчинялись закону нормального распределения (P > 0,05).
В результате линейного регрессионного анализа была выявлена ассоциация полиморфного локуса rs10251794 гена CNTNAP2 с вариациями в уровне ситуативной тревожности как в общей выборке (β = 1,97; P = 0,002; PFDR = 0,007), так и среди мужчин (β = 3,14; P = 0,011; PFDR = 0,032) и женщин (β = 1,64; P = 0,029; PFDR = 0,088) при анализе аддитивного эффекта минорного аллеля (A/A vs. A/T vs. T/T в локусе rs10251794) локуса. Однако у женщин ассоциация не достигла уровня статистической значимости после введения поправки на множественность сравнений. Причем, сила ассоциации увеличилась при рассмотрении доминантного эффекта минорного аллеля модели (A/A + A/T vs. T/T в локусе rs10251794) (табл. 3).
Таблица 3
Результаты линейного регрессионного анализа ассоциации полиморфных локусов rs2710102, rs2530310 и rs10251794 в гене CNTNAP2 с показателями ситуативной и личностной тревожности
Table 3
Linear regression association analysis of rs2710102, rs2530310, and rs10251794 in the CNTNAP2 gene and state and trait anxiety
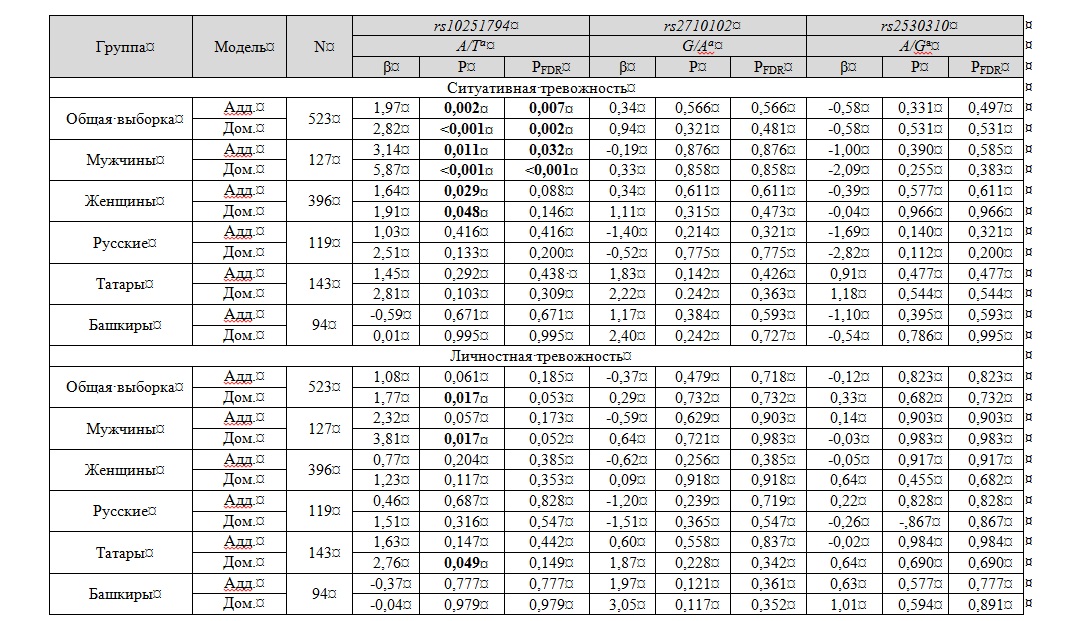
Примечание: N – число проанализированных индивидов. β –коэффициент регрессии, P – Р-value для теста Вальда (Wald test), МТ – математическая тревожность. Статистически значимые различия (до и после FDR-коррекции) выделены жирным шрифтом. aУказаны минорный / мажорный аллель. Указаны данные, полученные в аддитивной (Адд.) и доминантной (Дом.) модели наследования.
Note: N – sample size. β –regression coefficient; P – Р-value for Wald test; MA – mathematical anxiety. Statistically significant differences (prior and after FDR-correction are shown in bold. aMinor / major alleles are reported. Data revealed under additive (Add.) and dominant (Dom.) models of inheritance are demonstrated
В результате анализа было показано, что минорный аллель rs10251794*A был ассоциирован с повышенной ситуативной тревожностью в общей выборке (β = 2,82; P < 0,001; PFDR = 0,002) и среди мужчин (β = 5,87; P < 0,001; PFDR < 0,001) (рис. 1)
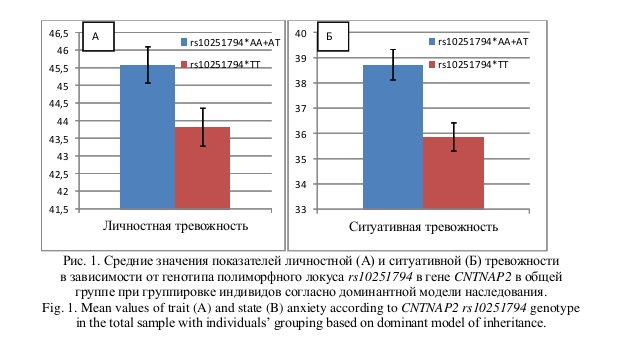
Дальнейшая статистическая обработка результатов продемонстрировала увеличение частоты аллеля rs10251794*А среди индивидов с более высокими значениями уровня личностной тревожности по сравнению с носителями генотипа rs10251794*Т/Т при рассмотрении доминантного эффекта минорного аллеля (A/A + A/T vs. T/T) наследования признака как в общей выборке (β = 1,77; P = 0,017; PFDR = 0,053), так и в группе мужчин (β = 3,81; P = 0,017; PFDR = 0,052) и индивидов татарской этнической принадлежности (β = 2,76; P = 0,049; PFDR = 0,149) (табл. 2, рис. 1). Однако, ассоциации не достигли уровня значимости после введения поправки на множественность сравнений (PFDR > 0,05).
Нами был проведен анализ неравновесия по сцеплению между локусами rs2710102, rs2530310 и rs10251794 в гене CNTNAP2, который не обнаружил неравновесия по сцеплению между ними (D’<0,1), что обусловлено большим расстоянием между локусами (более 540 кб). В связи с этим, гаплотипический анализ не проводился.
На следующем этапе был проведен линейный регрессионный анализ с включением половой и этнической принадлежности как ковариат в модели регрессии. В результате него был продемонстрирован значимый эффект взаимодействия генетической компоненты (вариантов локуса rs10251794) и половой принадлежности в доминантной модели (β = -3,95; P = 0,041; PFDR = 0,082), которая была элиминирована в ходе коррекции на множественность сравнений.
В ходе анализа не было обнаружено статистически значимых моделей ассоциации полиморфных локусов rs2530310 и rs2710102 гена CNTNAP2 и фенотипическими вариациями в уровне тревожности ни в одной из изученных групп.
Таким образом, в настоящем исследовании были выявлены ассоциации между полиморфными вариантами гена, отвечающего за регуляцию синаптической пластичности, и уровнем личностной и ситуативной тревожности. В частности, линейный регрессионный анализ свидетельствует об ассоциации минорного аллеля локуса rs10251794 гена CNTNAP2 с повышенной тревожностью. К настоящему времени существует всего одно опубликованное исследование, включающее полиморфный локус rs10251794 в гене CNTNAP2. В ходе данного полногеномного анализа ассоциаций (GWAS, genome-wide association study), основанного на анализе около 4000 индивидов из Италии и проанализировавшего более 350 тыс. однонуклеотидных полиморфных локусов (SNP), была продемонстрирована ассоциация полиморфного локуса rs10251794 в гене CNTNAP2 с другим свойством личности – «открытостью к познанию» [18]. Ранее нами была обнаружена взаимосвязь другого полиморфного варианта в гене CNTNAP2 (rs2530310) с вариациями в уровне определенного вида тревожности, который возникает при необходимости решения математических заданий (т.н. математической тревожности) [20].
Ген CNTNAP2 у человека и млекопитающих в основном экспрессируется в стриатуме, таламусе, миндалевидном комплексе, фронтальной коре [21] – отделах мозга, вовлеченных в регуляцию эмоциональной сферы и когнитивных функций [22]. С эволюционной точки зрения экспрессия гена CNTNAP2 у человека в 1,6 раз выше, чем у шимпанзе, что может указывать на участие контактин-ассоциированно подобного белка-2 в формировании высших нервных функций, включая речь и специфические поведенческие особенности [23]. Существуют данные, указывающие на взаимосвязь мутаций в гене CNTNAP2 с дефицитом ГАМК- и глутаматергического функционирования [24], которое также участвует в регуляции эмоциональных состояний.
Интересны результаты работ, исследовавших взаимосвязь активации регионов головного мозга в ответ на восприятие человеческого голоса, право/леворукости и вариантов гена CNTNAP2. В результате таких исследований была продемонстрирована значимая активация правой средней лобной и верхней височной извилины у индивидов с аллелем Т полиморфного локуса rs7794745 в ответ на обработку речевой информации вне зависимости от право/леворукости [16]. Примечательно, что на нейроанатомическом уровне большее количество серого вещества было отмечено в этих же отделах головного мозга у лиц с социальным тревожным расстройством [25], что позволяет предположить дифференцированную активацию регионов мозга, отвечающих за регуляцию эмоционального состояния, в зависимости от генетически детерминированного уровня активности контактин-ассоциированно подобного белка-2.
Поскольку ген CNTNAP2 затрагивает более 2,5 мб в регионе 7q35–36.1., в настоящей работе для исследования были выбраны однонуклеотидные полиморфные локусы, расположенные в разных регионах этого гена (rs2710102, rs2530310 и rs10251794). В связи с дистальным расположением изученных локусов неравновесия по сцеплению между ними обнаружено не было, что не позволило сконструировать возможные гаплотипы. Тем не менее, линейный регрессионный анализ позволил выявить ассоциацию аллеля rs10251794*A с повышенной ситуативной тревожностью в общей выборке. В то же время нам не удалось обнаружить вовлеченность полиморфных маркеров rs2710102 и rs2530310 в формирование изученных типов тревожности. С другой стороны, полиморфный вариант rs2710102*А в гене CNTNAP2 ранее был ассоциирован с селективным мутизмом у детей, представляющим собой излишнее избегание тревожных ситуаций и рассматриваемым в качестве предиктора социального тревожного расстройства в будущем [26]. Существуют данные о взаимосвязи аллелей локусов rs2710102*А и rs2710117*Т в гене CNTNAP2 с риском развития большого депрессивного эпизода в китайской популяции [27]. Однако, в ходе широкомасштабного исследования, включавшего мета-анализ опубликованных ранее данных GWAS, не было продемонстрировано взаимосвязи функциональных полиморфных вариантов гена CNTNAP2 (rs7794745 и rs2710102) ни с одним из 7 изученных психиатрических заболеваний (РАС, шизофренией, биполярным расстройством, синдромом дефицита внимания с гиперактивностью, нервной анорексией, обсессивно-компульсивным расстройством, основным депрессивным эпизодом). Тем не менее, анализ вариаций числа копийности в гене CNTNAP2 с помощью микрочипов продемонстрировал несовершенную сегрегацию делеции участка длиной 131 кб в интроне 1 гена, затрагивающую сайт связывания транскрипционного фактора FOXP2, индивидам с биполярным расстройством [28]. Исходя из полученных нами и опубликованных данных, можно предположить вовлеченность изменений в последовательности гена CNTNAP2, затрагивающих скорее интроны 1 и 3, чем дистальные участки гена, в формирование фенотипов, связанных с функционированием эмоциональной сферы.
Большое количество молекулярно-генетических работ сфокусировано на изучении функционирования гена CNTNAP2 при РАС. Поскольку функциональные исследования экспрессии гена CNTNAP2 в мозге человека невозможны, рядом ученых было выдвинуто предположение, что экспрессия генов в головном мозге человека коррелирует с их уровнем экспрессии в волосяных фолликулах, поскольку оба органа развиваются из эктодермы на ранних стадиях развития [12]. В ходе данного эксперимента было обнаружено снижение экспрессии гена CNTNAP2 в волосяных фолликулах у индивидов с РАС, по сравнению с контрольной группой [12]. В основном во всех работах были проанализированы локусы rs2710102 и rs7794745, показавшие ранее функциональную значимость. В частности, широкомасштабное исследование с использованием теста неравновесной трансмиссии выявило два локуса в интроне 14 (rs2710093, rs2253031) из более 2100 проанализированных SNPs, ассоциированные с РАС [13]. Другие авторы, наоборот, отметили отсутствие взаимосвязи между локусом rs2710102 и РАС как в экспериментальных статьях [29-31], так и в результате мета-анализа, включавшего данные Консорциума по психиатрической генетике (Psychiatric Genomics Consortium) [32]. С другой стороны, возможно, одиночные полиморфные локусы в гене CNTNAP2, не приводящие к существенному изменению структуры и функций кодируемого белка, ассоциированы с аффективной составляющей РАС, в то время как мутации и вариации числа копийности отдельных участков гена CNTNAP2 являются определяющими в формировании РАС. В частности, при изучении нуклеотидной последовательности 358 генов-кандидатов РАС были обнаружены изменения в последовательности ДНК в гене CNTNAP2 у здоровых индивидов без РАС, но с эпилепсией и тиками [33]. Кроме того, поскольку ген CNTNAP2 достаточно большой, в регуляции его экспрессии могут принимать участие и другие локусы (кроме rs2710102 и rs7794745), вовлеченность которых на данный момент была предсказана insilico, но не проверена invitro.
В настоящей работе была выявлена гендерная специфичность ассоциации полиморфного варианта rs10251794 в гене CNTNAP2 с ситуативной тревожностью. Причем, эффект локуса rs10251794 в формировании вариаций уровня тревожности обнаруживался в группе мужчин. Интересно, что ассоциации полиморфных вариантов в гене CNTNAP2 были выявлены с РАС [12, 13] – заболеванием, распространенность которого намного выше среди мужского населения. Одним из возможных объяснений выявленной в настоящей работе гендерной специфичности может являться регуляция Caspr2-зависимого поведения посредством половых гормонов [24, 34]. Причем, женские половые гормоны (окситоцин и фитоэстроген биоханин А) рассматриваются в качестве возможного терапевтического средства при лечении РАС в связи с восстановлением дефицита социального поведения у нокаутов по гену CNTNAP2 [24, 34]. В предыдущих исследованиях нами был продемонстрирован этно-специфичный характер ассоциации полиморфных вариантов генов SLC6A4 и HTR2A с крайними проявлениями излишней тревожности – клинически диагностированной униполярной депрессией [35]. Однако, в настоящей работе этнической специфичности, связанной с определенными частотами аллелей и генотипов изученных полиморфных маркеров в гене CNTNAP2, с уровнем тревожности обнаружено не было.
Стоит отметить, что некоторые средовые факторы могут модулировать ассоциацию генов с чертами тревожного ряда. В частности, важное значение в формировании тревожности играют факторы, воздействующие на индивида во время пренатального развития [36], которые, в свою очередь, могут изменять профиль метилирования конкретных генов. Так, при исследовании уровня метилирования более 5500 CpG островков по всему геному с использованием технологии микрочипов (Illumina HumanMethylation450K Beadchip) было выявлено дифференциальное метилирование нескольких генов, включая ген CNTNAP2, в пуповинной крови у новорожденных, чьи матери курили во время гестации, и не подвергавшихся такому воздействию [37]. Ранее нашей исследовательской группой была продемонстрирована значимость такого фактора как «сезон рождения» в выявление взаимосвязи между геном нейротрофического фактора головного мозга (BDNF) и уровнем тревожности (измеренным по шкале «избегание ущерба» с помощью опросника TCI-125) [6]. Полученный эффект может быть обусловлен дефицитом необходимых микронутриентов в питании беременной женщины (фолиевой кислоты, витамина В12, ω-3 жирных кислот) в зависимости от месяцев гестации. В свою очередь, этот дефицит приводит к увеличению концентрации гомоцистеина и окислительному стрессу, снижению уровня нейротрофинов, нейротрофического фактора головного мозга, в частности [38]. Эти изменения, в свою очередь, обуславливают модулирование эпигенетической регуляции посредством метилирования ДНК, гистонов, приводя к усилению продукции провоспалительных эйкозаноидов и дефициту противовоспалительных цитокинов и биоактивных липидов [39]. Последние, в свою очередь, приводят к так называемому ингибированию поведения [40]. Стоит отметить, что ген СNTNAP2, наряду с психиатрическими фенотипами, был ассоциирован с уровнем циркулирующих липидов в зависимости от уровня физической активности при исследовании более 250 тысяч индивидов из различных мировых популяция [41], что указывает на существенную значимость физической активности в каскаде процессов эпигенетической регуляции гена CNTNAP2.
Заключение. Несмотря на большое количество публикаций в отношении взаимосвязи как одиночных полиморфных локусов, так и изменений нуклеотидной последовательности в гене CNTNAP2 с манифестацией РАС и аффективных патологий, в настоящей работе была выявлена ассоциация полиморфных вариантов этого гена с индивидуальными различиями в эмоциональной составляющей индивидуального психологического паттерна. Несмотря на ряд преимуществ данной работы (учет половой и этнической принадлежности при проведении статистического анализа, введение поправки на множественность сравнений), необходимо проведение репликативного исследования на большей выборке. Кроме того, функциональная значимость двух из изученных локусов была не проанализирована invitro, что не позволило сделать вывод о взаимосвязи индивидуального уровня тревожности с экспрессией и активностью гена CNTNAP2. Необходимо отметить отсутствие возможности исследования влияния ряда стресс-ассоциированных средовых факторов, действующих на индивида во время онтогенеза (и в период пренатального развития, в особенности), которые, в свою очередь, могут приводить к изменениям профиля метилирования гена CNTNAP2, модулируя таким образом формирование индивидуального уровня тревожности. Дальнейшие исследования в данной области с учетом высказанных предложений представляются необходимыми.
В отношении данной статьи не было зарегистрировано конфликта интересов.
Благодарности
Работа выполнена в рамках государственного задания Минобрнауки РФ (№АААА-А16-116020350032-1) при частичной поддержке РФФИ (проект № 17-29-02195). Образцы ДНК для исследования взяты из ЦКП "Коллекция биологических материалов человека" ИБГ УФИЦ РАН, поддержанного Программой биоресурсных коллекций ФАНО России (соглашением № 007-030164/2).




















Список литературы