Фармакологические эффекты комбинированного введения низкой дозы ацетилсалициловой кислоты и метилдопы при ADMA-подобной преэклампсии
Aннотация
Актуальность: Одной из ведущих причин, приводящих к серьёзным осложнениям, длительной инвалидности и летальному исходу у матерей и младенцев, являются гипертензивные нарушения, а в частности преэклампсия, на долю которой приходится от 2 до 8 % от общего количества беременностей в мире. В структуре перинатальной смертности гипертензивные расстройства во время беременности составляют до 25% от общего количества случаев, а также занимают главенствующие места в структуре причин материнской смертности. Цель исследования: Изучить эффективность низкой дозы ацетилсалициловой кислоты и её комбинации с метилдопой на функциональные параметры, а также на росто-весовые показатели плодов крыс с ADMA – подобной преэклампсией. Материалы и методы: Исследование выполнено на 100 самках крыс линии Wistar, массой 250-300 гр. В эксперименте воспроизводили ADMA-подобную модель преэклампсии. Для оценки возникающих морфофункциональных нарушений использовали следующие параметры: артериальное давление, коэффициент эндотелиальной дисфункции, микроциркуляцию в плаценте, протеинурию, содержание жидкости в большом сальнике, концентрацию конечных метаболитов в плазме крови, морфометрические показатели плодов. Результаты: При оценке морфофункциональных нарушений у животных с ADMA-подобной преэклампсией, в ходе проведенного исследования установлено положительное влияние низкой дозы ацетилсалициловой кислоты в комбинации с метилдопой. Заключение: Комбинированное введение малой дозы ацетилсалициловой кислоты и метилдопы оказывает выраженную протективную активность при коррекции морфофункциональных нарушений у животных с ADMA-подобной преэклампсией и является перспективным направлением в лечении гипертензивных нарушений во время беременности.
Ключевые слова: ацетилсалициловая кислота, метилдопа, микроциркуляция, ишемические нарушения в плаценте
Введение. Гипертензивные расстройства во время беременности до сих пор остаются одной из наиболее частых причин материнской и перинатальной смертности по всему миру. По примерным оценкам, от 2 до 8% беременностей по всему миру осложняются преэклампсией [1, 2, 3]. В структуре перинатальной смертности гипертензивные расстройства во время беременности составляют до 25% от общего количества случаев, а также занимают главенствующие места в структуре причин материнской смертности [1]. В последние годы возрастает количество исследований, указывающих на то, что основную роль в развитии преэклампсии играет нарушение функционального состояния эндотелия сосудов, что влечет за собой развитие генерализованного спазма, повышение цифр артериального давления и, как следствие ишемические нарушения в органах [4]. Эндотелий является мощным эндокринным органом, участвующим в регуляции тонуса сосудов и поддержании их нормального строения, контроле реологических свойств крови и процессов местного воспаления. В норме антикоагулянтная и антитромботическая активность эндотелия преобладают над прокоагулянтными свойствами, однако в условиях повреждения данный баланс смещается в сторону прокоагуляции [5]. В настоящее время возрастает количество данных, свидетельствующих о том, что изменения ангиогенных факторов и коагулопатии ответственны за клинические проявления данного состояния. Преэклампсия является системным заболеванием, которое характеризуется интенсивным воспалительным ответом, эндотелиальным поражением, агрегацией тромбоцитов, активацией системы свертывания и повышенным генерализованным сосудистым спазмом [6]. Генерализованный спазм сосудов, вызванный активацией эндотелия, приводит к коварному и прогрессирующему процессу, ведущему к полиорганной недостаточности. Система коагуляции активируется путем контакта тромбоцитов с поврежденным эндотелием, что приводит к увеличению расходования, а также к образованию тромбоцитов в костном мозге [7]. Молодые тромбоциты, выброшенные в кровоток, имеют более высокую склонность к агрегации. Контакт тромбоцитов с поврежденным эндотелием может представлять собой начальную стадию коагуляционного каскада, которая приводит к увеличению потребления тромбоцитов в маточно-плацентарном русле с последующим уменьшением количества циркулирующих тромбоцитов на первой фазе процесса. Впоследствии может наблюдаться компенсаторное увеличение производства тромбоцитов костным мозгом [8]. В литературе есть данные, которые указывают на то, что при гипертонии у беременных время выработки тромбоцитов значительно сокращается по сравнению с нормально протекающей беременностью [8, 9]. Cпазм сосудов облегчает адгезию тромбоцитов, обычно, при повреждении сосуда субстратом для адгезии активированных тромбоцитов является субэндотелиальная поверхность, а именно коллаген, в котором и происходит необратимая агрегация тромбоцитов. При этом активированные тромбоциты используются локально и практически не поступают в системный кровоток [9]. При развитии преэклампсии этот процесс происходит в других условиях и приобретает генерализованный характер. Процесс взаимодействия тромбоцитов и эндотелиоцитов в патогенезе развития преэклампсии еще требует дальнейшего изучения, но объединение таковых в отдельное звено уже в рамках гемостаза подчеркивает их тесную связь. Механизм запуска сосудисто-тромбоцитарного звена гемостаза при повреждении сосуда заключается в многостадийной активации тромбоцитов при взаимодействии с субэндотелиальными клетками [10].
Использование низких доз аспирина рекомендуется женщинам, имеющим факторы риска развития преэклампсии, для снижения заболеваемости и смертности, связанных с данным осложнением [11-14]. Благоприятное влияние аспирина на течение преэклампсии, объясняется влиянием ацетилсалициловой кислоты на активность тромбоцитов. Ингибируя синтез тромбоксана A2, аспирин уменьшает активацию тромбоцитов [15].
Понимание фармакокинетических и фармакодинамических особенностей данного препарата позволяет использовать низкие дозы АСК в профилактических целях, как средство, обладающее антитромботическим эффектом [13].
Профилактический эффект от приема низких доз ацетилсалициловой кислоты у беременных с нарушениями в тромбоцитарном звене гемостаза связан с тем, что ацетилсалициловая кислота повышает уровень простациклинов снижая при этом уровень тромбоксана – протромботического фактора тромбоцитов в следствие чего нормализуются функциональные свойства тромбоцитов, а также функциональное состояние эндотелия сосудов. При преэклампсии дисфугкция эндотелия, а также нарушения в системе гемостаза формируются еще на доклинической стадии течения данного осложнения. Основными провоцирующими звеньями иммуновоспалительного каскада выступают тромбоциты и эндотелиальные клетки, которые провоцируют воспалительную реакцию и гемокоагуляцию на микроциркуляторном уровне. С точки зрения механизмов формирования преэклампсии и плацентарной недостаточности патогенетически обоснованным можно считать прием низких доз АСК у беременных высокого риска с профилактической целью [16, 17, 18].
Первичная профилактика преэклампсии является предметом споров и активных научных исследований, в рамках которых особое внимание уделяется применению противовоспалительных препаратов и питательных микроэлементов, в том числе кальция, витамина D и витаминов-антиоксидантов C и E. Единственным безусловно эффективным методом лечения преэклампсии является прерывание беременности / рождение плода и последа, хотя у некоторых женщин с преэклампсией может наблюдаться временное ухудшение в послеродовом периоде. Оказание помощи женщинам с преэклампсией имеет целью минимизацию дальнейших осложнений, связанных с беременностью, предотвращение необоснованного преждевременного родоразрешения и повышение числа благоприятных исходов у матерей и младенцев [19]. Современные методы лечения и профилактики преэклампсии направлены в первую очередь на коррекцию, непосредственно, доминирующего синдрома и с недостаточным уровнем учета патогенетической составляющей. Вместе с тем нужно отметить, что в современной литературе имеются сведения об экспериментальных работах, посвященных различным подходам коррекции, моделируемой преэклампсии. В качестве патотофизиологически обоснованных подходов в них используются способы направленные на: коррекцию ишемии плаценты с использованием препаратов улучшающих глубину плацентации и кровоток в спиральных артериях матки, а так же использование дистанционного ишемического прекондиционирования и фармакологического прекондиционирования, как активаторов процессов естественной цитопротекции, улучшение нарушенной функции эндотелия и восстановление активности eNOS, коррекция системы гемостаза, устранение проявлений «Оксидативного стресса», коррекция баланса цитокинов и других гуморальных факторов.
Цель исследования. Изучить эффективность низкой дозы ацетилсалициловой кислоты и её комбинации с метилдопой на функциональные параметры, а также на росто-весовые показатели плодов крыс с ADMA – подобной преэклампсией.
Материалы и методы исследования. Исследование выполнено на 100 самках крыс линии Wistar, массой 250-300 гр. В эксперименте воспроизводили ADMA-подобную модель преэклампсии путем введения неселективного блокатора NOS N-нитро-L-аргинин-метилового эфира (L-NAME) 25 мг/кг/сут внутрибрюшинно с 14-х по 20-е сутки беременности.
Группы беременных животных были получены путем подсаживания к самкам (3 животных) самцов (2 животных) на сутки, затем животных рассаживали. Факт наличия беременности устанавливали на 10-14 сутки путем пальпации передней брюшной стенки в условиях медикаментозного сна. Затем беременные крысы были рандомизированы на 5 групп: 1 группа контрольная – интактные (животные с физиологически протекающей беременностью), 2 группа контрольная – животные с ADMA-подобной преэклампсией, которым вводили неселективный блокатор NOS N-нитро-L-аргинин-метилового эфира (L-NAME) (25 мг/кг/сут) внутрибрюшинно с 14-х по 20-е сутки беременности), 3 группа – L-NAME + метилдопа, который вводили в дозе 0,043 г/кг 2 раза в сутки перорально с 14-х по 20-е сутки беременности, 4 группа L-NAME + ацетилсалициловая кислота в дозе 10 мг/кг/сут перорально с 14-х по 20-е сутки беременности; 5 группа – L-NAME + ацетилсалициловая кислота в дозе 10 мг/кг/сут + метилдопа в дозе 0,043 г/кг/сут х 2 р/сут с 14-х по 20-е сутки беременности путь введения – перорально. На 21 сутки гестации экспериментальное животное наркотизировали путем внутрибрюшинной инъекции хлоралгидрата в дозе 300 мг/кг массы тела, после чего проводились функциональные тесты.
Результаты и их обсуждение. При введении низкой дозы ацетилсалициловой кислоты животным с ADMA-подобной преэклампсией было выявлено статистически значимое (р<0,05) снижение уровня артериального давления по отношению к группе «нелеченых» животных, однако, при введении комбинации низкой дозы ацетилсалициловой кислоты и метилдопы данный показатель практически достигал уровня животных с физиологически протекающей беременностью (табл. 1).

При оценке результатов показателей функционального состояния эндотелия сосудов было выявлено статистически значимое (р<0,05) улучшение показателей коэффициента эндотелиальной дисфункции животных с ADMA-подобной преэклампсией, которым вводились низкие дозы ацетилсалициловой кислоты по отношению к группе «нелеченых» животных. При введениии метилдопы в качестве монотерапии значимого протективного эффекта на состояние эндотелия не выявлено. При введении комбинации низкой дозы ацетилсалициловой кислоты и метилдопы коэффициент эндотелиальной дисфункции практически достигал уровня интактных животных (табл. 1).
При оценке уровня концентрации конечных метаболитов оксида азота в плазме у крыс с ADMA – подобной преэклампсией было выявлено статистически значимое (р<0,05) по отношению к группе «нелеченых» животных увеличение показателей у групп животных с ADMA-подобной преэклампсией, которым вводились низкие дозы ацетилсалициловой кислоты в комбинации с метилдопой, в то время как при использовании исследуемых фармакологических агентов в качестве монотерапии данный показатель был менее выражен (табл. 2).
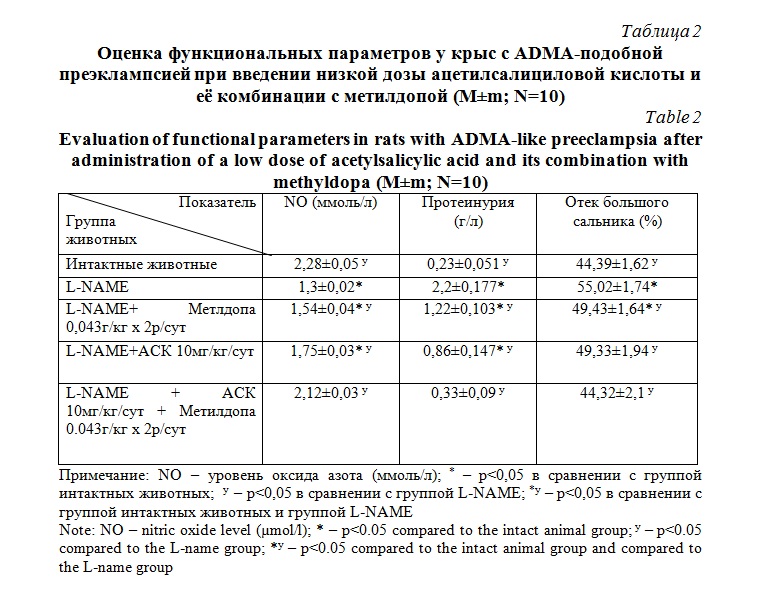
Введение низкой дозы ацетилсалициловой кислоты, как и метилдопы животным с экспериментальной преэклампсией оказывало статистически значимое (р<0,05) снижение концентрации белка в моче у экспериментальных животных, однако комбинированное введение исследуемых фармакологических агентов снижало протеинурию практически до уровня животных с физиологически протекающей беременностью (табл. 2).
Исследование содержания жидкости в тканях большого сальника у животных с экспериментальной преэклампсией выявлено статистически значимое (р<0,05) снижение данного показателя при сочетанном введении низкой дозы ацетилсалициловой кислоты и метилдопы в сравнении с группой «нелеченных» животных и достижением его уровня интактных животных (табл. 2).
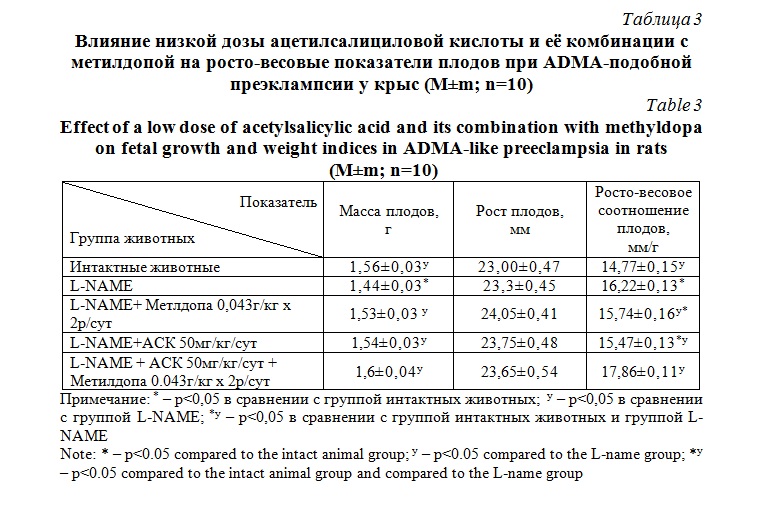
Исследование результатов коррекции росто-весовых показателей у плодов при экспериментальной преэклампсии показало повышение массы тела плодов в группе с сочетанным введением ацетилсалициловой кислоты и метилдопы (табл. 3). При этом нужно отметить, что соотношение роста и массы плода приближалось к уровню статистически не отличимого от уровня интактных животных.
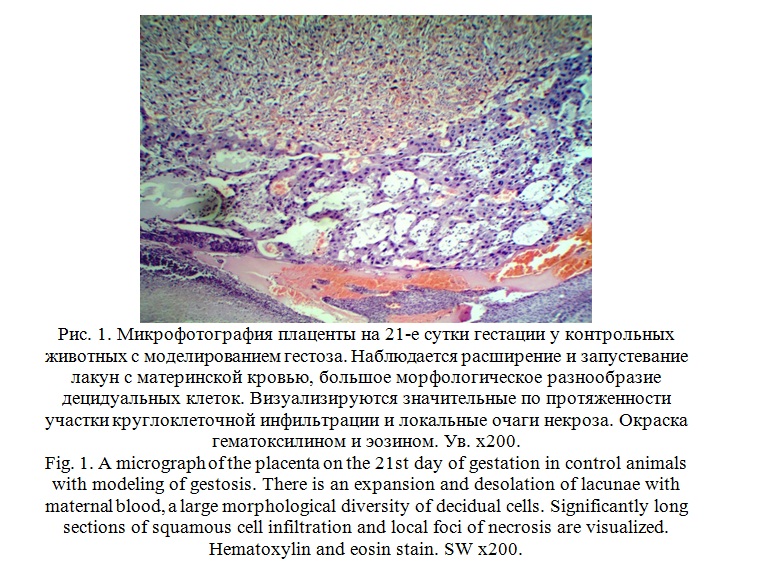
Изучение микропрепаратов плаценты в группе контрольных животных с моделированием гестоза были выявлены хорошо выраженные признаки деструктивно-дистрофических изменений плаценты.
При микроскопическом изучении материнской части или базальной зоны плаценты было выявлено снижение плотности клеток трофобласта, расширение и запустевание лакун с материнской кровью, большое морфологическое разнообразие децидуальных клеток. На границе базальной зоны и децидуальной оболочки визуализируются значительные по протяженности участки круглоклеточной инфильтрации и локальные очаги некроза, а также, расширенные, кровенаполненные с явлениями тромбоза и отложением фибриновых нитей кровеносные сосуды. Очаги кровоизлияний в окружающие ткани плаценты. В поле зрения определяются оптически пустые децидуальные клетки на фоне клеток с абсолютно сохранными структурами. Следует отметить, что толщина губчатой части плаценты, по отношению к лабиринтному отделу несколько увеличена (рис. 1).
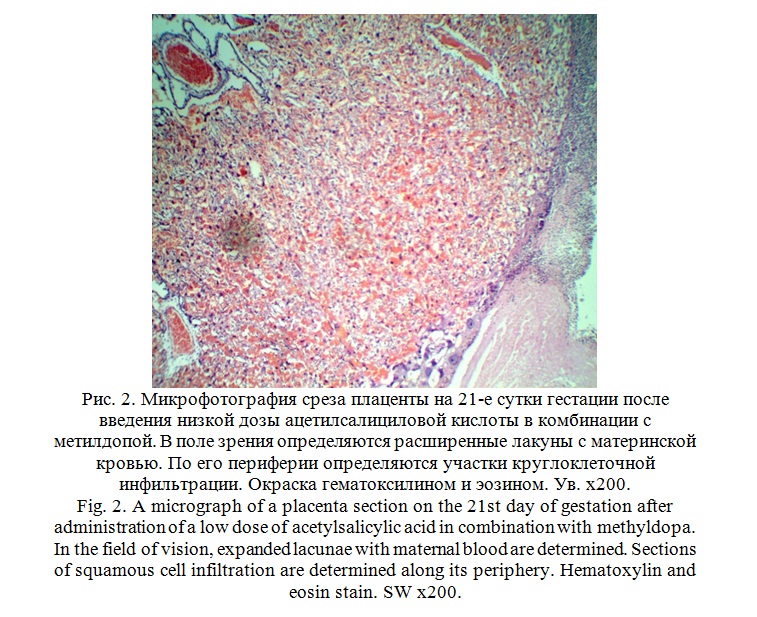
Фармакологическая коррекция выявленных морфологических изменений структур плаценты на 21-е стуки гестации низкой дозой ацетилсалициловой кислоты в комбинации с метилдопой имела положительную динамику. На микропрепаратах хорошо визуализируются плодовая и материнская части плаценты. Со стороны материнской части определяется децидуальная оболочка, состоящая из светлых удлиненных клеток. Основную площадь материнской части плаценты составляет трофоспонгиум, представленный базофильными отростчатыми клетками и гликогенными островками. Плотность децидуальных клеток несколько снижена. В поле зрения определяются расширенные лакуны с материнской кровью. По его периферии определяются участки круглоклеточной инфильтрации, очагов некроза нет (рис. 2).
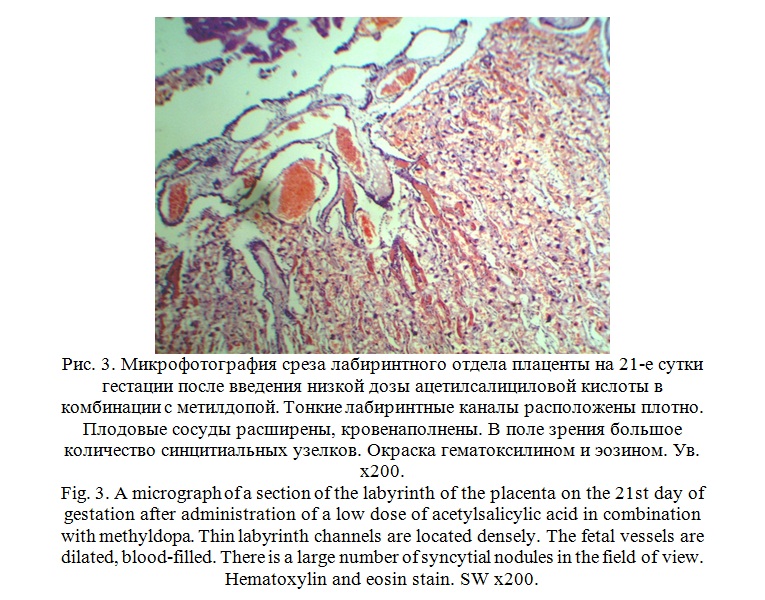
При изучении лабиринтного отдела плаценты отмечено, что основная площадь среза приходится на ворсинки с плодовыми капиллярами и межворсинчатое пространство с материнской кровью. На поверхности плодной части плаценты хорошо визуализируется сросшийся с хориальной пластинкой амниотический эпителий. В эмбриональной соединительной ткани ворсин отека стромы нет. Стажа эритроцитов и тромбоза в материнских лакунах а так же, уменьшения их числа и числа плодовых капилляров не выявлено. Тонкие лабиринтные каналы расположены плотно. Плодовые сосуды расширены, кровенаполнены, заполняют практически всю строму ворсины, снижая, таким образом, толщину гематоплацентарного барьера. Плотность ворсин на единицу площади среза высокая. Все ворсины окружены слоем трофобластического эпителия, который в большинстве участков представлен только слоем симпластотрофобласта. В поле зрения выявлено значительное количество синцитиальных узелков, свидетельствующих о достаточной степени зрелости плаценты (рис. 3).
Подводя итог всему вышеописанному, можно утверждать, что результаты проведенных серий экспериментов свидетельствуют о выраженной протективной активности низкой дозы ацетилсалициловой кислоты в комбинации с метилдопой при коррекции морфофункциональных нарушений у животных с ADMA-подобной преэклампсией.
Заключение. Выбранная нами модель преэклампсии несмотря на то, что вызывается вазоактивным ADMA-подобным веществом, имеет и ишемический компонент. При проведении данного исследования ишемия плаценты была выбрана в качестве мишени для поиска новых лекарственных препаратов с целью профилактики и лечения преэклампсии, так как нарушение кровообращения мелких артериальных сосудов приводит к нарушению регуляции артериального давления и микроциркуляции в тканях, что ведет к нарушению функции органов и систем, а в некоторых случаях и к полиорганной недостаточности. На сегодняшний день доказан тот факт, что низкие дозы ацетилсалициловой кислоты способствуют улучшению глубины плацентации, микроциркуляции в плаценте и усиления кровотока в спиральных маточных артериях. Таким образом, механизмы положительных эффектов ацетилсалициловой кислоты включают улучшение микроциркуляции в тканях, снижение тромботических явлений и оптимизацию неоваскулогенеза в плаценте. Это приводит к уменьшению ишемических явлений в плаценте и восстановлению функции эндотелия, которые играют важную роль в современном представлении о патогенетических механизмах развития преэклампсии. Современные знания о патогенезе преэклампсии и накопленный экспериментальный опыт, обосновывают обозримые перспективы для создания лекарственных препаратов для лечения и профилактики гипертензивных расстройств во время беременности.
В отношении данной статьи не было зарегистрировано конфликта интересов.




















Список литературы