Оксид азота в выдыхаемом воздухе как предиктор эффективности базисной терапии бронхиальной астмы у детей
Aннотация
Актуальность: Оксид азота в выдыхаемом воздухе на сегодняшний день является одним из обсуждаемых маркеров аллергического воспаления респираторного тракта, оценку которого предлагается использовать как в качестве критерия диагностики астмы, так и эффективности проводимой базисной терапии. В статье рассмотрена предиктивная способность мониторинга оксида азота в выдыхаемом воздухе относительно уровня контроля и вероятности развития обострений бронхиальной астмы (БА) у детей на фоне базисной терапии. Цель исследования: Оценить предсказательную способность ежемесячного мониторинга оксида азота в выдыхаемом воздухе относительно достижения контроля и возможного развития обострений у детей с неконтролируемой БА на фоне усиления базисной терапии. Материалы и методы: В исследовании проводилась ежемесячная оценка уровня NO в выдыхаемом воздухе портативным анализатором оксида азота NObreath, (Bedfont.Scientific.Ltd., Великобритания) у 111 детей (средний возраст 13,8±2,1 лет) с БА. Все пациенты находились на базисной терапии и на момент включения в исследование были переведены на 3 ступень (GINA, 2018) терапии БА. Для ежемесячной регистрации уровня контроля БА использовался опросник ACQ-5. В зависимости от исходного уровня FeNO были выделены 2 подгруппы пациентов: 1 подгруппа (n=50), FeNO=36-49 ppb; 2 подгруппа (n=61), FeNO≥50 ppb. Полученные данные были обработаны с помощью ROC-анализа внутри каждой подгруппы и в общей когорте пациентов. Результаты: Исходный уровень FeNO не обладает прогностической способностью для оценки контроля БА через 3 месяца терапии и развития обострений БА в течение этого времени. Мониторинг уровня оксида азота через 1 месяц позволяет прогнозировать развитие обострения БА, а через 2 месяца –как развитие обострения БА, так и достижение контроля БА к 3 месяцу наблюдения. Предиктивная способность мониторинга FeNO была достоверной в подгруппе 2. Заключение: Мониторинг FeNO может использоваться для принятия решений об изменении базисной терапии астмы у отдельных групп пациентов. Необходимы дальнейшие длительные исследования для оценки прогностической ценности динамического контроля FeNO у детей с бронхиальной астмой.
Введение. Достижение контролируемого течения бронхиальной астмы в реальной клинической практике составляет примерно 50%. Одним из возможных путей повышения эффективности базисной терапии бронхиальной астмы является разработка маркерориентированных алгоритмов её коррекции. Оксид азота является сигнальной молекулой, продуцируемой клетками респираторного эпителия [1], обнаруживается при выдохе и обладает свойством расширять сосуды и бронхи [2]. NO синтезируется из L-аргинина индуцибельными ферментами NO-синтазы в ответ на воспалительные цитокины и присутствует в выдыхаемом воздухе [3]. Значение FeNO в качестве маркера воспаления дыхательных путей и возможности его использования в качестве критерия оценки эффективности при астме у детей рассматривалось в предшествующих исследованиях [4-7]. Однако, результаты этих исследований были неоднозначными.
За счет неинвазивности метода FeNO может количественно отображать степень воспаления дыхательных путей при лечении детей с астмой [8]. В то же время анамнез болезни со слов родителей и спирометрия могут оказаться недостаточными для диагностики и лечения у таких пациентов [9]. Ряд зарубежных исследований показал, что спирометрия и, в частности, показатель ОФВ1 у детей с симптомами неконтролируемого течения БА и астмой различной тяжести часто может быть в пределах нормы [10, 11]. Оценка эозинофилов в периферической крови также не может быть использована в качестве однозначного критерия для лечения и диагностики БА [12]. Определение специфичных генетических профилей для предсказывания реакции на лечение астмы не показало высокой эффективности в последних исследованиях у детей [13]. Клинические данные свидетельствуют о том, что показатель оксида азота (FeNO) в выдыхаемом воздухе можно использовать для определения воспаления дыхательных путей с высокой специфичностью и чувствительностью [14, 15, 16]. Динамический мониторинг оксида азота может быть более информативным для диагностики и прогноза бронхиальной астмы [17, 18]. Некоторые исследования отмечают снижение уровня оксида азота на фоне противовоспалительной терапии глюкокортикостероидами в течение 1 недели [19, 20].
Цель исследования. Целью исследования являлась оценка предиктивной способности FeNO-мониторинга относительно достижения контроля и риска развития обострений у детей с неконтролируемой бронхиальной астмой на фоне изменения базисной терапии.
Материалы и методы исследования. В исследование было включено 111 детей обоего пола (м=83; ж=28) в возрасте 13,8±2,1 лет с верифицированным диагнозом «Бронхиальная астма, атопическая форма, неконтролируемое течение (ACQ5>1,5)». Все пациенты исходно в течение минимум 3 месяцев до момента включения в исследование получали базисную терапию второй ступени и были переведены на ступень 3 («step up») в соответствии с GINA-2018. Всем пациентам проводился ежемесячный мониторинг уровеня оксида азота в выдыхаемом воздухе с помощью портативного анализатора оксида азота NObreath, (Bedfont.Scientific.Ltd., Великобритания). Проведение исследования было одобрено локальным этическим комитетом. Родители всех участников исследования подписали форму информированного согласия. Критерием включения в исследование был исходный уровень FeNO³36 ppb. В течение 12 недель производилась регистрация обострений и ежемесячная оценка уровня контроля в соответствии с опросником ACQ-5. Результаты обрабатывались с применением программного продукта Microsoft Excel 2010, ранжировались по группам в зависимости от исходного уровня FeNO.
Статистическую обработку всех результатов исследования проводили с помощью пакета программ SPSS 17.0 и BIOSTAT. Для всех данных была применена описательная статистика: данные проверены на нормальность распределения. Тип распределения определялся критерием Шапиро-Уилка. Для параметров с нормальным распределением рассчитывали средние величины и стандартные отклонения M(SD); для распределений, отличающихся от нормального – медиану и интерквартильный размах Me [IQR]; для качественных величин – частота встречаемости (%).
На основании полученных данных был проведен ROC-анализ (Receiver Operator Characteristic) с использованием программного продукта MedCalc (версия 11.5.0.0) как для общей когорты пациентов (n=111), так и в подгруппах, стратифицированных по исходному уровню FeNO: 1 подгруппа (n=50), FeNO = 36-49 ppb; 2 подгруппа (n=61), FeNO≥50 ppb. Были определены оптимальные временные точки мониторинга FeNO для коррекции базисной терапии БА с целью достижения контролируемого течения заболевания и снижения риска развития обострений; а также определены предиктивные уровни FeNO, ассоциированные с разной степенью контроля и вероятностью развития обострения БА.
Результаты и их обсуждение. Уровень FeNO в обшей когорте пациентов составил: 51[54,75; 65] ppb – исходно; 32[12; 39,5] ppb – через 1 месяц; 29[13,75; 45] ppb – через 2 месяца; 21[12,75; 32,75] ppb – через 3 месяца. Динамика уровня FeNO в подгруппах представлена в таблице 1.
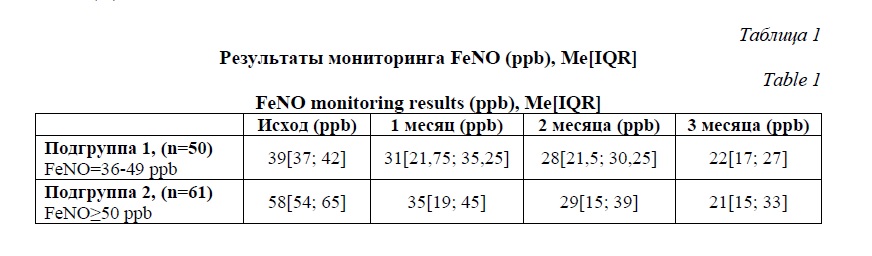
К 3 месяцу наблюдения 58,6% (65/111) пациентов достигли контролируемого течения астмы (ACQ5<0,75). Изменения уровня контроля БА у пациентов в обшей когорте и в подгруппах в ходе исследования представлены в таблице 2.
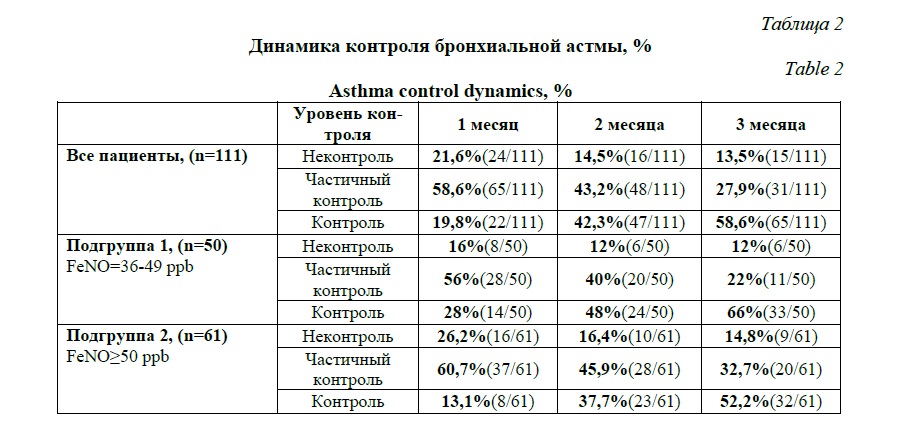
За 3 месяца наблюдения было зарегистрированы 24 обострения БА у 20,7% (23/111) пациентов общей группы наблюдения. В подгруппе 1 было выявлено 9 обострений БА у 18% (9/50), в подгруппе 2 – 15 обострений БА у 22,9% (14/61).
В ходе проведенного ROC анализа было установлено, что исходный уровень FeNO не имел прогностической способности ни в отношении достижения контроля БА, ни в отношении развития обострений в течение 3-х месяцев наблюдения как в общей когорте, так и в подгруппах.
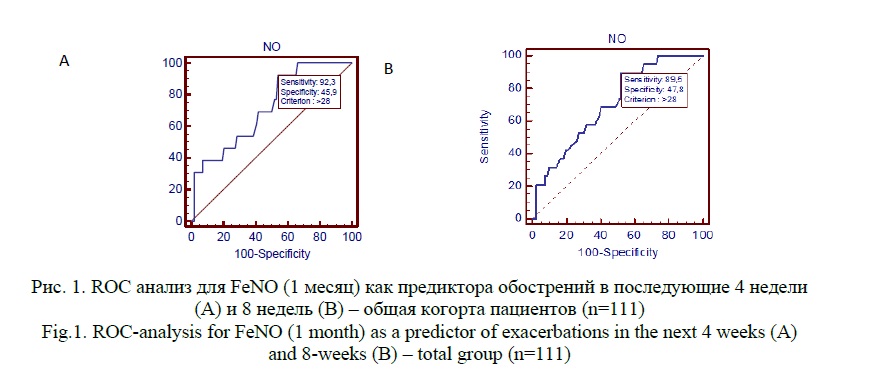
Определение показателя FeNO через 1 месяц пересмотренной базисной терапии БА также не позволило прогнозировать достижение контроля к 3 месяцу наблюдения как в общей группе пациентов, так и в обеих подгруппах. Однако, мониторинг FeNO в этой временной точке достоверно прогнозировал развитие обострений как в последующие 4 недели (AUC=0,717, p=0,0025), так и в последующие 8 недель (AUC=0,704, p=0,0008) у пациентов обшей когорты с уровнем FeNO>28 ppb (рисунок 1).
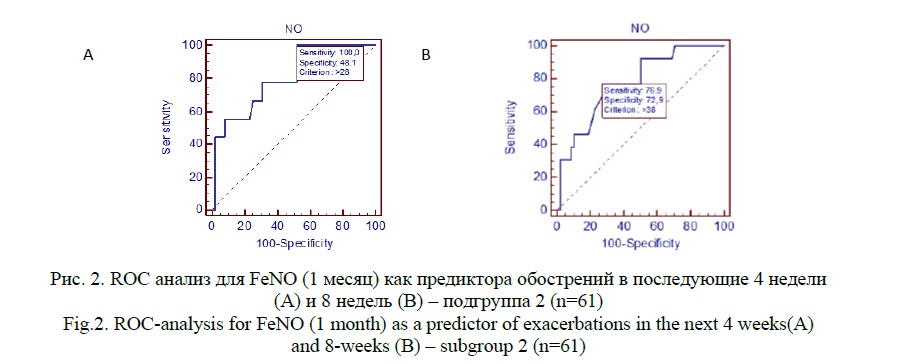
При этом анализ проведенный в подгруппах в этой же временной точке выявил статистически значимые результаты только для подгруппы 2 относительно риска обострений как в последующие 4 недели (>28 ppb, AUC=0,807, p=0,0001), так и в последующие 8 недель (>38 ppb, AUC=0,776, p=0,0001) (рисунок 2).
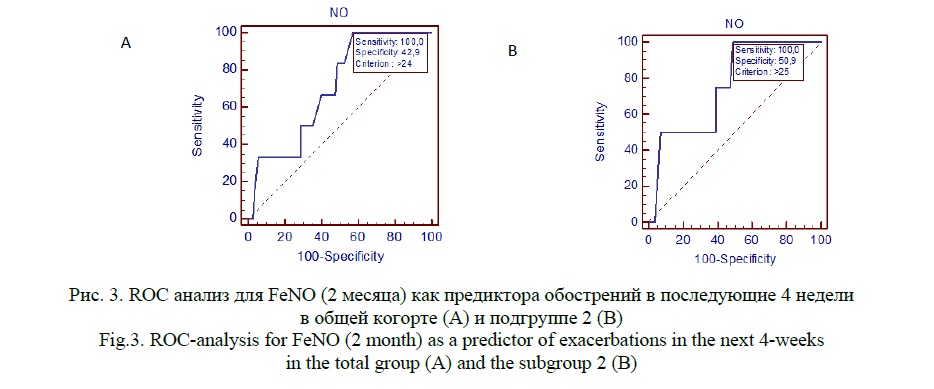
Через 2 месяца значение FeNO больше 24 ppb в общей группе пациентов (AUC=0,72, p=0,048) и больше 25 ppb во 2 подгруппе пациентов (AUC=0,757, p=0,03) было предиктором развития обострения БА в последующие 4 недели. Для подгруппы 1 статистически значимые зависимости установлены не были.
Кроме того, значение FeNO больше 28 ppb в общей группе пациентов через 2 месяца терапии было предиктором отсутствия контроля БА после 3 месяцев наблюдения (>28 ppb, AUC=0,706, p=0,0001). При субанализе аналогичная закономерность была установлена только для пациентов 2-ой подгруппы (>25 ppb, AUC=0,735, p=0,0003).
Результаты проведенного исследования продемонстрировали наличие предиктивной способности мониторинга FeNO относительно риска развития обострений и достижения контроля БА у детей при изменении базисной терапии со 2-ой на 3-ю ступень по GINA. Тенденция к снижению уровня оксида азота в выдыхаемом воздухе от исходных цифр к показателям, достигнутым на 3 месяце базисной терапии, свидетельствует об уменьшении гиперреактивности дыхательных путей, что позволило достичь контроля у более 50% детей в общей когорте к третьему месяцу исследования. В недавнем исследовании Petsky с соавт. показали снижение обострений на 42% при использовании мониторинга FeNO у детей с астмой [26]. Это обусловлено установленной связью уровня FeNO со степенью гиперреактивности дыхательных путей [21, 30].
Процедура проведения измерений FeNO была стандартизирована в соответствии с рекомендациями American Thoracic Society/European Respiratory Society [14]. Референсные значения, рекомендуемые для интерпретации в реальной клинической практике, постоянно корректируются. Так, по литературным данным уровень FeNO>45ppb в детской популяции коррелирует с риском неконтролируемого течения и развитием обострения бронхиальной астмы даже у пациентов без выраженных клинических симптомов [22, 23]. Выводы этих исследований согласуются с нашими результатами, полученными в подгруппе 2 (FeNO≥50ppb). Снижение уровня FeNO наблюдалось в обеих подгруппах, что свидетельствовало об эффективности базисной терапии третьей ступени и подтверждалось уменьшением числа обострений в каждой из подгрупп. В то же время за 3 месяца наблюдений большее число обострений было зарегистрировано в подгруппе 2 по сравнению с подгруппой 1. Это может быть обусловлено исходно высоким уровнем FeNO у детей второй подгруппы по сравнению с пациентами подгруппы 1. Ряд авторов указывает на прямую зависимость уровня воспаления дыхательных путей и риска развития обострения [24, 25]. В соответствии с действующими международными рекомендациями оценку эффективности базисной терапии целесообразно проводить через 3 месяца, поэтому оптимальный момент мониторинга FeNO для принятия решения об изменении базисной терапии с целью снижения риска обострений необходимо искать в данном временном интервале. В нашем исследовании предсказательная способность мониторинга FeNO относительно риска обострений через 1 месяц терапии во второй группе и в общей когорте свидетельствует о целесообразности применения данного метода не ранее чем через 1 месяц после пересмотра терапии. В ряде других исследований была продемонстрирована предиктивная способность FeNO относительно риска развития обострений в перспективе до 18 месяцев [27, 28]. Таким образом, отсутствие контроля заболевания через 3 месяца возможно спрогнозировать определением уровня FeNO не ранее чем через 2 месяца после пересмотра терапии у пациентов с сохраняющимся уровнем FeNO>25 ppb. В то же время для пациентов с высоким исходным уровнем FeNO более 50ppb целесообразней проводить ежемесячный мониторинг FeNO для предсказывания возможных обострений в последующие 8 недель. Мониторинг FeNO нецелесообразно использовать для коррекции базисной терапии у всех пациентов с верифицированным диагнозом «Бронхиальная астма». В последние годы были получены клинические данные, свидетельствующие о необходимости выделения групп (фенотипов) пациентов с астмой, для которых мониторинг FeNO может быть более эффективным по сравнению с традиционной ступенчатой стратегией подбора базисной терапии [29]. Поиск таких фенотипов будет являться целью наших дальнейших исследований.
Заключение. Таким образом, ежемесячный мониторинг оксида азота в выдыхаемом воздухе у детей с неконтролируемым течением бронхиальной астмы может быть полезным инструментом для прогнозирования развития обострений и основанием для более раннего пересмотра базисной терапии с целью повышения эффективности лечения. Необходимо дальнейшее изучение возможностей использования данного неинвазивного метода диагностики при различных фенотипах и на разных этапах подбора базисной терапии бронхиальной астмы.




















Список литературы
1. Dweik RA, Comhair SA, Gaston B, et al. NO chemical events in the human airway during the immediate and late antigen-induced asthmatic response. Proceedings of the National Academy of Sciences of the United States of America. 2001;98(5):2622-2627. DOI: 10.1073/pnas.051629498
2. Deykin A, Lazarus SC, Fahy JV, et al. Sputum eosinophil counts predict asthma control after discontinuation of inhaled corticosteroids. Journal of Allergy and Clinical Immunology. 2005;115:720-7. DOI: 10.1016/j.jaci.2004.12.1129
3. Qiu W, Guo F, Glass K, et al. Differential connectivity of gene regulatory networks distinguishes corticosteroid response in asthma. Journal of Allergy and Clinical Immunology. 2018;141:1250-8. DOI: 10.1016/j.jaci.2017.05.052
4. Grzelewski T, Witkowski K, Makandjou-Ola E, et al. Diagnostic value of lung function parameters and FeNO for asthma in schoolchildren in large, real-life population. Pediatric Pulmonology. 2014;49(7):632-40. DOI: 10.1002/ppul.22888
5. Bonato M, Bazzan E, Snijders D, et al. Clinical and pathologic factors predicting future asthma in wheezing children. A longitudinal study. American Journal of Respiratory Cell and Molecular Biology. 2018;59:458-66. DOI: 10.1165/rcmb.2018-0009OC
6. Visitsunthorn N, Prottasan P, Jirapongsananuruk O, et al. Is fractional exhaled nitric oxide (FeNO) associated with asthma control in children? Asian Pacific Journal of Allergy and Immunology. 2014;32(3):218-25. DOI: 10.12932/AP0362.32.3.2014
7. Petsky HL, Kew KM, Chang AB. Exhaled nitric oxide levels to guide treatment for children with asthma. Cochrane Database of Systematic Reviews. 2016;11:CD011439. DOI: 10.1002/14651858.CD011439.pub2
8. Arnold RJ, Massanari M, Lee TA, et al. A Review of the Utility and Cost Effectiveness of Monitoring Fractional Exhaled Nitric Oxide (FeNO) in Asthma Management. Managed Care. 2018;27(7):34-41.
9. Paull K, Covar R, Jain N, et al. Do NHLBI lung function criteria apply to children? A cross-sectional evaluation of childhood asthma at National Jewish Medical and Research Center, 1999-2002. Pediatric Pulmonology. 2005;39(4):311-317. DOI: 10.1002/ppul.20161
10. Fuhlbrigge AL, Kitch BT, Paltiel AD, et al. FEV(1) is associated with risk of asthma attacks in a pediatric population. Journal of Allergy and Clinical Immunology. 2001;107(1):61-67. DOI: 10.1067/mai.2001.111590
11. Rao DR, Gaffin JM, Baxi SN, et al. The utility of forced expiratory flow between 25% and 75% of vital capacity in predicting childhood asthma morbidity and severity. Journal of Asthma. 2012;49(6):586-592. DOI: 10.3109/02770903.2012.690481
12. Rodriguez‐Martinez CE, Sossa‐Briceno MP, Castro‐Rodriguez JA. Factors predicting persistence of early wheezing through childhood and adolescence: a systematic review of the literature. Journal of Asthma and Allergy. 2017;10:83-98. DOI: 10.2147/JAA.S128319
13. Goleva E, Babineau DC, Gill MA, et al. Expression of corticosteroid‐regulated genes by PBMCs in children with asthma. Journal of Allergy and Clinical Immunology. 2019;143:940-7. DOI: 10.1111/resp.13529
14. American Thoracic Society. European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 2005;171:912-30. DOI: 10.1164/rccm.200406-710ST
15. Alving K. FeNO and suspected asthma: better to identify responsiveness to treatment than to label with a diagnosis. The Lancet Respiratory Medicine. 2018;6(1):3-5. DOI: 10.1016/S2213-2600(17)30429-0.
16. Rao DR, Phipatanakul W. An Overview of Fractional Exhaled Nitric Oxide and Children with Asthma. Expert Review of Clinical Immunology. 2016;12(5):521-530. DOI:10.1586/1744666X.2016.1141049
17. Fielding S, Pijnenburg M, de Jongste JC, et al. Change in FEV1 and Feno Measurements as Predictors of Future Asthma Outcomes in Children. Chest. 2019;155(2):331-341. DOI: 10.1016/j.chest.2018.10.009
18. Lu M, Wu B, Che D, et al. FeNO and asthma treatment in children: a systematic review and meta-analysis. Medicine. 2015;94(4):e347. DOI: 10.1097/MD.0000000000000347
19. Sly PD, Holt PG. Predicting steroid responsiveness in asthmatic children: are we there yet? Journal of Allergy and Clinical Immunology. 2019;143:927-8. DOI: 10.1016/j.jaci.2018.07.035
20. Gupta A, Bhat G, Pianosi P. What is New in the Management of Childhood Asthma? Indian Journal of Pediatrics. 2018;85(9):773-781. DOI: 10.1007/s12098-018-2705-1
21. Jatakanon A, Lim S, Kharitonov SA, et al. Correlation between exhaled nitric oxide, sputum eosinophils, and methacholine responsiveness in patients with mild asthma. Thorax. 1998;53(2):91-95. DOI: 10.1136/thx.53.2.91
22. Agache I, Ciobanu C. Predictive value of lung function trend and FeNO for difficult asthma in children. Journal of Investigational Allergology and Clinical Immunology. 2012;22(6):419-426.
23. Dweik RA, Boggs PB, Erzurum SC, et al. An official ATS clinical practice guideline: interpretation of exhaled nitric oxide levels (FENO) for clinical applications. American Journal of Respiratory and Critical Care Medicine. 2011;184(5):602-615. DOI:10.1164/rccm.9120-11ST
24.Zeiger RS, Schatz M, Zhang F, et al. Elevated exhaled nitric oxide is a clinical indicator of future uncontrolled asthma in asthmatic patients on inhaled corticosteroids. Journal of Allergy and Clinical Immunology. 2011;128(2):412-414. DOI: 10.1016/j.jaci.2011.06.008
25. Kupczyk M, ten Brinke A, Sterk PJ, et al. Frequent exacerbators – a distinct phenotype of severe asthma. Clinical and Experimental Allergy. 2014;44(2):212-221. DOI: 10.1111/cea.12179
26.Petsky HL, Kew KM, Turner C, et al. Exhaled nitric oxide levels to guide treatment for adults with asthma. Cochrane Database of Systematic Reviews. 2016;9:CD011440. DOI: 10.1002/14651858.CD011440.pub2
27. Michils A, Baldassarre S, Van Muylem A. Exhaled nitric oxide and asthma control: a longitudinal study in unselected patients. European Respiratory Journal. 2008;31(3):539-546. DOI: 10.1183/09031936.00020407
28. Gelb AF, Flynn Taylor C, Shinar CM, et al. Role of spirometry and exhaled nitric oxide to predict exacerbations in treated asthmatics. Chest. 2006;129(6):1492-1499. DOI: 10.1378/chest.129.6.1492
29. Arnold RJ, Massanari M, Lee TA et al. A Review of the Utility and Cost Effectiveness of Monitoring Fractional Exhaled Nitric Oxide (FeNO) in Asthma Management. Managed Care. 2018;27(7):34-41.
30. Mallol J, Riquelme C, Aguirre V et al. Value of bronchial reversibility to salbutamol, exhaled nitric oxide and responsiveness to methacholine to corroborate the diagnosis of asthma in children. Allergologia et Immunopathologia. 2020. DOI: 10.1016/j.aller.2019.11.001