Гендерные особенности метаболических нарушений у пожилых больных с сердечной недостаточностью с промежуточной фракцией выброса
Aннотация
Актуальность: На сегодняшний день важным является увеличение частоты развития сердечной недостаточности с возрастом. Патогенетические механизмы, выявляемые при метаболическом синдроме и атеросклерозе свидетельствуют о взаимосвязи этих процессов, при этом у каждого второго больного с коронарной патологией выявляются признаки метаболических нарушений. Клиническая значимость оценки метаболического синдрома и его отдельных компонентов в отношении прогнозирования риска развития сердечной недостаточности с промежуточной фракцией выброса (СНпФВ) ишемической этиологии остается неясной. Цель исследования: Выяснить взаимосвязь метаболического синдрома и его компонентов с риском развития СНпФВ у пожилых больных и выявить гендерные патофизиологические различия между больными СНпФВ пожилого возраста. Материалы и методы: Обследовано 120 больных СНпФВ (40-49%) II функционального класса по NYHA ишемического генеза, средний возраст – 66,5±7,8 года. Изучали уровень глюкозы, гликированного гемоглобина (HbA1c), инсулина, лептина в сыворотке крови, рассчитывали индекс HOMA-IR. Оценивали липидный спектр – уровень общего холестерина, липопротеидов низкой и высокой плотности, триглицеридов. Результаты: Выявлена заметная положительная корреляционная связь абдоминального ожирения с уровнем лептина (r=0,56, р<0,05), с концентрацией в плазме крови инсулина (r=0,54, р<0,05) и индексом HOMA-IR (r=0,53, р<0,05). Так же выявлена высокая положительная связь абдоминального ожирения и уровня общего холестерина (r=0,86, р<0,001), умеренная связь с уровнем триглицеридов (r=0,46, р<0,05) и умеренная отрицательная корреляционная связь с липопротеидами высокой плотности (r=-0,34, р<0,05). Изучение гендерных особенностей у больных СНпФВ на фоне метаболического синдрома позволило выявить более высокую концентрацию инсулина (∆17%), лептина (∆33%) в крови у женщин, чем мужчин. У женщин выявлено более высокое содержание липопротеидов низкой плотности (∆12%) и более низкое содержание липопротеидов высокой плотности (∆10%), чем у мужчин. Заключение: Таким образом, у женщин с СНпФВ ишемического генеза на фоне метаболического синдрома отмечается наиболее выраженное по сравнению с мужчинами абдоминальное ожирение, ассоциированное с более высокими уровнями лептина крови и инсулинорезистентности, более высоким уровнем липопротеидов низкой плотности и более низким содержанием липопротеидов высокой плотности.
Ключевые слова: сердечная недостаточность, промежуточная фракция выброса, пожилой возраст, метаболический синдром
Введение. Сердечно-сосудистые заболевания являются наиболее важной причиной заболеваемости и смертности среди пожилых людей во всем мире, при этом сердечная недостаточность является наиболее быстро растущей сердечно-сосудистой нагрузкой на здоровье во всем мире [1, 2]. Частота сердечно-сосудистых событий увеличивается после 65 лет у мужчин и после 75 лет у женщин [2], при этом у каждого второго больного с коронарной патологией выявляются признаки метаболического синдрома (МС) [3]. Пожилые пациенты представляют собой особую категорию пациентов, обусловленную физиологическими изменениями, вызванными возрастом, большим количеством сопутствующих заболеваний и медикаментозным лечением. По данным Всемирной Организации Здравоохранения, пожилые люди находятся в возрасте более 60-65 лет. Принимая во внимание большой процент пожилых людей в общей численности населения, очень важно отметить, что частота развития сердечной недостаточности увеличивается с возрастом. Клиническая значимость оценки МС и его отдельных компонентов в отношении прогнозирования риска развития сердечной недостаточности с промежуточной фракцией выброса ишемической этиологии остается неясной.
Цельисследования. Выявить гендерные патофизиологические различия между больными пожилого возраста с СНпФВ в зависимости от наличия МС.
Материалы и методы исследования. В исследовании приняли участие 120 больных ХСН с промежуточной фракцией выброса (40-49%) II функционального класса по NYHA ишемического генеза. Симптомы и признаки ХСН определялись согласно рекомендациям экспертного комитета Европейского общества кардиологов и национальным рекомендациям, 2018 года. Критерием исключения были онкологические, инфекционные заболевания, тяжелые поражения печени и почек в анамнезе; любые хирургические вмешательства в предшествующие 6 месяцев. Все больные подписывали информированное согласие.
У всех пациентов была проведена оценка состояния их здоровья путем физикального осмотра и изучения медицинской документации. Мы оценили возраст больных, наличие метаболических нарушений, а также корреляцию между изучаемыми показателями.
Определение показателей углеводного обмена проводили всем больным, уровень глюкозы изучали автоматическим анализатором (Vital Scientific, Нидерланды); гликированного гемоглобина (HbA1c) в крови непосредственным определением; инсулин – автоматически на анализаторе Immulite 2000 (США). По формуле D. Matthews (1985) рассчитывали индекс HOMA-IR (показатель инсулинорезистентности). Уровень лептина определяли иммуноферментным методом с использованием систем Leptin ELISA (Diaghostics Biochem Canada Inс (DHC Inc)).
Изучение липидного спектра заключалось в определении уровня общего холестерина (ОХ) на автоматическом биохимическом анализаторе (Vital Scientific, Нидерланды). Холестерин липопротеинов высокой плотности (ЛПВП) и триглицериды (ТГ) количественно оценивали прямым гомогенным тестом (Human GmbH, Германия). Уровень липопротеинов низкой плотности (ЛПНП) определяли расчетным методом по формуле W. Friedewald (1972г.)
Статистический анализ проводился с использованием STATISTICA 10.0, формирование базы данных пациентов вели с помощью таблиц Excel MS Office 2016. Исходные и полученные значения были описаны с использованием стандартной статистики и сравнены с помощью парных t-тестов или по Вилкоксону. Параметры значений представлены в виде среднего показателя со стандартным отклонением или медианы (Ме) и интерквартильные размахи (Q25, Q75). Корреляции между двумя переменными оценивались с помощью рангового критерия Спирмена. Статистически достоверными считали различия при р<0,05.
Результаты и их обсуждение. Общую группу (120 пациентов) составили 65 (54%) мужчин и 55 (46%) женщин в возрасте от 58 до 74 лет (средний возраст 66,5±7,8 года).
В нашем исследовании все пациенты были разделены на две группы в зависимости от наличия метаболического синдрома. Симптомы и признаки ХСН определялись согласно рекомендациям экспертного комитета Европейского общества кардиологов и национальным рекомендациям, 2018 года.
Больные хронической сердечной недостаточностью с промежуточной фракцией выброса на фоне ИБС представляют интерес в изучении особенностей клинико-анамнестической, антропометрической, функциональной характеристики и метаболических особенностей, так как литературные данные по клиническому сочетанию этих заболеваний отсутствуют.
Сравнительный анализ клинической характеристики обследованных групп представлен в таблице 1.
Кроме того, больные с СНпФВ на фоне МС чаще имели артериальную гипертензию (88%) по сравнению с больными без МС (48%), пароксизмальную фибрилляцию предсердий 8% и 5% соответственно.
Нами проанализированы клинико-лабораторные данные больных обеих групп СНпФВ ишемического генеза (без МС и при наличии МС) в зависимости от пола: подгруппа 1.1 – мужчины СНпФВ ишемического генеза без метаболических нарушений; подгруппа 1.2 – женщины СНпФВ ишемического генеза без метаболических нарушений; подгруппа 2.1 - – мужчины СНпФВ ишемического генеза с метаболическим синдромом; подгруппа 2.2 – женщины СНпФВ ишемического генеза с метаболическим синдромом. В клинической картине СНпФВ женщины по сравнению с мужчинами чаще имели пастозность голеней и стоп, одышку при физической нагрузке, патологический III тон, набухание яремных вен.
Основным диагностическим критерием метаболического синдрома, в соответствии с рекомендациями (2009), является абдоминальное ожирение. В связи с этим при диагностике абдоминального ожирения мы использовали окружность талии (ОТ), как основной критерий, и отношение окружности талии к окружности бедер (ОБ). Объем талии у больных СНпФВ без МС составил 97,2 (95,1; 100,3) см, у больных СНпФВ ишемического генеза и МС был выше – 116,3 (107,3; 127,1) см, при этом разница (∆%) составила 16% (p<0,01). Показатель ОТ/ОБ у больных СНпФВ без МС – 0,96 (0,93; 0,99), у больных СНпФВ, ИБС на фоне МС – 1,09 (1,04; 1,17), разница составила 10% (p<0,05).
Объем талии у мужчин в подгруппе 1.1 – 94,9 (90,5;98,3) см, у женщин в подгруппе 1.2 составил 95,8 (85,2;97,4) см. Достоверной разницы по объему талии между мужчинами и женщинами СНпФВ, ИБС без МС не выявлено. Объем талии у мужчин в подгруппе 2.1 – 108,3 (107,3; 111,8) см, у женщин в подгруппе 2.2 – 121,4 (114,3; 127,1) см и был достоверно выше, чем у мужчин (∆11%, p<0,05). Отношение ОТ/ОБ у мужчин в подгруппе 1.1 – 0,99 (0,94; 1,05), у женщин в подгруппе 1.2 – 0,95 (0,87; 1,02), что свидетельствует об отсутствии достоверных различий у больных без МС, ∆% составила 4% (p>0,05). Отношение ОТ/ОБ у мужчин в подгруппе 2.1 – 1,05 (1,04; 1,07), у женщин в подгруппе 2.2 – 1,14 (1,09; 1,17), при этом ∆% составила 8% (p<0,05), что согласуется с опубликованным эпидемиологическим исследованием [4], в котором у женщин с метаболическим синдромом определялись более высокие показатели окружности талии.
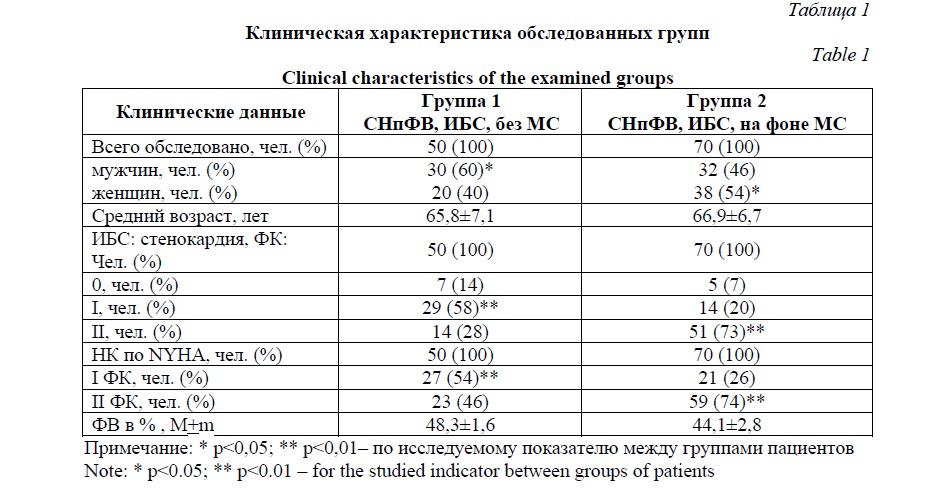
По данным литературы, при МС абдоминальное ожирение связано с повышенной продукцией лептина и развитием лептинорезистентности [5]. Было показано, что лептин обладает защитными эффектами, связанными с ослаблением окислительного стресса. В связи с этим, нами было изучено содержание в крови данного показателя у больных СНпФВ. Содержание лептина в крови у больных СНпФВ без нарушений метаболизма – 13,6 (10,5; 18,4) нг/мл, у больных СНпФВ ишемической этиологии с МС – 26,6 (17,8; 32,7) нг/мл, разница составила 49% (р<0,001). Кроме того, полученные нами результаты свидетельствуют о достоверно более высоком уровне лептина в крови у женщин в обеих подгруппах, чем у мужчин (рис.1). Уровень лептина у мужчин в подгруппе 1.1 – 11,9 (9,2; 12,9) нг/мл, у женщин в подгруппе 1.2 – 14,7 (12,4; 17,1) нг/мл, при этом ∆% составила 19% (p<0,01). Уровень лептина у мужчин в подгруппе 2.1 – 19,2 (16,8; 22,4) нг/мл, у женщин в подгруппе 2.2 – 28,7 (24,6; 34,1) нг/мл, при этом ∆% составила 33% (p<0,01).
Таким образом, наличие МС у пожилых больных с СНпФВ ишемического генеза ассоциировалось с абдоминальным ожирением, более выраженном у женщин, чем у мужчин. В патогенезе метаболических нарушений у больных СНпФВ ишемического генеза имеет место гиперлептинемия, более выраженная у женщин, чем у мужчин.
У больных с метаболическими нарушениями особое значение имеет состояние инсулинорезистентности, для диагностики которого нами был использован расчетный индекс HOMA-IR, определенный по показателям глюкозы натощак и содержания инсулина в крови.
В группе больных СНпФВ без МС уровень инсулина в крови – 8,86 (8,64; 9,25) мкМЕ/мл, у больных группы СНпФВ на фоне МС – 14,02 (11,01; 17,24) мкМЕ/мл, то есть выше на (∆%) – 36% (р<0,01). У мужчин в подгруппе 1.1 уровень инсулина в крови – 9,07 (9,22; 9,75) мкМЕ/мл, у женщин в подгруппе 1.2 (рис.2) выявлены более высокие значения данного показателя – 10,02 (9,91; 10,09) мкМЕ/мл по сравнению с мужчинами, при этом ∆% составила 9% (p<0,05). У мужчин в подгруппе 2.1 уровень инсулина в крови – 13,25 (11,01; 15,38) мкМЕ/мл, у женщин в подгруппе 2.2 выявлены более высокие уровни инсулина в крови (16,01 (15,81; 17,24) мкМЕ/мл) по сравнению с мужчинами, ∆% составила 17% (p<0,01).

В группе пожилых больных СНпФВ без МС уровень глюкозы находился в пределах нормальных значений и составил 5,32 (5,10; 5,44) ммоль/л, в группе больных СНпФВ на фоне МС – 6,08 (5,78; 6,22) ммоль/л, разница составила 13% (р<0,05). Гендерных различий по уровню глюкозы выявлено не было.
Среди критериев метаболического синдрома активно обсуждается роль инсулинорезистентности, которая является компонентом метаболического синдрома и была определена нами на основании индекса HOMA-IR, рассчитанного из показателей глюкозы натощак и концентрации инсулина в крови. Инсулинорезистентность сопровождается компенсаторным повышением секреции инсулина и гиперинсулинемией для поддержания нормальной концентрации глюкозы.
У больных СНпФВ ишемического генеза без метаболических нарушений значение индекса HOMA-IR было ниже диагностического критерия инсулинорезистентности и составило – 2,52 (2,14; 2,72) ед., у больных же в группе СНпФВ с наличием МС индекс HOMA-IR был 4,92 (4,61; 5,28) ед., разница (∆%) составила 48% (р<0,001), что является косвенным признаком инсулинорезистентности. При изучении гендерных особенностей индекса HOMA-IR было установлено, что у мужчин в подгруппе 1.1 значение составило 2,31 (2,05; 2,47) ед., у женщин в подгруппе 1.2 – 2,65 (2,47; 2,77) ед., что выше на 13% (р<0,05). В группе пожилых мужчин СНпФВ на фоне МС, его значение было 4,32 (4,11; 4,58) ед., у женщин (подгруппа 2.2) – 5,58 (5,32; 5,74) ед., разница составила 23% (р<0,01).
Соответственно, у больных СНпФВ с МС повышен как уровень глюкозы, так и инсулина, что свидетельствует об инсулинорезистентности. Различия по индексу HOMA-IR между группами больных СНпФВ ишемического генеза в зависимости от МС определялись в наибольшей степени уровнем инсулина, чем глюкозы.
Результаты нашей работы свидетельствуют, что независимо от наличия метаболического синдрома, пожилые женщины с СНпФВ ишемического генеза имеют более высокие уровни инсулина и индекса HOMA-IR, чем мужчины.
С учетом того, что причиной развития сердечной недостаточности у пожилых больных в нашем исследовании была ишемическая болезнь сердца, мы оценили гендерные особенности и зависимость содержания ОХ от наличия МС. У больных СНпФВ, имеющих метаболические нарушения уровень общего холестерина (ОХ) крови составил 6,68 (6,38; 6,96) ммоль/л, что превышает показатели группы сравнения на 17% (p<0,01). У больных СНпФВ без МС содержание ОХ – 5,52 (5,10; 5,79) ммоль/л. У мужчин в подгруппе 1.1 уровень холестерина в плазме крови составил 5,58 (5,11; 5,72) ммоль/л, у женщин в подгруппе 1.2 – 5,51 (4,96; 5,68) ммоль/л (р>0,05). У женщин в подгруппе 2.2. концентрация ОХ была 6,72 (6,53; 6,94), у мужчин в подгруппе 2.1 – 6,67 (6,38; 6,96) ммоль/л (р>0,05). Достоверных гендерных различий по содержанию общего холестерина нами не установлено. Нами проанализировано содержание ТГ в обеих группах больных СНпФВ и выявлено, что в группе больных СНпФВ с МС уровень ТГ был выше, чем в группе без МС (соответственно, 2,38 (2,21; 2,54) ммоль/л и 1,76 (1,54; 1,88) ммоль/л, разница составила 26% (р<0,01). Достоверных различий по гендерному признаку выявлено не было.
В группе пожилых больных СНпФВ на фоне МС уровень ЛПНП был 3,62 (3,34; 3,86) ммоль/л, а в группе сравнения без МС – 2,85 (2,76; 3,30) ммоль/л, разница составила 21% (p<0,01). Особый интерес у пожилых больных представляют гендерные особенности содержания в крови высоко атерогенного ЛПНП, что представлено на рисунке 3.
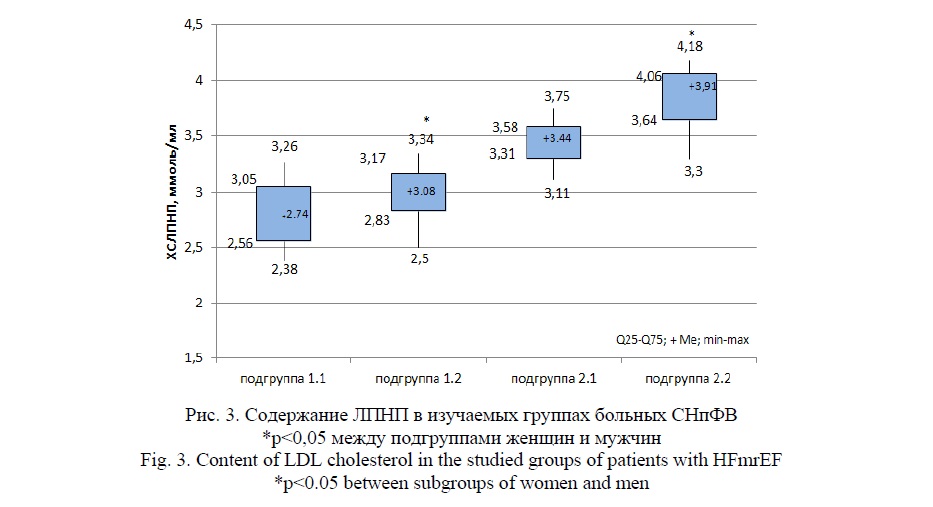
Так, у пожилых мужчин (подгруппа 1.1) с СНпФВ без МС концентрация ХС ЛПНП в крови была – 2,74 (2,56; 3,05) ммоль/л, в то время как у женщин подгруппы 1.2 она составила 3,08 (2,83; 3,17) ммоль/л, что на ∆11% выше, чем у мужчин (p<0,05). Следует отметить, что у пожилых женщин на фоне МС (подгруппа 2.2) содержание ЛПНП в плазме крови составило – 3,91 (3,64; 4,06) ммоль/л, при этом у мужчин концентрация – 3,44 (3,31; 3,58) ммоль/л, что на 12% ниже, чем у женщин (p<0,05).
Известно, что при МС имеет место дисбаланс между про- и антиатерогенными фракциями липидов. В связи с этим мы проанализировали концентрацию ЛПВП в плазме крови изучаемых больных. В группе пожилых больных СНпФВ без МС содержание ЛПВП составило 1,12 (1,02; 1,15) ммоль/л, в группе больных на фоне МС выявлен более низкий уровень липопротеидов высокой плотности – всего 0,90 (0,78; 0,96) ммоль/л, разница между группами составила ∆20% (р<0,01).
Не меньший интерес представляют гендерные различия антиатерогенной фракции липопротеидов у пожилых больных. Так, у мужчин подгруппы 1.1 содержание в крови ЛПВП – 1,07 (1,00; 1,16) ммоль/л, в то время как у женщин подгруппе 1.2 – 1,17 (1,10; 1,22) ммоль/л, разница составила 8% (р<0,05). Следует обратить внимание, что при сочетании СНпФВ и МС у пожилых женщин уровень липопротеидов высокой плотности оказался ниже (0,81 (0,78; 0,85) ммоль/л), чем у мужчин – 0,90 (0,85; 0,96) ммоль/л, разница (∆,%) между группами составила 10% (р<0,05).
Таким образом, проанализировав гендерные изменения липидного профиля у пожилых больных СНпФВ ишемического генеза в зависимости от наличия МС можно сделать вывод, что они состоят в более высоком уровне ЛПНП и более низком уровне ЛПВП у женщин, что ассоциируется с дополнительным усилением атерогенного потенциала крови по сравнению с мужчинами.
Нами был проведен анализ взаимосвязи абдоминального ожирения (по критерию ОТ) с изученными показателями метаболического статуса у пожилых больных СНпФВ ишемического генеза. Нами выявлена заметная положительная корреляционная связь абдоминального ожирения с уровнем лептина (r=0,56, р<0,05), что полностью согласуется с литературными данными об избыточной продукции лептина при МС [6]. Лептинорезистентность, в свою очередь, приводит к ожирению [7].
Кроме того, нами выявлена заметная положительная корреляционная зависимость абдоминального ожирения с концентрацией в плазме крови инсулина (r=0,54, р<0,05) и индексом HOMA-IR (r=0,53, р<0,05), то есть развитием инсулинорезистентности, которая на сегодняшний день так же относится к основным компонентам МС. Известно, что гиперинсулинемия приводит к снижению содержания липопротеидов высокой плотности, изменению структуры и размеров липопротеидов, ремоделированию макро- и микрососудистого русла [8, 9]. Кроме того, известно, что при МС повышенное содержание инсулина в крови при нарушенной толерантности к глюкозе с одной стороны поддерживает нормогликемию, с другой – ведет к нарушениям, способствующим развитию сердечно-сосудистых заболеваний [10, 11].
В результате проведенного корреляционного анализа нами выявлена высокая положительная связь абдоминального ожирения и уровня ОХ (r=0,86, р<0,001), умеренная связь с уровнем ТГ (r=0,46 р<0,05) и умеренная отрицательная корреляционная связь с ЛПВП (r=-0,34, р<0,05). Известно, что гиперхолестеринемия является ведущей причиной ИБС [12]. В нашем исследовании продемонстрировано, что на фоне МС у пожилых больных СНпФВ ишемического генеза увеличивается атерогенность плазмы крови за счет более высокого содержания ОХ и ТГ по сравнению с пожилыми больными без МС. Дислипидемия у пожилых больных СНпФВ ишемического генеза усугубляется за счет более высокой концентрации ЛПНП и более низкой ЛПВП на фоне метаболического синдрома. В соответствии с данными литературы, дислипидемия у больных с МС заключается в повышении в крови уровня триглицеридов и снижении липопротеидов высокой плотности на фоне снижения чувствительности тканей к инсулину [13].
Задачей исследования было изучение гендерных особенностей у пожилых больных СНпФВ ишемического генеза на фоне МС. Важным представляется установленная нами у пожилых женщин с СНпФВ, ИБС связь абдоминального ожирения с ОТ, которая у них была на 11% больше, чем у мужчин.
В литературе [14] описан более высокий уровень лептина у женщин, чем у мужчин, что объяснялось особенностями распределения жира в женском организме, стимулирующим эффектом эстрогенов и прогестерона или подавляющим влиянием андрогенов. В другом опубликованном исследовании [15] было показано, что у женщин с МС гиперлептинемия тесно коррелирует с инсулинорезистентностью. Однако, в этих исследованиях не изучались гендерные различия в зависимости от возрастной категории. В связи с этим, и так же учитывая литературные данные об участии лептина в развитии ожирения, мы провели оценку его концентрации в крови у пожилых больных по гендерному признаку. Так, нами выявлено, что у пожилых женщин с СНпФВ ишемического генеза на фоне МС уровень лептина в крови был выше (∆, 33%), чем у мужчин.
Особенности углеводного обмена у мужчин и женщин представляют интерес для анализа, поскольку инсулинорезистентность является одной из кардинальных характеристик метаболического синдрома [16]. В нашей работе установлено, что при наличии СНпФВ на фоне МС у пожилых женщин по сравнению с мужчинами определялась более высокая (∆, 17%) концентрация инсулина в крови.
При сравнительном анализе липидного спектра крови у мужчин и женщин мы не выявили статистически значимых различий по уровню общего холестерина и триглицеридов. Вместе с тем, были обнаружены особенности, связанные с уровнем в крови высоко атерогенных липопротеинов низкой плотности, уровень которых был у пожилых женщин выше (∆, 12%), чем мужчин. В тоже время, показатель липопротеидов высокой плотности у пожилых женщин СНпФВ на фоне МС был ниже (∆, 10%), чем у мужчин. При интерпретации полученных результатов мы учитывали, что женщины, включенные в данное исследование, находились в периоде менопаузы. Известно, что у женщин среднего возраста с нормальной массой тела содержание в плазме, как общего холестерина, так и липопротеидов низкой плотности ниже, чем у мужчин, а липопротеидов высокой плотности – выше. При наступлении менопаузы у женщин, по мере снижения продукции эстрогенов, увеличивается количество висцерального жира, уменьшается активность печеночной липазы, что сопровождается снижением уровня липопротеидов высокой плотности в крови [17].
Заключение. Таким образом, в нашем исследовании установлено, что абдоминальное ожирение у пожилых пациентов с СНпФВ ишемического генеза на фоне метаболического синдрома имеет прямую корреляцию с гиперлептинемией. Наличие признаков метаболического синдрома у пожилых больных СНпФВ ишемического генеза ассоциируется как с гиперинсулинемией, так и с инсулинорезистентностью, а липидный профиль крови отличается не только гиперхолестеринемией, но и гипертриглицеридемией, увеличением концентрации липопротеидов низкой плотности и снижением уровня липопротеидов высокой плотности. Установлены отдельные гендерные особенности у пожилых больных СНпФВ ишемического генеза и нарушением метаболизма. Так, у пожилых женщин с СНпФВ ишемического генеза на фоне МС отмечается наиболее выраженное по сравнению с мужчинами абдоминальное ожирение, ассоциированное с более высокими уровнями лептина крови и инсулинорезистентности, более высоким уровнем ЛПНП и более низким содержанием ЛПВП.




















Список литературы