Поиск ассоциаций генов-кандидатов, дифференциально экспрессирующихся в плаценте, с риском развития плацентарной недостаточности с синдромом задержки роста плода
Aннотация
Актуальность: Плацентарная недостаточность (ПН) – одно из осложнений беременности, часто приводящее к развитию синдрома задержки роста плода (СЗРП). СЗРП определяется как патологическое торможение внутриутробного роста плода и неспособность его достичь своего потенциала роста. Цель исследования: Изучить ассоциации однонуклеотидных полиморфизмов генов-кандидатов, дифференциально экспрессирующихся в плаценте, с риском развития плацентарной недостаточности с синдромом задержки роста плода. Материалы и методы: Выборку исследования составили 273 беременных с плацентарной недостаточностью с синдромом задержки роста плода и 631 женщина с физиологической беременностью. Всем женщинам проведено типирование десяти однонуклеотидных полиморфизмов пяти генов, дифференциально экспрессирующихся в плаценте (HK2, BCL6, NDRG1, ENG, RDH13). Анализ ассоциаций полиморфных маркеров с развитием ПН с СЗРП оценивали с помощью логистического регрессионного анализа в рамках аддитивной, доминантной и рецессивной генетических моделей. Результаты: Аллель A rs10496196 HK2 ассоциирован с развитием плацентарной недостаточности с СЗРП в рамках аддитивной (OR=1,40, 95%Сl 1,05-1,87, р=0,024), и доминантной (OR=1,44, 95%Сl 1,04-2,0, р=0,03) моделей взаимодействия аллелей. Кроме того данный полиморфный локус связан с уровнем транскрипции 5 генов (HK2, POLE4, AC104135,2, AC104135,3, AC104135,4) в различных органах и тканях (pFDR≤0,05) и с уровнем альтернативного сплайсинга транскрипта гена MTHFD2 в крови и гена POLE4 в коже (pFDR≤0,05). Заключение: Аллель A rs10496196 HK2 является фактором риска развития плацентарной недостаточности с синдромом задержки роста плода у беременных Центрально-Черноземного региона России.
Ключевые слова: плацентарная недостаточность, синдром задержки роста плода, полиморфизм, гексокиназа 2
Введение. Плацентарная недостаточность (ПН) – cиндром, связанный с морфофункциональными изменениями в плаценте и нарушениями компенсаторно-приспособительных механизмов, обеспечивающих функциональную полноценность органа. ПН – результат сложной реакции плода и плаценты на различные патологические состояния материнского организма, проявляющийся комплексом нарушений транспортной, трофической, эндокринной и метаболической функций плаценты, лежащих в основе патологии плода и новорожденного [1].
Плацентарная недостаточность является причиной таких нарушений беременности, как преэклампсия и синдром задержки роста плода (СЗРП) [2, 3]. СЗРП определяется как патологическое торможение внутриутробного роста плода и неспособность его достичь своего потенциала роста, при котором размеры плода ниже 10-го процентиля для данного гестационного возраста [4].
Перинатальная смертность среди женщин с плацентарной недостаточностью составляет среди доношенных новорожденных 10.3‰, среди недоношенных – 49‰ [5]. В 60% случаев плацентарная недостаточность приводит к развитию СЗРП, который занимает третье место в структуре причин перинатальной заболеваемости [5].
Плацентарная недостаточность с СЗРП является гетерогенным осложнением беременности и включают широкий спектр как средовых, так и генетических факторов риска [3, 6].
Так как плацента принимает непосредственное участие в развитии плода путем обеспечения транспорта различных веществ, иммунной защиты и нейроэндокринных функций, логичным является изучение экспрессии генов плацентарной ткани, влияющих на вес и рост плода, и развитие таких нарушений беременности, как плацентарная недостаточность с синдромом задержки роста плода.
Проведенные исследования транскриптома плаценты у беременных с СЗРП выявляют различия в экспрессии генов по всему геному. Процессы, связанные с изменением экспрессии плацентарных генов, включают: ангиогенез, иммунные реакции, энергетический обмен и регуляцию роста [7-13].
Ассоциативные исследования по изучению генетических факторов развития плацентарной недостаточности с СЗРП, проведенные в России, связаны с оценкой полиморфизмов генов фолатного цикла, факторов коагуляции, липидного обмена и газового гомеостаза [14-17].
В зарубежных исследованиях количество работ, посвященных изучению генетических аспектов плацентарной недостаточности с СЗРП не так обширно, и, в основном, затрагивает оценку патогенетической значимости полиморфизмов генов фолатного цикла [18-20], системы гемостаза [18, 21], главного комплекса гистосовместимости [22], провоспалительных цитокинов [23].
Цель исследования. Изучить ассоциации однонуклеотидных полиморфизмов генов-кандидатов, дифференциально экспрессирующихся в плаценте, с риском развития плацентарной недостаточности с синдромом задержки роста плода.
Материалы и методы исследования. Группу исследования составили 273 беременных с развитием плацентарной недостаточности с синдромом задержки роста плода и 631 женщина с физиологической беременностью.
Группу исследования составили женщины русской национальности без родственных связей, родившиеся и проживающие на территории Центрального Черноземья РФ.
Клинико-лабораторное обследование беременных проводилось на базе перинатального центра Белгородской областной клинической больницы Святителя Иоасафа.
Все женщины подписали информированное согласие до начала участия в данном исследовании.
Изучаемые параметры включали: возраст, сведения о месте рождения, жительства, антропометрические данные (вес, индекс массы тела, рост, масса тела при рождении).
Средний возраст женщин с плацентарной недостаточностью с СЗРП составил 27,18±4,84 лет, в группе контроля – 26,57±4,94 лет (р<0,05). Значение ИМТ в группе женщин с плацентарной недостаточностью с СЗРП составило 23,40±4,31 кг/м2, в группе контроля 23,40±3,47 кг/м2 (р>0,05).
При формировании выборки были определены критерии исключения: наличие патологии матки (фибромиома матки, аномалии развития внутренних половых органов), осложнения беременности (изосенсибилизация по резус фактору, аномалии расположения и прикрепления плаценты,), плодовые причины (врожденные пороки развития, генетические болезни), многоплодная беременность.
Диагностика СЗРП проводилась, основываясь на клинических данных, которые подтверждались данными ультразвуковой фетометрии (определялся бипариетальный размер головки плода, окружность грудной клетки и живота, длина плечевой и бедренной костей (аппарат TOSHIBA XARIO SSA-660A)) [24]. Фетометрические показатели, полученные при ультразвуковом исследовании сравнивались с номограммами F. Hadlock и гестационным сроком, что позволяло подтвердить наличие СЗРП, его степень выраженности и форму [24].
Кровь для исследования (5 мл) была взята из локтевой вены каждого участника в пластиковую пробирку (Vacutainer®), содержащую 0,5 М раствор ЭДТА (рН = 8,0). Геномная ДНК была выделена из лейкоцитарной массы с использованием стандартного фенол-хлороформного метода и затем проверена на качество с помощью спектрофотометра Nanodrop 2000 (Thermo Scientific, Inc.).
Всем женщинам проводилось типирование 10 однонуклеотидных полиморфизмов генов, дифференциально экспрессирующихся в плаценте: гексокиназы 2 (rs10496196 HK2), белка цинковых пальцев 51 (rs3821817 BCL6 и rs3774298 BCL6), цитоплазматического белка суперсемейства гидролаз (rs11545664 NDRG1, rs2227262 NDRG1, rs2977559 NDRG1, rs3802252 NDRG1,), эндоглина (rs12609771 ENG), ретинолдегидрогеназы 13 (rs1671215 RDH13 и rs1654439 RDH13). Данные полиморфные локусы были включены в исследование, так как имеют значимый регуляторный потенциал и оказывают значимое влияние на экспрессию генов [25]. Регуляторный потенциал изучаемых полиморфизмов и влияние их на экспрессию генов оценивали с использованием следующих онлайн-инструментов: HaploReg (v4.1) (https://pubs.broadinstitute.org/mammals/haploreg/haploreg.php), Genotype-Tissue Expression (GTEx) GTExportal (http://www.gtexportal.org/). Анализ ассоциаций изученных полиморфных локусов с уровнем транскрипции генов осуществлялся с помощью методики, представленной в исследовании [26].
Ассоциации полиморфных локусов с риском развития плацентарной недостаточности с СЗРП оценивали с помощью лог-линейного регрессионного анализа в рамках трех основных генетических моделей (аддитивной, рецессивной и доминантной) с учетом коррекции на ковариаты: возраст, индекс массы тела, количество артифициальных абортов в анамнезе, наличие артериальной гипертензии в анамнезе, наличие преэклампсии в анамнезе, наличие плацентарной недостаточности с СЗРП в анамнезе).
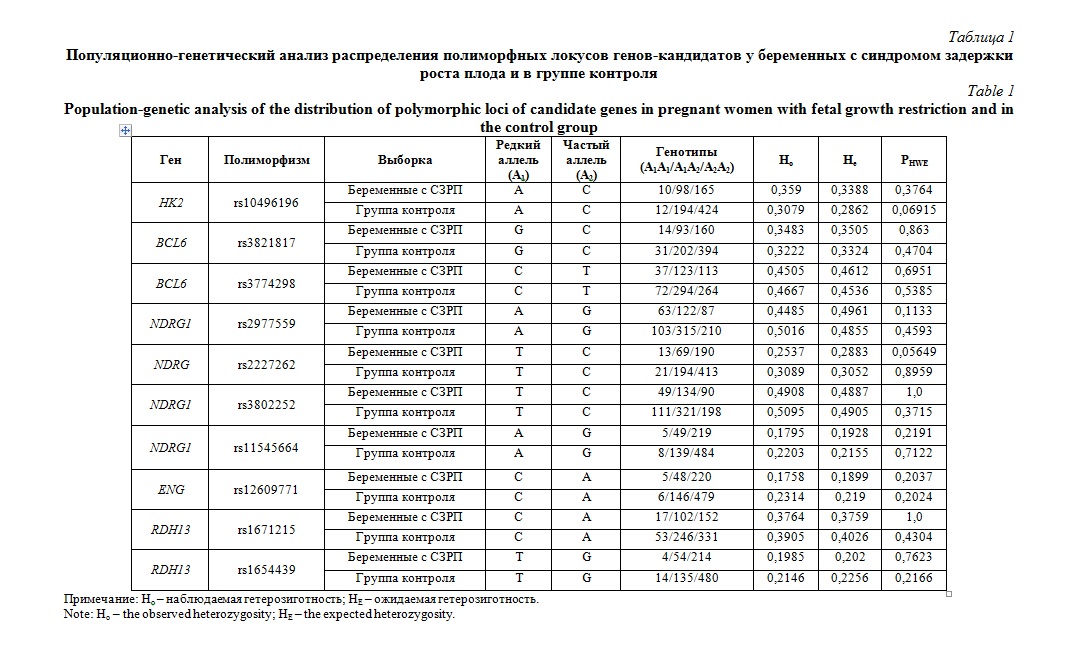
Результаты и их обсуждение. Результаты популяционно-генетического анализа распределения генотипов в исследуемых группах беременных представлены в таблице 1. По всем рассмотренным десяти локусам генов-кандидатов наблюдаемая гетерозиготность (Ho) соответствует теоретически ожидаемой гетерозиготности (He) (эмпирическое распределение генотипов соответствует теоретически ожидаемому при равновесии Харди-Вайнберга (р>0,05).
Результаты исследований по поиску ассоциаций полиморфизмов генов, дифференциально экспрессирующихся в плаценте, с риском развития плацентарной недостаточности с СЗРП представлены в таблице 2.
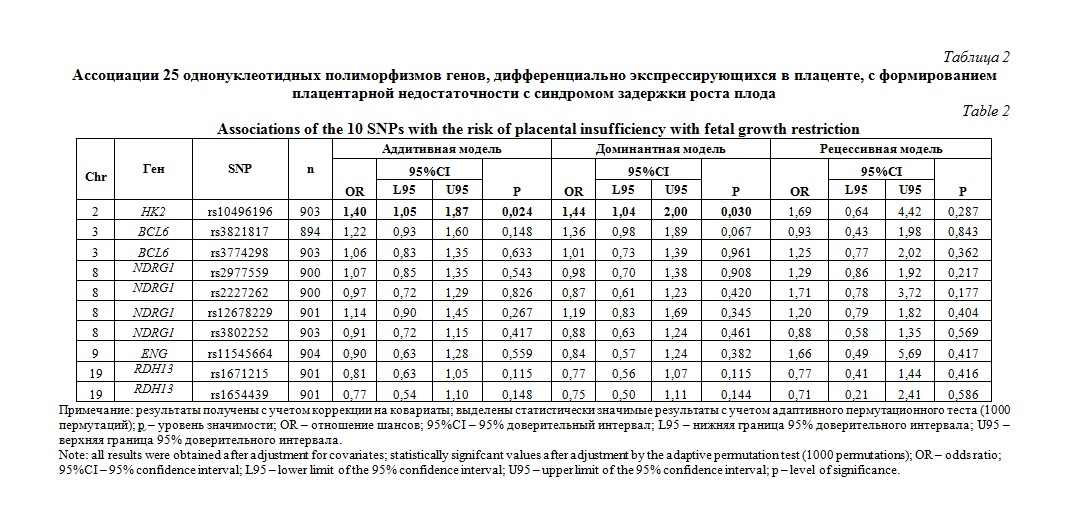
Установлено, что аллель A rs10496196 HK2 ассоциирован с развитием плацентарной недостаточности с СЗРП в рамках аддитивной (OR=1,40, 95%Сl 1,05-1,87, р=0,024), и доминантной (OR=1,44, 95%Сl 1,04-2,0, р=0,03) моделей взаимодействия аллелей.
На следующем этапе работы с помощью программного обеспечения HaploReg (v4.1) были оценены регуляторные эффекты локуса rs10496196 HK2, ассоциированного с риском развития плацентатной недостаточности с СЗРП.
Данный анализ показал, что изученный полиморфный маркер находится в регионе модифицированных гистонов, маркирующих промоторы (H3K4me3, H3K27ac) и энхансеры (H3K4me1, H3K9ac) в различных культурах клеток, тканях и органах; расположен в области гиперчувствительности к ДНКазе-1 в 19 клеточных культурах и тканях; находится в области регуляторного мотива ДНК, взаимодействующего с регуляторными белками CFOS, CJUN, STAT3. Также данный полиморфизм локализован в регионе регуляторных мотивов ДНК, определяющих взаимодействие с факторами транскрипции Ets, Nrf-2, TATA. При это, аллель А, являющийся фактором риска в развитии плацентарной недостаточности с СЗРП, понижает афинность к трем рассматриваемым факторам транскрипции (разница между LOD коэффициентами альтернативного и референсного аллелей для факторов транскрипции Ets и Nrf-2 составляют -12, для фактора транскрипции TATA – -11,7).
При помощи проекта Genotype-Tissue Expression (GTEx) (http://www.gtexportal.org/) установлено значимое eQTL значение полиморфного локуса rs10496196 HK2 (таблица 3). Данный полиморфизм ассоциирован с уровнем транскрипции 5 генов (HK2, POLE4, AC104135,2, AC104135,3, AC104135,4) в различных органах и тканях (pFDR≤0,05). Также изученный полиморфизм связан с уровнем альтернативного сплайсинга транскрипта гена MTHFD2 в крови (интрон ID: 74211866:74214079:clu_38697, β=-0,31, p=0,0000026, pFDR≤0,05) и гена POLE4 в коже (интрон ID: 74959425:74960105:clu_48974, β=-0,36, p=0,000028, pFDR≤0,05).
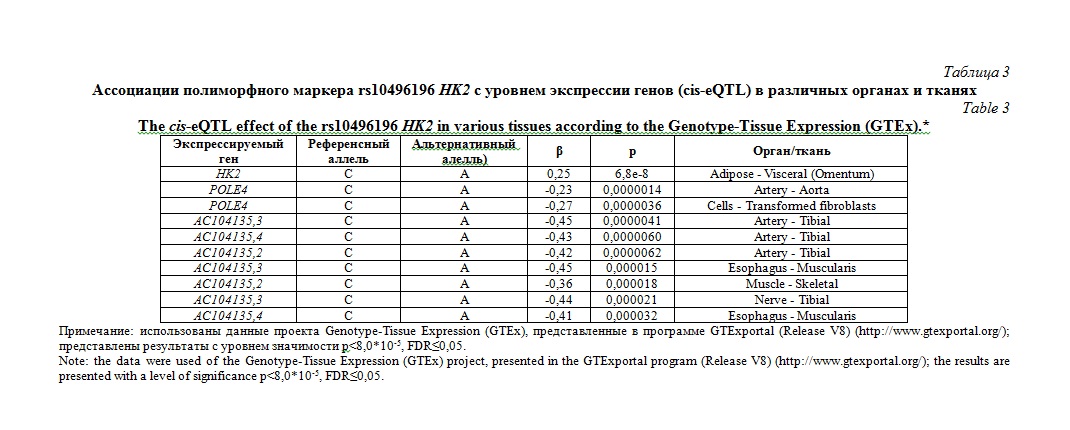
Таким образом, в нашем исследовании выявлена ассоциация полиморфизма rs10496196 HK2 с развитием плацентарной недостаточности с СЗРП, установлены значимые регуляторные эффекты данного полиморфного маркера.
Согласно литературным данным гексокиназы – группа ферментов, которые катализируют первую ферментативную реакцию гликолиза – АТФ-зависимое фосфорилирование глюкозы до глюкозо-6-фосфата [27]. В тканях животных описано четыре изофермента гекзокиназ, кодируемых соответствующими генами – HK1, HK2, HK3, HK4 [28].
В работе, проведенной Hong с соавт. [29] было показано, что HK2, также стимулирует поглощение глюкозы и выработку лактата стромальными клетками эндометрия человека. При этом пониженная экспрессия HK2 ингибировала пролиферацию и дифференцировку стромальных клеток эндометрия, подавляя гликолиз и нарушая децидуализацию.
Нарушение децидуализации в дальнейшем может привести к нарушению ремоделирования спиральных артерий и развитию ишемии плаценты. Возникшая ишемия индуцирует окислительный стресс в тканях, что приводит к селективному подавлению синтеза белка и уменьшению пролиферации клеток. В результате происходит снижение объема ворсинок хориона и площади поверхности для обмена между организмом матери и плода. Недостаточность кровоснабжения плода в дальнейшем приводят к задержке его развития и снижению веса при рождении [30].
Другие исследователи не оценивали роль полиморфизма rs10496196 HK2 в развитии ПН c СЗРП. Лишь в некоторых работах изучалась связь данного гена с развитием преэклампсии [29, 31].
Заключение. Аллель A rs10496196 HK2 является фактором риска развития плацентарной недостаточности с синдромом задержки роста плода в рамках аддитивной (OR=1,40, 95%Сl 1,05-1,87, р=0,024), и доминантной (OR=1,44, 95%Сl 1,04-2,0, р=0,03) моделей взаимодействия аллелей у беременных Центрально-Черноземного региона России.
Благодарности
Работа выполнена при финансовой поддержке гранта Президента Российской Федерации для ведущих научных школ Российской Федерации (проект НШ-2609.2020.7).




















Список литературы