Полиморфизм гена VEGFA, курение и ишемическая болезнь сердца: значимость генно-средовых взаимодействий для развития заболевания
Aннотация
Актуальность: В России ишемическая болезнь сердца (ИБС) является очень распространенным заболеванием, характеризующимся высокой смертностью, поэтому проблема раннего прогноза и профилактики данного заболевания представляется особенно актуальной. В связи с мультифакториальной этиологией ИБС, понимание генетических факторов развития заболевания медицинскими работниками является перспективным для более полноценного формирования групп риска среди населения нашей страны и проведения предупредительных мероприятий. Цель исследования:Изучение роли взаимодействий полиморфизмов гена сосудистого эндотелиального фактора роста-А (VEGFA) и курения в развитии ИБС. Материалы и методы:Образцы ДНК 1214 неродственных индивидов (555 больных ИБС и 659 здоровых лиц) использовались для генотипирование SNPs rs3025039, rs2010963, rs833061, rs3025000 и rs833068 гена VEGFA методом ПЦР льном времени (ПЦР-РВ) с помощью TaqMan-зондов. Результаты:Мы впервые выявили ассоциации полиморфных вариантов rs2010963, rs833061, rs3025000 и rs833068 с риском развития ИБС исключительно у курильщиков независимо от пола и возраста (PGxE£0,01). Установлено, что аллели rs2010963C, rs833061T, rs3025000T и rs833068A были ассоциированы с повышением уровня экспрессии гена VEGFA в тканях организма. Заключение:SNPs rs3025000 и rs833068 в рамках данной работы были впервые нами представлены как генетические маркеры предрасположенности к ишемической болезни сердца. Рассмотренные полиморфные варианты гена VEGFA (rs2010963, rs833061, rs3025000 и rs833068) ассоциированы с риском развития ИБС посредством потенцирования негативных влияний химических компонентов табачного дыма на формирование атеросклеротического процесса в коронарных артериях.
Ключевые слова: ишемическая болезнь сердца, ген сосудистого эндотелиального фактора роста-А (VEGFA), однонуклеотидный полиморфизм (SNP), курение, генно-средовые взаимодействия, аннотирование SNP, эпигенетические модификации
Введение. Ишемическая болезнь сердца (ИБС) – это заболевание, возникающее вследствие уменьшения или прекращения кровоснабжения миокарда, в связи с поражением в системе коронарных артерий. Согласно статистическим данным в 2016 году в Российской Федерации было зарегистрировано более 7 миллионов пациентов с установленным диагнозом ИБС, а смертность от заболевания составила 397,4 случаев на 100 тысяч человек [1]. Согласно данным ВОЗ в подавляющем большинстве развитие случаев ИБС (примерно у 95% больных) связано с атеросклеротическим процессом в коронарных артериях. Основными факторами риска развития ИБС являются: артериальная гипертензия, ожирение, гиперхолестеринемия, сахарный диабет 2-го типа, принадлежность к мужскому полу, наследственная отягощенность по ИБС, нерациональное питание, курение, а также возраст старше 55 лет [2, 3].
Известно, что этиология ишемической болезни сердца имеет мультифакториальную природу, то есть в развитии заболевания играют роль взаимодействия многочисленных генетических и средовых факторов [4]. К настоящему времени идентифицирован широкий спектр генов, ассоциированных с предрасположенностью к ИБС, включая полиморфные варианты генов регуляции липидного обмена, контролирующих свертывание крови и тонус сосудов, факторов адгезии и эндотелиальной дисфункции [5]. Установленные гены-кандидаты, ассоциированные с предрасположенностью к ИБС, характеризовались слабыми или умеренными фенотипическими эффектами и даже их совокупное влияние на коронарный атеросклероз объясняет лишь незначительную долю подверженности болезни, что указывает на значимую роль факторов окружающей среды в формировании заболевания [5]. Как правило, в генетических исследованиях этиологии ИБС, как впрочем, и других мультифакториальных заболеваний, совместная оценка генетических маркеров и средовых факторов на развитие болезни проводится далеко не во всех работах, хотя именно для этого класса болезней влияние факторов окружающей среды имеет наибольшее значение [6]. Хорошо известно, что курение в значительной степени повышает риск развития ИБС, особенно у генетически восприимчивых людей [7]. Однако молекулярные механизмы, посредством которых средовые факторы потенцируют влияние генов на развитие ИБС, по-прежнему, остаются еще недостаточно изученными.
Одной из патогенетически значимых для развития ИБС групп генов, потенциально вовлеченных в формирование артериального русла (в том числе коронарных артерий) и развитие коллатерального кровообращения, являются сосудистые эндотелиальные факторы роста (VEGF). Семейство VEGF включают в себя шесть факторов роста: VEGFA, VEGFB, VEGFC, VEGFD, VEGFE и плацентарный фактор роста (PLGF) [8]. Одним из генов, которые могут вносить вклад в развитие ИБС, является VEGFA, который регулирует миграцию, пролиферацию и дифференцировку клеток эндотелия сосудов, в связи с чем, полиморфные варианты данного гена представляют интерес в качестве потенциальных генетических маркеров риска развития ИБС. Полиморфные варианты гена VEGFA при ИБС ранее были изучены в некоторых популяциях мира, а их результаты суммированы в двух недавно опубликованных мета-анализах [9, 10]. Мета-анализ, выполненный Wang с соавт. [9], позволил установить взаимосвязь между однонуклеотидными полиморфизмами (SNPs) rs699947 и rs3025039 гена VEGFA и повышенным риском ИБС. Кроме того, полиморфизм rs2010963 был связан с развитием инфаркта миокарда. Результаты мета-анализа, проведенного Ма с соавт. [10], подтвердили результаты Wang с соавт., и показали, что полиморфизмы rs699947, rs2010963 и rs3025039 гена VEGF ассоциированы с повышенным риском развития ИБС. Анализ подгрупп, стратифицированный по расово-этническому признаку, показал, что полиморфизмы rs699947 и rs3025039 связаны с риском развития ИБС только в азиатских популяциях [10], тем самым, демонстрируя межрасовые/межэтнические различия во вкладе полиморфных вариантов гена VEGFA в детерминацию предрасположенности к ИБС. К сказанному следует добавить, что исследований, сфокусированных на поиске ассоциаций полиморфных вариантов гена VEGFA с риском развития ИБС в российских популяциях до настоящего времени не проводилось, а исследования, которые бы анализировали совместные влияния факторов риска (например, курения) и полиморфизмов VEGFA на риск развития болезни в мире немногочисленны.
Цель исследования. Целью настоящего исследования явилось изучение роли взаимодействий полиморфных вариантов гена сосудистого эндотелиального фактора роста-А и одного из ведущих средовых факторов риска болезни – курения в реализации наследственной предрасположенности к ишемической болезни сердца. Важной задачей исследования был биоинформатический анализ регуляторного потенциала SNPs, которые покажут ассоциации с развитием ИБС, с целью патофизиологической интерпретации гено-фенотипических корреляций.
Материалы и методы. В исследование было включено 1214 образцов ДНК биобанка научно-исследовательского института генетической и молекулярной эпидемиологии Курского государственного медицинского университета (КГМУ). Исследуемая когорта включала образцы ДНК 555 больных с диагнозом ИБС (53% мужчин и 47% женщин) и 659 относительно здоровых добровольцев без хронических заболеваний (51% мужчин и 49% женщин) – неродственных жителей Курской области славянского происхождения (более 90% были этнически русскими). У всех пациентов было получено информированное согласие на участие в исследовании. Протокол исследования был рассмотрен и утвержден на заседании Регионального этического комитета при КГМУ.
Все пациенты с ИБС находились на стационарном лечении в кардиологическом отделении, отделении сосудистой хирургии и рентгенохирургических методов диагностики областной клинической больницы (БМУ КОКБ), кардиологическом отделении больницы скорой медицинской помощи (ОБУЗ КГКБ СМП) г. Курска в период с 2011 по 2015 гг. в рамках проведения генетико-эпидемиологических исследований различных сердечно-сосудистых заболеваний [11-15]. Диагноз ИБС (стенокардия, инфаркт миокарда, постинфарктный кардиосклероз) устанавливался квалифицированными врачами-кардиологами на основании результатов клинического и лабораторно-инструментального обследования (данные суточного мониторирования ЭКГ, коронарографии). Анкетирование по наличию фактора риска курение проводилось при непосредственном общении с пациентами с использованием анкеты, разработанной на кафедре биологии, медицинской генетике и экологии КГМУ и использовавшейся нами в ранее проводившихся исследованиях [12, 13, 14, 16, 17].
Выделение ДНК производилось из цельной венозной крови методом фенольно-хлороформной экстракции. Для исследования было отобрано пять частых SNP rs3025039, rs2010963, rs833061, rs3025000 и rs833068 гена VEGFA. Выбор SNPs основывался на оценке гаплотипической структуры гена (отбор tagSNPs, r2≥0.8), частоте минорного аллеля (MAF>5%), регуляторном потенциале SNP – параметрах, необходимых для наиболее полного охвата вариабельности гена и включения наиболее функционально значимых полиморфных вариантов [18]. Генотипирование ДНК-полиморфизмов гена VEGFA проводилось методом ПЦР в режиме реального времени с дискриминацией аллелей с помощью TaqMan-зондов на амплификаторе CFX96 (Bio-Rad, США) с использованием коммерческих наборов Applied Biosystems (Thermo Fisher Scientific).
Статистическая обработка генетических и фенотипических данных осуществлялась с использованием программы SNPstats [19]. Ассоциации аллелей и генотипов VEGFA с развитием ИБС оценивались раздельно в группах, стратифицированных по наличию/отсутствию фактора риска курения, методом логистического регрессионного анализа посредством расчета показателя отношения шансов (OR) и границ 95%-го доверительного интервала (CI) с поправкой на пол и возраст индивидов. Программа SNPstats также рассчитывала уровень значимости, отражающий взаимодействие SNP-фактор риска - т.е. генно-средовые взаимодействия (PGxE). С целью интерпретации выявленных ассоциаций полиморфных вариантов гена VEGFA нами проводилось функциональное аннотирование SNPs с использованием доступных биоинформатических инструментов и интернет-ресурсов. С целью выявления QTLs (локусов количественных признаков), ассоциированных с исследуемыми полиморфизмами, нами использовались базы данных: eQTLGen (https://www.eqtlgen.org/cis-eqtls.html), GTEx portal (https://www.gtexportal.org)иQTLbase (http://mulinlab.tmu.edu.cn/qtlbase/index.html). Для изучения потенциальных механизмов эпигенетической регуляции экспрессии гена VEGFA, осуществляемой при участии его полиморфных вариантов нами использовались биоинформатические ресурсы SNPnexus (https://www.snp-nexus.org/index.html), интегрирующие экспериментальные данные проектов ENCODE (https://www.encodeproject.org) и Roadmap Epigenomics (http://www.roadmapepigenomics.org) и позволяющие выявлять функциональные элементы в геноме человека, которые контролируют экспрессию генов в различных видах клеток и тканей. Биоинформатический инструмент atSNP search [20] использовался нами для предсказания связывающей способности транскрипционных факторов (ТФ) с ДНК-мотивами в области SNPs, потенциально влияющих на экспрессию гена VEGFA. Программа позволяет рассчитывать статистики (P-уровни значимости) аффинности связывания ТФ с ДНК-мотивами, включающими каждый аллель, на основе оценки параметров PWM (position weight matrices – позиционные весовые матрицы) [21] – биоинформатического метода поиска мотивов в биологических последовательностях. Пороговое значение уровня значимости P<0,01 было принято для отбора кандидатных ТФ, в отношении которых in silico тестируемый аллель создает (gain) или теряет (loss) участок связывания для специфического регулятора транскрипции.
Результаты и их обсуждение. Распределение частот генотипов в группах больных ИБС и контроля находилось в соответствии с равновесием Харди-Вайнберга РХВ за исключением rs3025039, в отношении которого установлено статистически значимое отклонение от РХВ (P<0,01). Частоты минорных аллелей (MAF) полиморфных вариантов гена VEGFA в исследуемой нами выборки жителей Курской области были сопоставимы с таковыми в других европеоидных популяциях (P>0,05). В частности, MAF SNPs rs3025039 (T), rs2010963 (С), rs833061 (С), rs3025000 (T) и rs833068 (A) в исследованной нами популяции и усредненные MAF в европейских популяциях (данные проекта HapMap, www.ensembl.org) были следующими: 0,13, 0,27, 0,49, 0,26, 0,27 и 0,12, 0,31, 0,50, 0,29, 0,31, соответственно.
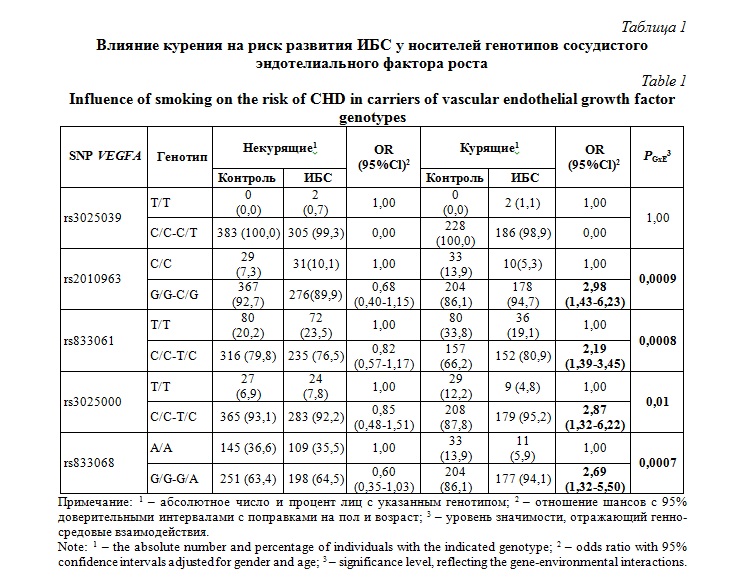
В таблице 1 представлены результаты анализа ассоциаций полиморфных vвариантов гена VEGFA с риском развития ИБС в зависимости от наличия у пациентов фактора риска курения. Четыре из пяти полиморфизмов VEGFA показали статистически значимые генно-средовые взаимодействия, отражающие синергичное влияние курения и SNPs на риск развития болезни. Так, генотипы G/G и C/G (генотипы с вариантным аллелем G) SNP rs2010963 оказались нейтральными в отношения влияния на риск развития ИБС у некурящих индивидов (P=0,19), в то время как у курильщиков (P=0,003) указанные генотипы увеличивали риск развития болезни, (PGxE=0,0009). Ассоциации с аналогичной направленности наблюдались и для полиморфизмов rs833061, rs3025000 и rs833068 (PGxE£0,01). В частности, генотипы C/C-T/C rs833061 (P=0,001), C/C-T/C rs3025000 (P=0,008) и G/G-G/A rs833068 (P=0,007) были ассоциированы с повышенным риском развития ИБС у курильщиков, а у некурящих индивидов не оказывали никакого влияния на развитие болезни (P>0,05). При этом выявленные генно-средовые взаимодействия не зависели от пола и возраста пациентов.
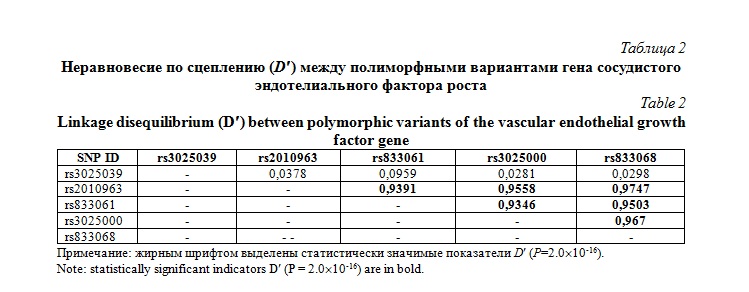
В таблице 2 представлены результаты анализа неравновесия по сцеплению между исследуемыми полиморфными вариантами гена VEGFA. Как можно увидеть из таблицы 2, полиморфизмы rs2010963, rs833061, rs3025000 и rs833068 находились в тесном неравновесии по сцеплению друг с другом (D¢>0,9), тогда как SNP rs3025039 не был сцеплен ни с одним из исследованных полиморфизмов VEGFA.
Для интерпретации выявленных ассоциаций нами было проведено функциональное аннотирование SNPs с использованием различных биоинформатических инструментов и онлайн-ресурсов. В таблице 3 представлены сводные данные по результатам функционального аннотирования полиморфных вариантов гена VEGFA. Базы данных eQTLGen, GTEx portal and QTLbase позволили установить, что исследуемые SNPs имеют статистически значимые eQTLs (expression Quantitative Trait Loci) – локусы, ассоциированные с экспрессией гена VEGFA в различных видах тканей и типов клеток. В большей степени нас интересовали клетки и ткани, которые могли бы иметь прямые или косвенные патофизиологические взаимосвязи с атеросклерозом коронарных артерий – т.е. артерии, ткани миокарда и клетки крови. Мы проанализировали данные функционального аннотирования для SNP, в отношении которых нами были выявлены статистически значимые генно-средовые взаимодействия. Мы обнаружили, что аллель G rs2010963 ассоциирован со снижением экспрессии гена VEGFA в крови согласно данным, полученным при использовании биоинформатических ресурсов QTLbase (P=1,0´10-4) и eQTLGen (P=1,3´10-26). Согласно результатам эпигенетического анализа, выполненного с использованием ресурса Roadmap Epigenomics Project, SNP rs2010963 ассоциирован с химическими модификациями гистона H3K4me3 в аорте, правом предсердии и левом желудочке сердца, а также гистона H3K27ac в правом предсердии и левом желудочке сердца. C помощью биоинформатического инструмента Regulatory Build (Ensembl) установлено, что SNP rs2010963 расположен в участке промотора, ассоциированном с повышением транскрипционной активности гена в аорте, правом предсердии и левом желудочке сердца.
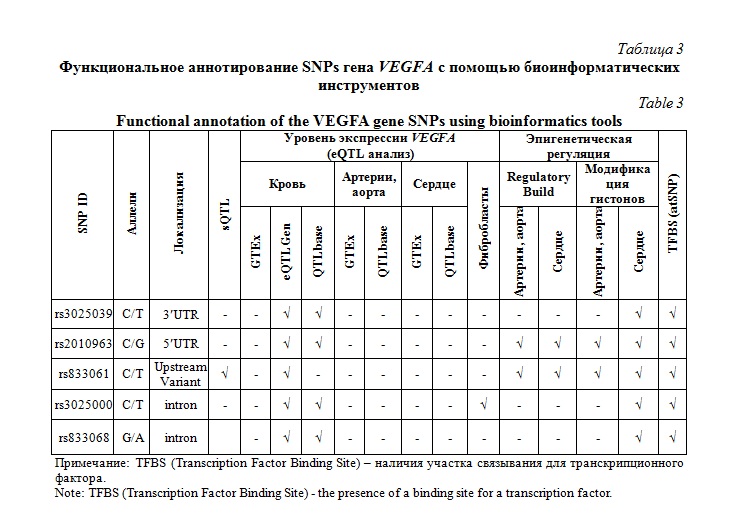
В отношении SNP rs833061 с помощью ресурса eQTLGen обнаружен один статистически значимый cisQTL – аллель T ассоциировался с увеличением экспрессии гена VEGFA в крови (P=4,4´10-12). Данный полиморфизм был также ассоциирован с sQTL в левом желудочке сердца (P=9,2´10-10). sQTL (splicing quantitative trait locus) представляют собой сплайсинговые локусы количественных признаков, которые посредством включения или выключения интронов могут регулировать альтернативный сплайсинг, тем самым формировать различные изоформы фермента в тканях. Кроме того, для SNP rs833061 в лимфоцитах крови обнаружен caQTL (chromatin accessibility quantitative trait locus) – аллель T был ассоциирован с доступностью хроматина для регуляции экспрессии рядом расположенных генов (P=5,1´10-08). С помощью ресурса Roadmap Epigenomics Project установлено, что SNP rs833061 ассоциируется с модификациями гистонов H3K36me3, H3K4me3 и H3K27ac в правом предсердии и аорте, а также гистона H3K27ac в левом желудочке сердца. Кроме того, онлайн-инструмент Regulatory Build показал, что SNP rs833061 расположен в участке промотора, усиливающего транскрипционную активность гена в аорте, правом предсердии и левом желудочке сердца.
Анализ транскриптомных данных портала GTEx показал, что аллель T SNP rs3025000 ассоциирован с повышением экспрессии гена VEGFA в культивированных фибробластах (P=0,000003) и крови (P=3,4´10-28). Кроме того, с полиморфизмом rs3025000 ассоциировались модификации гистонов H3K4me1 и H3K36me3 в левом желудочке сердца были. Согласно данным ресурса eQTLGen аллель A rs833068 ассоциировался с повышением экспрессии гена VEGFA в крови (P=1,1´10-27). В правом предсердии и левом желудочке сердца SNP rs833068 ассоциировался с химическими модификациями гистоновых белков, а именно H3K4me3 и H3K4me1, а также с гистонами H3K4me1 и H3K27ac в левом желудочке сердца.
С помощью in silico инструмента atSNP search установлено, что исследованные полиморфные варианты гена попадают в участки связывания для различных транскрипционных факторов, способных оказывать влияние на экспрессию гена VEGFA. Наибольший интерес представляли именно аллели, ассоциированные с риском развития ИБС у курильщиков. В частности, нами было предсказано, что аллель G SNP rs2010963 формирует участки связывания для транскрипционных факторов: SP1 (P=0,0009), NRF1 (P=0,005), NR3C1 (P=0,004), ETS1 (P=0,009), BDP1 (P=0,0001), RARA (P=0,005) и REST (P=0,0005). Аллель С полиморфизма rs833061 формировал участки связывания для ТФ, таких как: ETS1 (P<0,0001), HINFP (P=0,0009), E2F1 (P=0,002), семейство ТФ EGR (P=0,007) и FOXN1 (P=0,007), В отношении аллеля С SNP rs3025000 установлены участки связывания для восьми транскрипционных факторов, а именно: RXRA (P=0,009), REST (P<0,0001), HNF4 (P<0,0001), VDR (P=0,001), NR2F1 (P=0,008), VDR (P=0,007), ZBTB18 (P=0,009) и HNF4A (P=0,007), Аллель A полиморфизма rs833068 ассоциировался с формированием участков связывания для ТФ IRF1 (P=0,009), RHOXF1 (P=0,007), HNF1 (P=0,007), TBX21 (P=0,007), ZNF652 (P=0,0005) и HNF1A (P=0,005), Проведенное исследование подтвердило ранее выявленную взаимосвязь полиморфизма rs2010963 (−405C>G) гена сосудистого эндотелиального фактора роста А с риском развития ИБС [10], в то время как в исследуемой нами популяции ассоциация SNP rs3025039 (+936C>T) с риском развития болезни не была воспроизведена. Нами подтверждена также ассоциация SNP rs833061 (-460C>T) с риском развития ИБС, обнаруженная ранее у англичан [22]. Ассоциации полиморфных вариантов rs3025000 и rs833068 гена VEGFA с риском развития ишемической болезни сердца нами были впервые выявлены.
В целом, результаты исследования демонстрируют, с одной стороны, значимость вариабельности гена VEGFA в детерминации наследственной предрасположенности к ИБС, с другой – существование межпопуляционных различий во вкладе отдельных полиморфных вариантов данного класса генов. Эти различия могут быть объяснены, как гаплотипической структурой генофондов различных этносов, так и популяционно-географическими особенностями воздействия известных факторов риска сердечно-сосудистых заболеваний на население. В этой связи изучение генно-средовых взаимодействий позволит глубже проникнуть в понимание механизмов, посредством которых происходит реализации наследственной предрасположенности к мультифакториальным заболеваниям в отдельно взятой популяции. Учитывая то, что исследования триггерного влияния курения на взаимосвязь полиморфных вариантов гена VEGFA в мире не многочисленны, новизна настоящего исследования заключалась в том, что нами впервые осуществлен анализ ассоциации различных полиморфных вариантов гена VEGFA с развитием ишемической болезни сердца в российской популяции, а также установлены генно-средовые взаимодействия – совместные влияния полиморфных вариантов гена и курения на риск развития заболевания.
Полученные результаты могут свидетельствовать о том, что полиморфные варианты rs2010963, rs833061, rs3025000 и rs833068 гена VEGFA ассоциированы с риском развития ИБС посредством потенцирования негативных влияний химических компонентов табачного дыма на формирование атеросклеротического процесса в коронарных артериях. В отдельных работах, выполненных ранее в других популяциях мира, были также обнаружены взаимодействия курения и полиморфных вариантов гена VEGFA. Так, в работе Chen с соавт. [22] было показано, что промоторный полиморфизм -2578A>C (rs699947), находящийся в выраженном неравновесии по сцеплению с SNP rs833061, увеличивает риск развития ИБС у курильщиков, что согласуется с полученными нами результатами об ассоциации SNP rs833061 с развитием болезни у курящих индивидов. Примечательно, что подобные генно-средовые взаимодействия были ранее обнаружены и в отношении риска развития других заболеваний, что может указывать на неспецифичность механизмов влияния курения на риск развития болезней, развитие которых детерминируется полиморфными вариантами гена VEGFA. К примеру, было ранее установлено, что генотипы -460CT+CC SNP rs833061 ассоциированы с повышенным риском развития аденокарциномы пищевода исключительно у курильщиков, а у некурящих, эти генотипы, наоборот, снижали риск развития данной формы рака [23].
В рамках настоящего исследования нами была предпринята попытка всестороннего биоинформатического анализа регуляторного потенциала полиморфизмов для понимания механизмов, посредством которых они связаны с формированием ИБС при участии фактора риска курения. Интегрированные данные транскриптомного и геномного анализа интернет-ресурсов eQTLGen, GTEx portal и QTLbase позволили установить взаимосвязи полиморфных вариантов с уровнем экспрессии гена VEGFA в различных тканях. Так, аллели rs2010963C, rs833061T, rs3025000T и rs833068A были ассоциированы с увеличением экспрессии гена VEGFA. Данная находка была ожидаемой, так как согласно полученным нами данных эти SNPs находятся в тесном неравновесии по сцеплению друг с другом (D¢>0,9). Результаты геномно-транскриптомного анализа подтверждаются и результатами биохимических исследований. К примеру, известно, что генотип rs2010963СС ассоциирован с увеличением уровня VEGFA в плазме крови [24] и связан с повышенной экспрессией гена согласно полученным нами данным биоинформатического анализа. Возникает вполне логичный вопрос, каким образом аллели, ассоциированные со снижением экспрессии VEGFA (согласно результатам транскриптомных исследований), увеличивают риск развития ишемической болезни сердца у курильщиков и действительно ли указанные аллели увеличивают транскрипционную активность гена? Для поиска ответа на данный вопрос можно обратиться к результатам insilico-анализа эпигенетической регуляции экспрессии гена VEGFA. Основываясь на результатах insilico анализа эпигенетического регуляторного потенциала SNPs Химические модификации гистонов (ацетилирование и метилирование), находящиеся в окружении мотивов ДНК, включающие участки вариабельности нуклеотидов, ассоциированные с риском ИБС, могут способствовать усилению транскрипционной активности гена VEGFA в миокарде, а также аорте (по всей видимости, в том числе и в коронарных артериях). В частности, модификация гистона H3K4me3 (добавление трех метильных групп к остатку лизину в 4-м положении гистона H3) была связана с активацией транскрипции рядом расположенных промоторов генов [25], увеличивая доступ хроматина к транскрипционным факторам. Известно, что “метка” H3K27ac (ацетилирование гистона Н3 на 27-м остатке лизина), располагаясь в области старта транскрипции (TSS), способствует активации транскрипции генов [26]. Модификация гистона H3K36me3 (добавление трех метильных групп к 36-му остатку лизина гистона Н3) также связана с транскрипционной активацией генов [27]. H3K4me1 (метилирование по 4-му остатку лизина гистона H3) располагается в области активных энхансеров, тонко настраивая усиление экспрессии рядом расположенных генов [28]. Таким образом, SNPs, ассоциированные у курильщиков с развитием ИБС, посредством эпигенетических модификаций гистонов могут способствовать усилению транскрипционной активности гена VEGFA. Какое отношению к такому эффекту может иметь курение? Интересен тот факт, что результаты многочисленных эпидемиологических и экспериментальных исследований на животных установили, что химические компоненты табачного дыма действительно способны усиливать экспрессию и секрецию сосудистого эндотелиального фактора роста [29-34].
Вышеизложенные примеры наглядно демонстрируют, что табачный дым представляет собой потенциальный модулятор активности и/или экспрессии сосудистого эндотелиального фактора роста. Можно предположить, что такая модуляция экспрессии связана со способностью компонентов табачного дыма вызывать химические модификации гистонов, распаковывая хроматин для связывания ДНК с ТФ, как это было наглядно продемонстрировано на клетках легочных тканей у курильщиков [35].
В целом, полученные нами результаты показывают, что риск ИБС у курильщиков зависит от носительства определенных аллелей. В этой связи заслуживают внимание результаты in silico-предсказания участков связывания для транскрипционных факторов в области ДНК-мотивов, включающих ассоциированные с ИБС аллели гена VEGFA. В частности было предсказано in silico, что аллель G SNP rs2010963 формирует участки связывания для различных транскрипционных факторов, из которых представляют интерес два – SP1 и ETS1. Известно, что табачный дым вызывает усиление экспрессии транскрипционного фактора SP1, который trans-активирует гены-мишени, нуклеотидные последовательности которых имеют участки связывания для этого ТФ [36]. Таким образом, можно предположить, что связывание SP1 с участком ДНК промотора гена VEGFA может способствовать активации его экспрессии у носителей G-аллеля SNP rs2010963. Другой транскрипционный активатор – ETS1, способный связываться с промотором гена VEGFA у носителей G-аллеля rs2010963 по результатам insilico-анализа, известен в качестве регулятора ангиогенеза посредством влияния на экспрессию генов, контролирующих миграцию и инвазию эндотелиальных клеток сосудов [37]. Подтверждением взаимодействия ETS1-VEGFA являются экспериментальные данные проекта ENCODE [38], которые демонстрируют, что ген VEGFA действительно является мишенью для действия транскрипционного фактора ETS1.
Следует также рассмотреть механизмы, объясняющие взаимосвязь повышенной экспрессии гена VEGFA с развитием коронарного атеросклероза. Очевидно, что патологическое действие курения на развитие атеросклероза посредством влияния на экспрессию гена VEGFA реализуется уже на фоне сформировавшихся еще в пренатальном периоде коронарных артерий. По всей видимости, повышенная выработка негативно сказывается на морфологических изменениях интимы (возможно, вследствие ее повреждения токсическими компонентами табачного дыма) коронарных артерий при формировании атеросклеротического процесса, чему есть подтверждение в литературе. Известно, что VEGFA специфически действует на эндотелиальные клетки, оказывая разнообразные биологические эффекты, включая повышение проницаемости сосудов, индуцирование ангиогенеза, васкулогенеза и митогенез эндотелиальных клеток, стимулирование миграции клеток и ингибирование апоптоза [39]. Примечательно, что митогенный эффект VEGFA не ограничивается стимулирующими влияниями на пролиферацию только эндотелиальных клеток и может способствовать усилению роста гладкомышечных клеток сосудов [40], что, несомненно, имеет патогенетическое значение для формирования атеросклероза. Подобно провоспалительным цитокинам VEGFA может способствовать развитию и прогрессированию атеросклероза посредством усиления пролиферации интимы сосудов, стенозирования артерий, увеличения размера и дестабилизации атеросклеротической бляшки, как это было ранее продемонстрировано экспериментальными исследованиями [41, 42, 43].
Заключение. Таким образом, в рамках настоящего исследования, с одной стороны, установлены новые генетические маркеры предрасположенности к ишемической болезни сердца (полиморфные варианты rs3025000 и rs833068), с другой стороны, наглядно продемонстрировано, что патологические эффекты полиморфных вариантов гена VEGFA на фенотипическом уровне реализуются при непосредственном участии ведущего средового фактора риска болезни - курения. Несомненно, наши предположения о молекулярных механизмах, посредством которых курение оказывает влияние на развитие атеросклероза коронарных артерий посредством модуляции экспрессии гена VEGFA, основанные на результатах insilico-анализа требуют проведения дополнительных экспериментальных исследований, направленных на токсикогенетическую оценку компонентов табачного дыма у носителей различных генотипов сосудистого эндотелиального фактора роста. Полученные результаты в очередной раз подчеркивают значимость эколого-генетических механизмов формирования атеросклероза [6] не только на индивидуальном уровне под влиянием вредных привычек или образа жизни, но и на уровне популяций, подвергающихся химическому загрязнению окружающей среды – атрибуту современной техногенной цивилизации.




















Список литературы