Распределение аллелей и гаплоблочная структура полиморфизма генов матриксных металопротеиназ у больных H.pylori-негативной язвенной болезнью желудка и двенадцатипестной кишки
Aннотация
Актуальность: Одной из важных задач является изучение молекулярно-генетических основ язвенной болезни желудка и двенадцатиперстной кишки. Данная патология достаточно широко распространена среди населения и имеет важное медико-социальное значение. Цель исследования: Целью настоящего исследования явился сравнительный анализ ассоциаций аллелей полиморфизма генов матриксных металлопротеиназ и гаплотипов полиморфных локусов гена матриксной металлопротеиназы 9 с развитием Н.pylori-негативной язвенной болезни желудка и язвенной болезни двенадцатиперстной кишки. Материалы и методы: Для данного исследования была сформирована выборка из 513 человек, среди которых 275 больных Н.pylori-негативной язвенной болезнью желудка (n=121) и двенадцатиперстной кишки (n=79) и 313 индивидуумов контрольной группы. Методом полимеразной цепной реакции синтеза ДНК (метод дискриминации аллелей) проведено генотипирование десяти полиморфных локусов генов матриксных металлопротеиназ: rs1799750 MMP1, rs243865 MMP2, rs679620 MMP3, rs1940475 MMP8, rs3918242, rs3918249, rs17576, rs3787268, rs2250889, rs17577 гена MMP9. Анализ ассоциаций аллелей и гаплотипов с язвенной болезнью проводился методом логистической регрессии. Построение гаплоблоков осуществлялось в программе Haploview v.4.2 с использованием алгоритмов «Confidence intervals» и «Solid Spine». Результаты: С развитием Н.pylori-негативной язвенной болезни желудка ассоциированы полиморфные локусы rs3918242 (OR=0,59, рperm=0,034), rs17577 гена MMP9 (OR=0,54, рperm=0,025) и гаплотип ТC полиморфных локусов rs3918242-rs3918249 (OR=0,56, pperm=0,032) гена MMP9. С возникновением Н.pylori-негативной язвенной болезни двенадцатиперстной кишки связан полиморфизм rs679620 гена MMP3 (OR=0,69, рperm=0,041). Структура гаплоблоков шести полиморфных локусов гена MMP9 у больных Н.pylori-негативной язвенной болезнью желудка и язвенной болезнью двенадцатиперстной кишки в сравнении с контрольной группой отличается. Заключение: Полиморфные локусы гена MMP9 вовлечены в развитие Н.pylori-негативной язвенной болезни желудка, а полиморфизм гена MMP-3 связан с возникновением Н.pylori-негативной язвенной болезни двенадцатиперстной кишки.
Ключевые слова: язвенная болезнь желудка и двенадцатиперстной кишки, ассоциации, MMP, полиморфизм, Н.pylori
Введение. Язвенная болезнь (ЯБ) представляет собой хроническое рецидивирующее заболевание, протекающее с чередованием периодов обострения и ремиссии, ведущим проявлением которого служит образование дефекта (язвы) в стенке желудка и двенадцатиперстной кишки [1]. Распространенность язвенной болезни в общей популяции составляет 5-10% [2, 3]. Согласно официальным статистическим данным Росстата заболеваемость язвенной болезнью желудка и двенадцатиперстной кишки (впервые установленный диагноз) среди населения России в настоящее время (2018 г) составляет 71,9 на 100 000 населения при имеющейся тенденции ее снижения в последние годы [4].
Известными факторами риска развития ЯБ являются бактерии H.Pylori, прием нестероидных противовоспалительных препаратов (НПВП), анальгетиков, психо-эмоциональные стрессы, табакокурение, злоупотребление алкоголем, нарушение режима питания, употребление в пищу пряных продуктов, наследственные факторы и др. [2, 5-10]. Одними из «главных» факторов риска возникновения ЯБ считаются микроорганизмы H.Pylori и чрезмерное использование нестероидных противовоспалительных препаратов [1, 9].
H.pylori-негативная, НПВП-негативная и аспирин-негативная язвенная болезнь, которая классифицируется как идиопатическая язва, регистрируется примерно в 20% случаев [11]. Она обусловлена дисбалансом между факторами, способствующими целостности слизистой оболочки, и факторами агрессии, повреждающими слизистую оболочку, но патогенетические механизмы, лежащие в основе развития идиопатической язвенной болезни, до сих пор неизвестны [12]. Среди факторов, вовлеченных в процессы воспаления и ранозаживления при развитии ЯБ важное значение имеют матриксные металлопротеиназы, определяющие деградацию и ремоделирование внеклеточного матрикса [13].
Цель исследования. Сравнительный анализ ассоциаций аллелей полиморфизма генов матриксных металлопротеиназ и гаплотипов полиморфных локусов гена матриксной металлопротеиназы 9 с развитием Н.pylori-негативной язвенной болезни желудка и язвенной болезни двенадцатиперстной кишки.
Материалы и методы исследования. Для данного исследования была сформирована выборка из 513 человек, среди которых 275 больных Н.pylori-негативной язвенной болезнью желудка (n=121) и язвенной болезнью двенадцатиперстной кишки (n=79) и 313 индивидуумов контрольной группы. В выборку для исследования включались индивидуумы русского этноса, родившиеся и проживающие в Центральном Черноземье РФ, не состоящие в родстве между собой. Пациенты включались в исследование только после установления диагноза, подтвержденного с помощью клинических и лабораторно-инструментальных методов обследования [1]. Диагностика язвенной болезни проводилась на базе отделения гастроэнтерологии Белгородской областной клинической больницы Святителя Иоасафа. Всем пациентам было выполнено эндоскопическое исследование желудка и двенадцатиперстной кишки (гастродуоденоскопия) с последующей биопсией. Для выявления Н.pylori проводилось морфологическое исследование биоптатов слизистой оболочки. В выборку для исследования включались только пациенты с Н.pylori-негативной язвенной болезнью. В контрольную группу включались индивидуумы без клинических и эндоскопических признаков язвенной болезни, сопоставимые с больными по возрасту и полу. Исследование проводилось под контролем этического комитета медицинского института Белгородского государственного национального исследовательского университета с информированного согласия всех обследуемых индивидуумов.
Для молекулярно-генетического исследования в соответствии с критериями, представленными в работе [14], были отобраны десять полиморфных локусов генов матриксных металлопротеиназ: rs1799750 MMP1, rs243865 MMP2, rs679620 MMP3, rs1940475 MMP8, rs3918242, rs3918249, rs17576, rs3787268, rs2250889, rs17577 гена MMP9. Генотипирование образцов ДНК проводилось с помощью полимеразной цепной реации на амплификаторе CFX96 (Bio-Rad) методом Tag-Man зондов (использовались наборы, разработанные ООО «Тест-Ген» (Ульяновск)). Геномная ДНК выделялась из периферической крови фенольно-хлороформным методом.
При анализе ассоциации использовалось программное обеспечение plink 1.06 (http://pngu.mgh.harvard.edu/Èpurcell/plink). Методом логистической регрессии изучены ассоциации аллелей и гаплотипов изучаемых полиморфизмов с развитием Н.pylori-негативной язвенной болезни желудка и язвенной болезни двенадцатиперстной кишки. Характер ассоциаций оценивался на основе показателя отношения шансов (OR) и его 95% доверительного интервала (95%CI) [15]. Построение гаплоблоков осуществлялось в программе Haploview v.4.2 с использованием алгоритмов «Confidence intervals» и «Solid Spine» с заданным порогом D’>0,8 (http://www.broad.mit.edu/mpg/haploview/).
В работе изучена связь полиморфизмов с несинонимическими заменами: предиктивный потенциал несинонимических замен изучался с использованием программ SIFT (http://sift.jcvi.org/) и PolyPhen-2 (http://genetics.bwh.harvard.edu/pph2/index.shtml). Ассоциации полиморфных локусов с транскрипционной активностью генов исследовались с использованием данных проекта Genotype-Tissue Expression (http://www.gtexportal.org/) (методика анализа представлены в работе [16]).
Результаты и их обсуждение. При анализе наблюдаемого распределения генотипов по исследуемым 10 SNPs генов MMP1,MMP2, MMP3,MMP8, MMP9 в контрольной группе и в изучаемых группах больных Н.pylori-негативной язвенной болезнью желудка и язвенной болезнью двенадцатиперстной кишки установлено его соответствие теоретически ожидаемому распределению при равновесии HWE (p>0,05). Распространенность минорных аллелей по рассматриваемым 10 SNPs в исследуемых группах больных и контроля превышала 10%.
Выявлены особенности ассоциаций полиморфизма генов матриксных металлопротеиназ с развитием Н.pylori-негативной язвенной болезни желудка и язвенной болезни двенадцатиперстной кишки (таблица 1). С формированием ЯБ Ж ассоциированы полиморфизмы rs3918242 и rs17577 гена MMP9, тогда как с возникновением ЯБ ДПК связан полиморфизм rs679620 гена MMP3. Согласно полученных нами данных, протективное значение для развития ЯБ Ж имеют аллель Т rs3918242 (OR=0,588, 95%СI 0,372-0,929, р=0,022, рperm=0,034), и аллель А rs17577 гена MMP9 (OR=0,542, 95%СI 0,341-0,861, р=0,009, рperm=0,025), а с низким риском формирования ЯБ ДПК связан аллель Т rs679620 гена MMP3 (OR=0,692, 95%СI 0,485-0,987, р=0,041, рperm=0,041). Соответственно, частые аллели вышеуказанных полиморфных локусов будут иметь «рисковое» значение для развития язвенной болезни желудка (аллель С rs3918242 и аллель G rs17577 гена MMP9) и язвенной болезни двенадцатиперстной кишки (аллель C rs679620 гена MMP3).
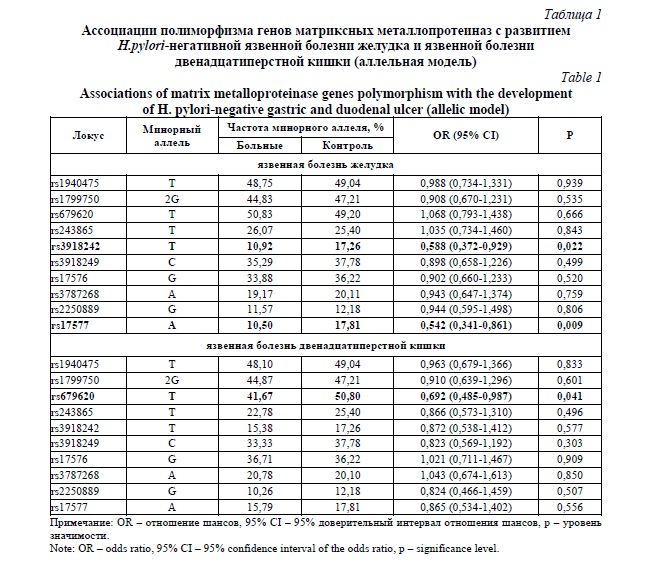
Анализ структуры гаплоблоков изученных шести полиморфных локусов гена MMP9, расположенных на 20 хромосоме (rs3918242, rs3918249, rs17576, rs3787268, rs2250889 и rs17577), показал различия в структуре гаплоблоков как между рассматриваемыми группами больных ЯБ Ж (рисунок 1 А1 и А2) и ЯБ ДПК (рисунок 1 Б1 и Б2), так и между этими группами больных и контрольной группой (рисунок 1 С1 и С2). Так, в контрольной группе с использованием алгоритма «Confidence intervals».
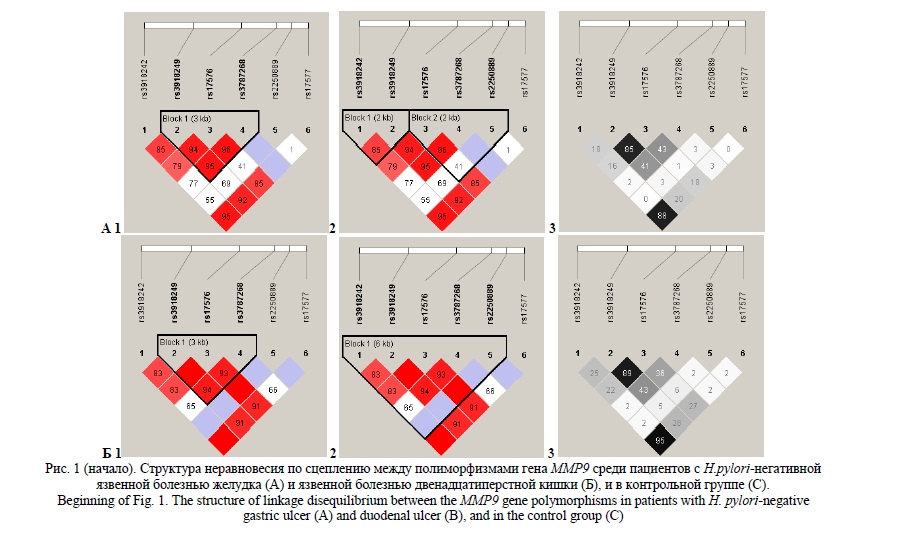

Выявлен один гаплоблок, включаюший два полиморфизма - rs3918242 и rs3918249 (r2=0,34, D’=1,00) (рисунок 1 С1), а с использованием алгоритма «Solid Spine» установлено два гаплоблока, состоящие из трех SNPs (rs3918242, rs3918249 и rs17576; r2=0,31-0,77, D’=0,91-1,00) и двух SNPs (rs3787268, rs2250889; r2=0,01, D’=0,61) соответственно (рисунок 1 С2). В группе больных язвенной болезнью желудка на основе алгоритма «Confidence intervals» определен один гаплоблок, в состав которого входят три полиморфизма - rs3918249, rs17576 и rs3787268 (r2=0,41-0,85, D’=0,94-0,96) (рисунок 1 А1); при использовании алгоритма «Solid Spine» выявлено два гаплоблока, первый из которых включает два SNPs (rs3918242 и rs3918249; r2=0,18, D’=0,85), второй - три SNPs (rs17576, rs3787268 и rs2250889; r2=0,01-0,43, D’=0,41 - 0,96) соответственно (рисунок 1 А2). Среди пациентов с язвенной болезнью двенадцатиперстной кишки как на основе алгоритма «Confidence intervals» так и на основе алгоритма «Solid Spine» зарегистрирован один гаплоблок, но включающий разное количество полиморфизмов: 3 полиморфных локуса - rs3918249, rs17576, rs3787268 (r2=0,43-0,89, D’=0,93-1,00) (по данным алгоритма «Confidence intervals») (рисунок 1 Б1) и 5 полиморфных локусов -rs3918242, rs3918249, rs17576, rs3787268, rs2250889 (r2=0,02-0,89, D’=0,65-1,00) (по данным алгоритма «Solid Spine») (рисунок 1 Б2).
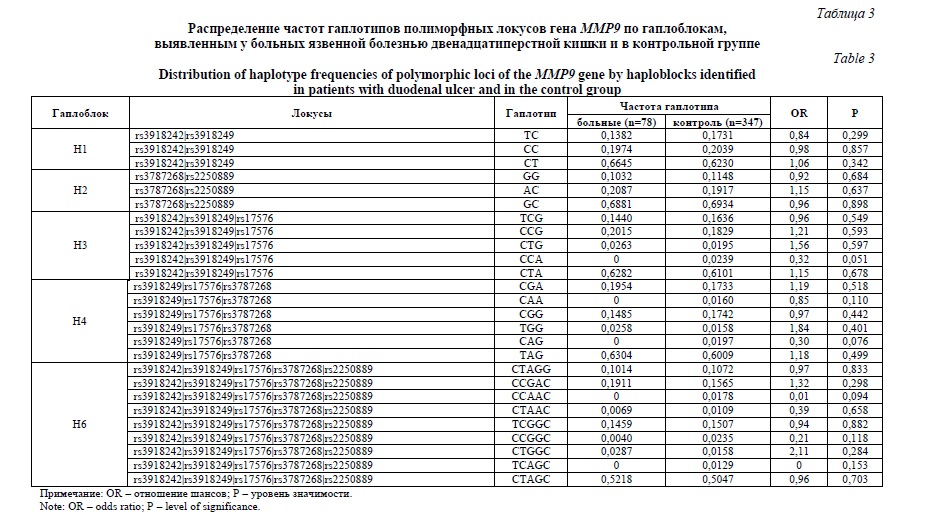
На следующем этапе работы были изучены ассоциации гаплотипов гена MMP9 с развитием ЯБ Ж и ЯБ ДПК в рамках выявленных ранее различных гаплоблоков (рисунок 1). Результаты этого исследования представлены в таблицах 2 и 3. Установлены ассоциации гаплотипа ТC полиморфных локусов rs3918242-rs3918249 (p=0,012, pperm=0,032) гена MMP9 с формированием язвенной болезни желудка (таблица 2). Частота этого гаплотипа в контрольной группе в 1,67 превышает аналогичные показатели больных ЯБ Ж. Данный галотип имеет протективное значение для развития ЯБ Ж (OR=0,56). Ассоциации гаплотипа TCG полиморфных локусов rs3918242-rs3918249-rs17576 гена MMP9 с возникновением язвенной болезни желудка после проведения пермутационного теста оказались статистически не значимыми (OR=0,55, p=0,020, pperm=0,061) (таблица 2). В работе не выявлено ассоциаций гаплотипов рассматриваемых гаплоблоков гена MMP9 с развитием язвенной болезни двенадцатиперстной кишки (таблица 3).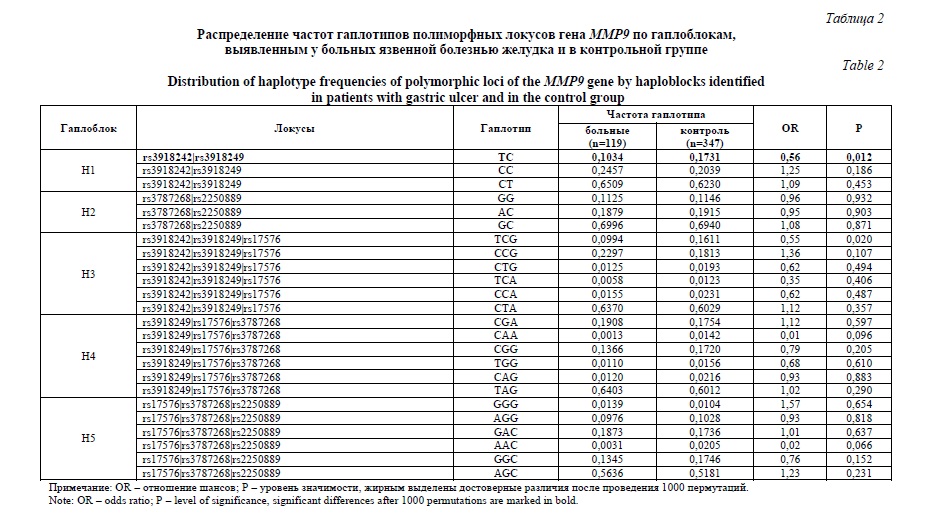
В рамках данного исследования мы оценили биологические механизмы, лежащие в основе выявленных ассоциаций rs3918242, rs17577 и гаплотип ТC полиморфных локусов rs3918242-rs3918249 гена MMP9 с развитием Н.pylori-негативной язвенной болезни желудка и полиморфизм rs679620 гена MMP3 с формированием Н.pylori-негативной язвенной болезни двенадцатиперстной кишки связан. Установлено, что полиморфизм rs679620 является несинонимическим и обусловливает замену аминокислот Lys45Glu в полипептиде MMP3. Согласно базы данных SIFT предикторный потенциал этой аминокислотной замены маркируется как «TOLERATED» (SIFT коэффициент равен 1). Материалы базы данных PolyPhen-2 свидетельствуют о «BENIGN» предикторном классе данной аминокислотной замены (PolyPhen-2 коэффициент составляет 0 при чувствительности 1 и специфичности 0). Так же выявлено, что несинонимичным является и полиморфный локус rs17577 – он детерминирует аминокислотную замену Arg668Gln в белке MMP9. Согласно оценкам предикторного потенциала, представленным в базе SIFT, полиморфизм rs17577 является «TOLERATED» (SIFT коэффициент = 0,647), а материалы базы данных PolyPhen-2 указывают на предикторный класс «BENIGN» этого полиморфизма (PolyPhen-2 коэффициент составляет 0,01 при чувствительности 0,96 и специфичности 0,77).
Полученные нами данные свидетельствуют о важном eQTL значении полиморфизма rs679620 гена MMP3. Согласно базы данных GTExportal аллель С rs679620, связанный с высоким риском формирования ЯБ ДПК (OR=0,692 для аллеля Т rs679620), ассоциирован с более высоким уровнем экспрессии генов MMP1 (β=0,30-0,31 р≤2,3*10-5, pFDR≤0,05) и WTAPP1 (β=0,28, р=4,5*10-9, pFDR≤0,05) в различных органах и тканях и в том числе гена MMP1 в щитовидной железе и культуре клеток фибробластов (рисунок 2 А и Б соответственно). Ассоциированы с уровнем экспрессии различных генов и полиморфные локусы rs3918242 (PLTP, SLC12A5, SNX21) (pFDR≤0,05), rs17577 (SLC12A5, SNX21, SYS1, RPL13P2, DNTTIP1, MMP9, RP11-465L10.10) (pFDR≤0,05) и rs3918249 (CD40, NEURL2, PCIF1, PLTP, RP3-337O18.9, SLC12A5, SNX21, SPATA25, ZNF335, ZSWIM1) (pFDR≤0,05) гена MMP9. Следует отметить, что данные полиморфизмы связаны с транскрипционной активностью генов и в органах пищеварительной системы (пищевод, тонкий кишечник) (рисунок 3).
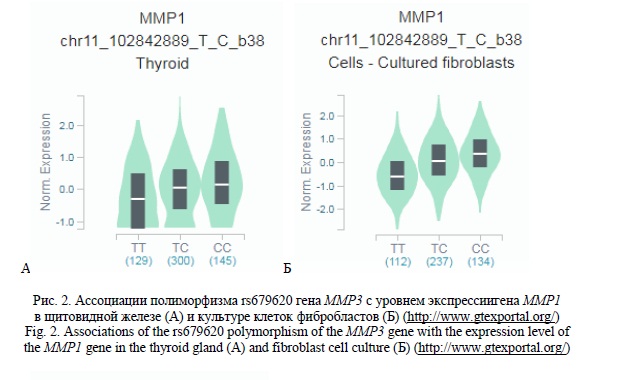
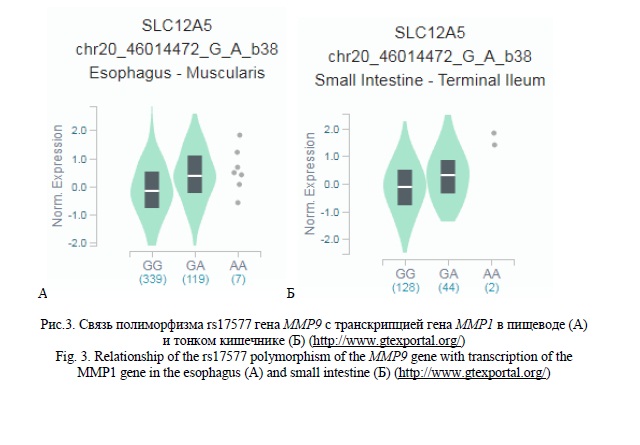
Таким образом, можно заключить, что согласно полученных нами данных, медико-биологической основой ассоциаций полиморфных локусов rs3918242, rs17577 и rs3918249 гена MMP9 с развитием Н.pylori-негативной язвенной болезни желудка и полиморфизма rs679620 гена MMP3 с формированием Н.pylori-негативной язвенной болезни двенадцатиперстной кишки может быть их связь с аминокислотными заменами в кодируемых полипептидах MMP3 (rs679620) и MMP9 (rs17577) и влияние этих полиморфизмов на уровень экспрессии различных генов в разных органах и тканях (все четыре «значимых» для формирования язвенной болезни полиморфных локуса ассоциированы с транскрипционной активностью генов).
Следует отметить, что согласно базы данных HaploReg v4.1 на расстоянии 22kb от полиморфного локуса rs679620 гена MMP3 расположен полиморфизм rs11225434, который сильно сцеплен с ним (r2=0,90, D’=-0,97). В полно-геномном исследовании (GWAS) Cheng Y.C. et al. [17] установлены ассоциации полиморфизма rs11225434 с уровнем экспрессии гена MMP1 (p= 2,07×10−19). Так же в данной работе было показано, что rs11225434 находится в неравновесии по сцеплению (r2=0,34, D’=1,00) с полиморфным локусом rs495366, который согласно результатам проведенного исследования определяет 17,5% изменчивости уровня MMP1 в организме.
Материалы настоящей работы, демонстрирующие связь полиморфизма rs679620 гена MMP3 с риском развития Н.pylori-негативной язвенной болезни двенадцатиперстной кишки согласуются с результатами работы Yeh Y.C. et al. [18]. В этом исследовании делается вывод о том, что полиморфизм rs679620 гена MMP3, но не dupA-статус Н.pylori, может коррелировать с восприимчивостью к язвенной болезни двенадцатиперстной кишки после инфицирования H.pylori у тайваньских женщин. При этом среди Н.pylori инфицированных женщин Тайваня (как и в европейской популяции Центрального Черноземья России) фактором риска развития язвенной болезни двенадцатиперстной кишки является генотип СС (OR=2,4) по сравнению с генотипом ТТ.
Следует отметить, что результаты данного исследования, указывающие на вовлеченность полиморфизма rs679620 гена MMP3 в формирование Н.pylori-негативной язвенной болезни двенадцатиперстной кишки, но не в развитие язвенной болезни желудка отличаются от данных работы Tomita M. et al. [19] в которой показана значимая роль MMP3 в развитии язвенной болезни желудка. Авторы установили, что уровень MMP3 у пациентов с язвенной болезнью желудка был достоверно выше в месте локализации язвы, чем в антральном отделе, и имел достоверную положительную корреляционную связь с TIMP1, IL1β, IL6 и IL8.
Полученные нами результаты о связи полиморфизма матриксной металлопротеиназы 9 (rs3918242, rs17577 и rs3918249) с формированием Н.pylori-негативной язвенной болезни желудка согласуются с результатами работы Li S.L. et al. [20], в которой показана важная роль матриксной металлопротеиназы 9 и тканевого ингибитора металлопротеиназы (TIMP1) при язвенной болезни желудка и хроническом поверхностном гастрите (ХПГ). В данном исследовании на выборках из 63 пациентов с ЯБ Ж и 25 пациентов с ХПГ авторы установили, что уровни MMP9 и TIMP1 в месте локализации язвенного дефекта или в антральном отделе желудка были достоверно выше у пациентов с ЯБ Ж, чем у пациентов с ХПГ. Уровень MMP9 в месте язвы был достоверно выше, чем в антральном отделе у больных ЯБ Ж, и положительно коррелировал с уровнем с TIMP1. Содержание MMP9 было значительно выше у Н.pylori -позитивных, чем у Н.pylori -негативных пациентов с ЯБ Ж и ХПГ. Авторы делают вывод о том, что MMP9 может выполнять важную функцию при формировании и рецидивировании язвенной болезни желудка. Значимую динамику уровня MMP9 в слизистой оболочке желудка при лечении инфекции Н.pylori выявили в работе Kubben FJ et al [21]. Авторы на выборке из 58 пациентов с H. pylori-ассоциированным гастритом, получавшим комбинированную терапию, установили снижение уровня MMP9 при успешной эрадикация Н.pylori, как в антральном отделе, так и в слизистой оболочке тела желудка, по сравнению с таковой до лечения, независимо от применяемой схемы терапии.
Заключение. С развитием Н.pylori-негативной язвенной болезни желудка ассоциированы полиморфные локусы rs3918242 (OR=0,59), rs17577 гена MMP9 (OR=0,54) и гаплотип ТC rs3918242-rs3918249 гена MMP9 (OR=0,56), а с возникновением Н.pylori-негативной язвенной болезни двенадцатиперстной кишки связан полиморфизм rs679620 гена MMP3 (OR=0,69).




















Список литературы