Влияние экологически факторов на заболеваемость опухолями головного мозга и эпилепсией у детей в Белгородской области
Aннотация
В статье изложены данные о заболеваемости опухолями головного мозга, начинающимися с эпилептических приступов в зависимости от экологических факторов в районах и городах Белгородской области. Наблюдались 92 ребенка с опухолями головного мозга из различных районов Белгородской области. У 61 ребенка первым симптомом опухоли головного мозга были эпилептические приступы. Проанализированы возможные причины высокой заболеваемости в отдельных районах области и предложены методы раннего выявления больных с данной патологией.
Ключевые слова: эпилепсия, опухоли головного мозга, Белгородская область, экологические факторы, дети
Целью данной работы является изучение заболеваемости опухолями головного мозга у детей и подростков, начинающимися с эпилептических приступов в зависимости от экологических факторов в районах и городах Белгородской области.
Сведения о точном количестве опухолей головного мозга и распределение их по возрасту и району проживания в Белгородской области необходимы для планирования обеспечения лечебных учреждений врачебными кадрами, медицинским оборудованием и медикаментами.
Вариации по возрасту, полу, времени, месту развития, особенностям клинического течения могут быть ключом для определения этиологических факторов в зависимости от района проживания больного. Это важно, так как по литературным данным частота встречаемости и смертных случаев от первичных опухолей головного мозга возросла во многих странах.
У детей опухоли головного мозга, несмотря на возможность проведения НСГ, КТ и МРТ, диспансерное наблюдение врачами неврологами, встречаются достаточно часто в запущенной стадии, когда риск оперативного вмешательства достаточно высок.
В нашей работе проведен анализ данных отчетов детского нейрохирурга, онколога и заведующего неврологическим отделением ГУЗ «Белгородская детская областная больница».
За последние 2 года в детскую областную больницу поступили 8 детей с опухолями ЦНС в возрасте до 3 лет, из них 5 – в возрасте до 1 года. У всех этих детей злокачественные опухоли больших размеров. Двое детей умерли до операции. Из них 3 – жители г. Белгород; 2 – г. Губкин; 1 – г. Старый Оскол; 2 – из Вейделевского района.
Актуальность темы для Белгородской области объясняется заболеваемостью у детей и подростков области эпилепсией – 5,1 на 1000 населения в возрасте от 0 до 17 лет; опухолями ЦНС – 0,23 на 1000 населения в возрасте от 0 до 17 лет.
Этиология опухолей неизвестна. В 1926 году американские нейрохирурги Бейли и Кушинг сопоставив морфологические и клинические данные своего материала, обнаружили зависимость клинического течения от гистологического типа опухоли. Они дали первое развернутое описание многообразия опухолей нервной системы и систематическую их классификацию. Существует также гипотеза Л.И.Смирнова, Б.С.Хоминского (1954): не только детерминированность, но и экзогенная малигнизация (пример-озлокачествления глиом после операции).
Большинство авторов говорят о факторах риска развития опухолей центральной нервной системы, в частности, головного мозга.
Заболеваемость опухолями головного мозга имеет статистические различия в зависимости от возраста, половой принадлежности, географических особенностей места проживания, социального класса и уровня жизни исследуемой группы населения и целого ряда других внешних факторов [1, 9].
Так, чаще всего опухоли головного мозга встречаются у лиц европейской расы [2, 15].
Опухоли головного мозга могут возникать в любом возрасте. Например, такая опухоль, как медуллобластома, встречается очень часто именно в детском возрасте [5,17].
Единственным установленным фактором риска окружающей среды является радиация. В прежние годы детям, страдавшим дерматомикозом волосистой части головы, вызванным грибковой инфекцией, применялась лучевая терапия в низких дозах. Впоследствии это привело к повышенному риску возникновения опухолей головного мозга. В настоящее время большинство опухолей головного мозга вызывается облучением головы по поводу других видов злокачественных опухолей [9,16].
Нарушения иммунной системы могут быть врожденными, в результате лечения других опухолей, профилактики отторжения пересаженных органов или СПИДа (синдром приобретенного иммунодефицита).
У людей с измененной иммунной системой имеется повышенный риск возникновения лимфом головного и спинного мозга.
Иногда отмечаются множественные случаи опухолей головного и спинного мозга у членов одной семьи [12].Обычно у больных с семейным раковым синдромом возникают множественные опухоли в молодом возрасте.
У левшей заболеваемость опухолями головного мозга снижена, что может быть обусловлено генетическими факторами[10].
Нейрофиброматоз 2 типа является наследуемым заболеванием и ассоциируется с развитием шванном слухового нерва, множественными менингеомами или эпендимомами спинного мозга.
У больных туберозным склерозом могут развиваться гигантоклеточные астроцитомы наряду с доброкачественными опухолями кожи, сердца и почек.
Была проанализирована связь новообразований с генетическими синдромами и пороками развития у детей и доказано, что определенные генетические синдромы сопряжены с более высоким риском возникновения онкозаболеваний, а опухолевой процесс, развившийся на фоне генетической патологии, имеет худший прогноз[4].
Среди причин возникновения опухолей головного мозга у детей, наряду с генетическим фактором, необходимо учитывать экологические факторы, к которому относятся чистота атмосферного воздуха, источников воды, ионизирующая радиация (в том числе природные источники), электромагнитные поля [3,6,7,8].
Не менее значимыми являются антенатальные, интранатальные и постнатальные повреждающие факторы, вирусы, другие инфекционные агенты, перенесенная черепно-мозговая травма и прочие причины [10,13].
Возможно, именно то, что все предположения авторов говорят о факторах риска, а не этиологии как таковой, объясняет множество предположений и их разнообразие, а в ряде случаев (факторы окружающей среды), некоторое несоответствие.
Вероятно, именно работы генетиков, могут определить истинную причину развития опухолей головного мозга, так в настоящее время выделены гены ко многим опухолям: медуллобластома – 61; PNET – 3; глиома – 147; астроцитома – 61.
Как показали многочисленные наблюдения, изменения вследствие наследственно обусловленных или приобретенных при воздействии экзогенных и эндогенных факторов в генетических мутациях могут быть ассоциированы с онкогенезом астроцитом. Так, обнаруженные мутации в 17(17p) хромосоме и, реже, в хромосоме 22(22q)
обнаруживаются во многих клетках астроцитом независимо о степени их озлокачествления [12].
При астроцитарных опухолях переход в глиобластому связывают с нарушением в гене фактора роста эпидермы (EGFR), находящегося в хромосоме 7. В связи с этим было высказано предположение, что мутация в хромосоме 10q может быть причиной стимуляции в гене EGFR в связи с нарушением его регуляции. Также отмечено, что делеция локуса 17p обуславливает повышенную продукцию фосфопротеина, закодированного в гене p53. Рядом авторов [12], показана высокая вероятность повреждения гена p53 при злокачественных глиомах головного мозга.
Экологические особенности области:
Состояние атмосферного воздуха:
Основной вклад в загрязнение атмосферы области вносят: автотранспорт – 58,9 – 75,8%, предприятия горнорудной и металлургической промышленности – 24,4% и производства строительных материалов – 8,4%. Среди городов 58,9% от общих выбросов всех стационарных источников приходится на Старый Оскол, 19,2% – на Губкин и 11,2% – на Белгород, и лишь 1% – на Шебекино, доля остальных населенных пунктов в сумме не превышает 9,7%.
Состояние использования водных ресурсов:
Уровень загрязненности воды в пограничных с Украиной створах на реках Северский Донец, Ворскла, Ворсклица, Оскол и в межобластных створах на реках Потудань и Оскол характеризуется как умеренно загрязненный, относится к 3-му классу чистоты и является неизменным уже на протяжении многих лет.
Обращение с отходами и радиационная обстановка:
Из общего количества образовавшихся отходов 97,9%, или 127,9 млн. т, приходится на горно-металлургический комплекс, а именно: Лебединский Горно-обогатительный комплекс (ГОК), Стойленский ГОК и Оскольский электрометаллургический комбинат.
По-прежнему наибольший вклад в дозу облучения населения области внесли природные источники ионизирующего излучения (80,9%) и медицинские рентгенорадиологические процедуры (19%). На долю всех остальных источников, в том числе последствий аварии на Чернобыльской атомной электростанции (ЧАЭС), приходится менее 0,1% годовой дозы.
Содержание цезия-137, стронция-90 в продуктах питания, включая продукты, произведенные на территории области, подвергшейся радиоактивному загрязнению вследствие аварии на ЧАЭС, не превышают требований СанПиН 2.3.2.1087-01 («Областная программа финансирования природоохранных мероприятий на 2008-2010 годы», губернатор области Е. Савченко, программа утверждена постановлением правительства Белгородской области от 3 сентября 2007 года №198-пп).
Согласно проведенному анализу экологической ситуации в Белгородской области сотрудниками Госсанэпиднадзора совместно с институтом Эрисмана, среди городов области более 50% общих выбросов всех стационарных источников приходятся на Старый Оскол, 17,5% – на Губкин и 7,6% – на областной центр. Доля остальных населённых пунктов в сумме не превышает 11 %. Основной загрязнитель атмосферы по-прежнему автотранспорт, предприятия горнорудной и металлургической промышленности.
Среди городов области самыми загрязненными являются г. Старый Оскол (52%) и Губкин (24% всех выбросов). В районах, примыкающих к карьерам, отвалам, хвостохранилищам, обнаружено загрязнение подземных вод, истощены их запасы на территории более 200 кв. км, а уровень понизился до 200 – 250 мм. Сформировалась зона анормального запыления почв – более 4000 кг\га в год пыли. Концентрация большого количества предприятий на территории, которая характеризуется непосредственной близостью к аномальной геомагнитной зоне, быстрым изменением природного ландшафта и гидрогеологических условий вследствие горных разработок, интенсивным промышленным и гражданским строительством, своеобразием демографической структуры приводит к резкому увеличению техногенной нагрузки на население в радиусе 30-40 км.
В общей структуре смертности за последние годы преобладают причины по болезням системы кровообращения (61.5-62.4%) и по новообразованиям (12-14.5%).
Популяционный канцерогенный риск составляет 2,8 дополнительных случая возникновения новообразований от влияния диоксида хрома и формальдегида.
В частности, динамика индекса здоровья детского населения свидетельствует о снижении уровня общественного здоровья в 2 раза.
В ходе настоящей работы выявлена зависимость сроков постановки диагноза и течения опухолей головного мозга у детей в Белгородской области от семиологии и возраста начала эпилептических приступов, эффективности АЭТ, сопутствующей патологии, наследственности и факторов перинатального риска, а так же в зависимости от зоны проживания в области.
Согласно полученным данным большинство детей с эпилепсией и опухолями проживают в г. Белгород и Белгородском районе – 26,4%; Старооскольском районе – 26,4%; г. Губкин и Губкинском районе – 10%; Алексеевском районе – 8,2 % и Яковлевском районе – 8,2 %.
В нашей работе были выделены две группы детей N1- с опухолями головного мозга, первым симптомом которых были эпилептические приступы и N2 – в клинике опухоли головного мозга у которых симптоматические эпилептические приступы отсутствовали. В исследование вошли 92 пациента в возрасте от 5 месяцев до 18 лет 51(55%) мальчик и 41(45%) девочка с опухолями головного мозга.
В группе N1 28 (46%) больных были в возрасте с 7 до 15 лет; 18 (29,5%) – дети в возрасте с 3 до 7 лет; 8 (13%) – дети до 1 года.
В группе N2 12 (38,7 %) больных были в возрасте с 7 до 15 лет; 11(35,5%) – дети в возрасте с 3 до 7 лет; поровну по 4 (12,9 %) ребенка дети до 1 года и с 1 года до 3 лет.
В первой группе время постановки диагноза опухоль головного мозга от времени начала приступов различно и колеблется от нескольких месяцев до 14 лет. У 24(39,3%) детей диагноз поставлен более чем через 1 год (что не расходится с литературными данными), после появления симптоматики гипертензионного ликворного синдрома и появления изменений на глазном дне. У 8 пациентов впервые приступы возникли в младенческом возрасте, до 1 года. Только у троих детей опухоль головного мозга диагностирована была в течение 1 года, один из них умер от продолженного роста опухоли на фоне проводимого лечения, двое – до операции. У остальных детей проявления опухоли в неврологическом статусе, изменениях глазного дна появились через 7, 10 и более лет.
У 37 (60,7%) пациентов диагноз опухоли был поставлен в течение 1 года.
В группе сравнения (N2) время от первого обращения к неврологу или педиатру до постановки диагноза опухоль головного мозга более 1 года только у 4 детей (12,9%). Среди этих детей: 1 ребенок из социально неблагополучной семьи наблюдался с микроцефалией и врожденной патологией зрения; 1 ребенок с экзофтальмом наблюдался офтальмологом с патологией зрения; 1 – наблюдался у эндокринолога и педиатра с подозрением на несахарный диабет, а так же по поводу прибавки веса, приступов аритмии; 1 наблюдался у педиатра и невролога в районной поликлинике по поводу дисфункции вегетативной нервной системы и получал медикаментозное и физиотерапевтическое лечение в течение 2 лет.
Среди детей с опухолями без эпилепсии 22,6% детей из г. Белгорода и Белгородского района – 22,6%; Шебекинского района – 16%; Старооскольского района – 13%; Яковлевского, Вейделевского и Губкинского районов – по 10% (рис. 1).
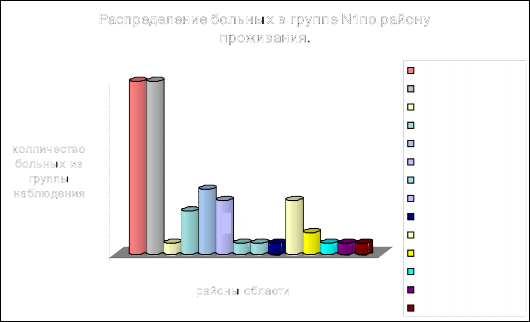
Рис. 1. Количество больных с опухолями головного мозга и эпилепсией
(основная группа – N 1) в отдельных районах Белгородской области
Как видно из рисунка, максимальное количество больных с этой патологией проживает в Белгородском и Старооскольском районах(p ≤ 0,05). Интересно распределение в области заболеваемости детей и подростков с данной патологией выглядит на карте (рис. 2).
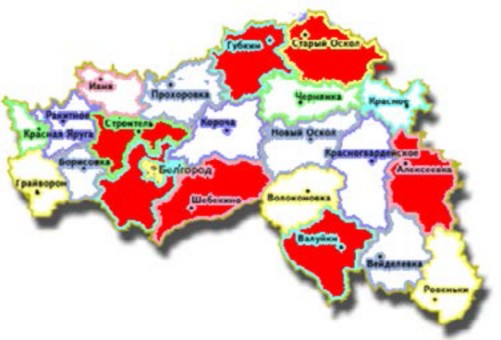
Рис. 2. На рисунке обозначены районы с максимальной
заболеваемостью у детей опухолями и эпилепсией в Белгородской области
Эти данные соответствуют ежегодному анализу заболеваемости эпилепсией и опухолями ЦНС среди детей Белгородской области (рис. 3).
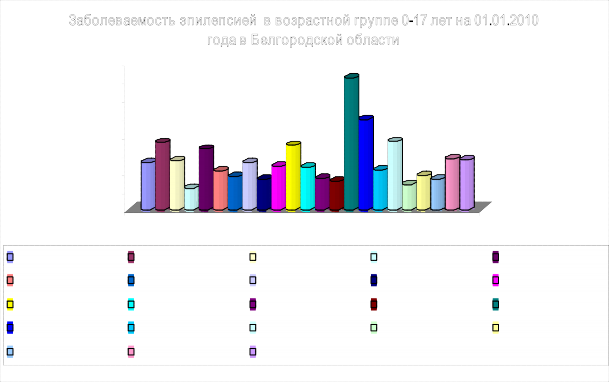
Рис. 3. Заболеваемость эпилепсией (из расчета
на 1000 населения от 0 до17 лет)
Видно преобладание данной патологии в Вейделевском, Краснояружском, Красногвардейском, Губкинском, Ивнянском, Яковлевском, Старооскольском, Белгородском районах и г. Белгород.

Рис. 4. Заболеваемость опухолями ЦНС (из расчета
на 1000 населения от 0 до17 лет)
Видно четкое преобладание данной патологии в Старооскольском (и городе Старый Оскол), Белгородском (и городе Белгород), Губкинском и Шебекинском районах.
Более наглядно выглядят полученные данные на карте области
(рис. 5; рис. 6).
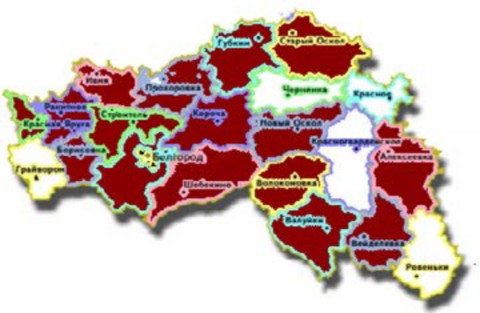
Рис. 5. Преобладание заболеваемости эпилепсией в районах Белгородской области
На рисунке отмечены районы, в которых заболеваемость эпилепсией выше 3,5 на 1000 населения.
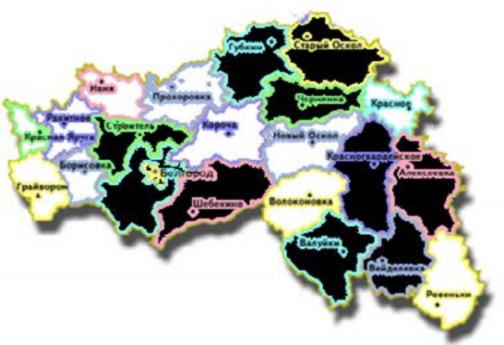
Рис. 6. Преобладание заболеваемости опухолями ЦНС в районах Белгородской области
На рис. 6 отмечены районы, в которых выявлены опухоли ЦНС у детей и подростков (возраст 0-17 лет).
Сопоставляя карты, мы видим, что районы максимальной заболеваемости эпилепсией и опухолями ЦНС и территории распределения больных в нашем исследовании пересекаются.
Анализируя приведенные выше диаграммы можно предположить, что вероятность опухоли у ребенка с эпилепсией выше в Валуйском, Белгородском, Алекссевском, Яковлевском, Губкинском, Старооскольском и Вейделевском районах.
Причиной такого распределения патологии нервной системы могут быть экологические особенности районов Белгородской области, о чем было сказано в анализе литературы.
Таким образом, нами установлено, что зонами высокого риска заболевания опухолями головного мозга у детей являются Валуйский, Белгородский, Алексеевский, Яковлевский, Губкинский и Старооскольский районы Белгородской области. Дети с эпилептическими приступами из этих районов должны профилактически осматриваться неврологом не реже 1 раза в 6 месяцев с обязательным проведением инструментальных обследований: ЭЭГ видеомониторирования с включением сна и, при необходимости нейровизуализацию, даже без клинических проявлений опухоли головного мозга.




















Список литературы
1. Артарян А.А. Опухоли мозжечка. М 1979.
2. Белоглазов Т. А., Берснев В. П. Значимость ЭЭГ при супратенториальных опухолях у детей. Материалы III съезда нейрохирургов России, 2002. С. 549-550.
3. Евдокимов В.И., Поляков А.Д. Динамика формирования техногенной нагрузки и гигиенический прогноз развития железорудного региона // Материалы научно-практических конгрессов 4 Всеросийского форума «Здоровье нации – основа процветания России; Том.1, раздел «Санитарно-эпидемиологическое благополучие Российской Федерации». - М.,2008. С. 51-52.
4. Лунякова М. А., Безнощенко А. Г., Дронова С. Н. Сочетание злокачественных новообразований и генетических синдромов и пороков развития у детей. Настоящее и будущее детской онкологии. Москва, 2008.
С. 114-115.
5. Материалы 4-го съезда детских онкологов России с международным участием» Настоящее и будущее детской онкологии». Москва, 2008.
6. Поляков А.Д. Санитарное состояние почвы территорий с развитым горнодобывающим комплексом // Санитарный врач, 2008. №11.- С. 28-29.
7. Поляков А.Д., Катаева Е.В. Решение проблемы утилизации промышленных отходов на Оскольском электрометаллургическом комбинате // Региональные проблемы сохранения здоровья населения / Сб. науч. тр. – Л., 2007. С.80-83.
8. Поляков А.Д., Оглезнева Е.Е. Организация социально-гигиенического мониторинга в Старооскольском промышленном районе // ЗНиСО. 2008. №2. С.36-39 .
9. Розуменко В.Д. Эпидемиология опухолей головного мозга и факторы риска их развития, Киев, 2009.
10. Скоромец Т.А. Применение кортексина в остром периоде черепно-мозговой травмы. // Тез. докл. XI конгресса «Человек и лекарство». М., 2004. С. 342.
11. Суворова Е. Г. Исследование мутаций в пятом-восьмом экзонах гена р53 при новообразованиях головного мозга у детей. Настоящее и будущее детской онкологии. Москва, 2008.С. 152-153.
12. Тарасова Е. М., Холодов Б. В., Белохвостов А. С., Суворова Е. Г., Притыко А. Г. Клиническое значение определенных мутаций некоторых генов у детей с глиальными опухолями головного мозга. Настоящее и будущее детской онкологии. Москва, 2008.С. 154-155.
13. Шабалов Н.П., Скоромец А.А., Шумилина А.П. и др. Ноотропные и нейропротекторные препараты в детской неврологической практике // Вестник Российской Военно-медицинской академии. 2001. № 1(5). С. 24-29.
14. Aicardi J. Diseases of the Nervous System in Childhood. Cambridge: University Press 1998; 1-100.
15. Cohen B. H., Packer R. J., Siegel K. R., Rorke L. B., et al. Brain tumors in children under 2 years: treatment, survival fnd long-term prognosis. Pediatr Neurosurg 1993; 19: 171-179.
16. Edward C. Halperin. M.D., Louis S. Conctine, M. D., Nancy J. Tarbell, M. D., Larry E. Kun, M. D. Pediatric Radioation Oncology, 1999.
17. Fitz C., Rao K. Primary tumors in children. Cranial computed tomography. Eds. S. Lee, K. Rao. New York 1882; 295-343.
18. Menkes J. Textbook of Child Neurology 1997; 827.
19. Plowman P. N., Pinkerton C. R. Paediatric Oncology. Clinical practice and controversies. Chapman & Hall Medical. 1992.
20. Riccardo Riccardi, Общие принципы диагностики и лечения солидных опухолей у детей. Европейская школа детской онкологии. Москва, 2006. С 181-207.