Полиморфизм генов, ассоциированных с возрастом менархе, и риск формирования осложнений беременности у женщин Центрально-Черноземного региона России
Aннотация
Актуальность: Наиболее частыми осложнениями беременности, связанными с метаболическими и гемодинамическими расстройствами в системе «мать-плацента-плод», являются плацентарная недостаточность и преэклампсия. Преэклампсия является одной из основных причин материнской смертности и перинатальных смертей. Цель исследования: Изучить роль полиморфизма генов-кандидатов менархе с риском развития преэклампсии у женщин Центрально-Черноземного региона России. Материалы и методы:В выборку для исследования вошли 997 женщин: 366 беременных с преэклампсией и 631 женщин группы контроля. Для исследования были отобраны полиморфные локусы генов, связанных с менархе (6 SNPs): рецептор лютеинизирующего гормона / хорионического гонадотропина (rs7579411 и rs4953616 LHCGR), рецептор фолликулостимулирующего гормона (rs6732220 и rs4953655 FSHR) альфа-рецептор эстрогена (rs3020394 и rs1884051 ESR1). Генотипирование образцов ДНК было выполнено с использованием метода MALDI и масс-спектрометра MassARRAY Analyzer 4 (“Seqeunom”, США). Ассоциации SNPs генов-кандидатов c преэклампсией оценивали при помощи логистической (лог-линейной) регрессии согласно аддитивной, рецессивной и доминантной моделей, с поправкой на ковариаты. Для оценки направленности ассоциаций SNPs с преэклампсией использовался показатель отношения шансов (ОR) и его 95% доверительный интервал (95%CI). Результаты:Установлено, что аллель G rs3020394 ESR1 ассоциирован с развитием преэклампсии в рамках рецессивной модели (OR=1,74, 95%Сl 1,06-2,85, р=0,029). Выявленные ассоциации данного SNP могут быть связаны с его регуляторным значением: rs3020394 ESR1 локализован в сайте модифицированных гистонов в областях энхансеров и в ДНКаза-гиперчувствительном сайте. Заключение: Аллель G rs3020394 ESR1 связан с повышенным риском развития преэклампсии у женщин Центрально-Черноземного региона России (OR=1,74).
Вопросы, связанные с репродуктивным здоровьем населения продолжают оставаться в центре внимания отечественных и зарубежных ученых [1-5].
Наиболее частыми осложнениями беременности, связанными с метаболическими и гемодинамическими расстройствами в системе «мать-плацента-плод», являются плацентарная недостаточность и преэклампсия (ПЭ) [6, 7].
Как свидетельствуют литературные данные, частота встречаемости преэклампсии во всем мире составляет 2-8 % [8-10]. ПЭ является одной из основных причин материнской смертности и перинатальных смертей [11, 12]. При развитии тяжелой преэклампсии и эклампсии существенно повышается риск развития различных осложнений (отслойка плаценты, массивные акушерские кровотечения, ДВС-синдром, HELLP-синдром, острая почечная и печеночная недостаточность и др.) [13]. В последующей жизни у этих женщин значительно чаще регистрируются артериальная гипертензия, ишемическая болезнь сердца, инсульт [14].
Согласно материалам некоторых исследований, одним из факторов риска развития осложнений беременности может являться возраст менархе [15, 16]. Возраст появления первых месячных, характеризуя функционирование гипоталамо-гипофизарно-яичниковой системы в организме женщины [17], является одним из ключевых показателей как его пубертатного этапа развития [18] так и важным маркером фертильности женщины и возможных проблем с ее здоровьем в дальнейшей жизни [19, 20]. Обращает на себя внимание факт того, что, несмотря на очевидную связь возраста менархе с ПЭ, исследований, направленных на изучение роли полиморфизма генов-кандидатов менархе в формировании осложнений беременности до настоящего времени не проведено как в России, так и в мире.
Цель исследования. Изучить роль полиморфизма генов-кандидатов менархе с риском развития преэклампсии у женщин Центрально-Черноземного региона России.
Материалы и методы исследования. Выборка для исследования была сформирована на базе профильных отделений стационара перинатального центра Белгородской областной клинической больницы. В группу исследования вошли женщины с преэклампсией и женщины контрольной группы (с физиологическим течением беременности), давшие свое информированное согласие на участие в данной исследовательской работе и соответствующие ряду критериев: русский этнос, место рождения и проживания – регион Центрального Черноземья России. Основаниями для исключения женщин из исследовательской выборки были отказ от участия в данной работе, наличие родства между ними различной степени, выявление тяжелых хронических заболеваний, проводящих к декомпенсации, нерусский этнос и иные (нежели Центральное Черноземье России) места рождения и/или проживания. Клиническое, клинико-лабораторное, клинико-инструментальное обследование беременных, верификация диагноза преэклампсии (или её отсутствие), проводилось сертифицированными врачами профильных отделений перинатального центра. Таким образом, в выборку для исследования вошли 997 женщин: 366 беременных с преэклампсией (средний возраст = 27,32 ± 5,17 лет) и 631 женщин группы контроля (средний возраст = 26,57 ± 4,94 лет).
Для исследования были отобраны полиморфные локусы генов, связанных с менархе [20]. При отборе SNPs учитывались следующие критерии: расположение в регуляторных последовательностях (regSNPs); связь с экспрессией генов (eSNP). Регуляторный потенциал и вовлеченность в пути регуляции транскрипции генов SNPs (regSNP и eSNP соответственно) оценивались с использованием онлайн портала HaploReg (версия 4.1) [21]. Для исследования было отобрано 6 SNPs трех генов: рецептор лютеинизирующего гормона / хорионического гонадотропина (rs7579411 и rs4953616 LHCGR), рецептор фолликулостимулирующего гормона (rs6732220 и rs4953655 FSHR) альфа-рецептор эстрогена (rs3020394 и rs1884051 ESR1),
Генотипирование образцов ДНК было выполнено в Центре коллективного пользования «Медицинская геномика» Томского национального исследовательского медицинского центра РАН на базе НИИ медицинской генетики (использовался метод MALDI и масс-спектрометр MassARRAY Analyzer 4 (“Seqeunom”, США).
В изучаемых выборках беременных для SNPs генов-кандидатов менархе с помощью программы gPLINK v2.050 [22] вычислены параметры наблюдаемой и ожидаемой гетерозиготности (Ho и He, соответственно), определены частоты минорных аллельных вариантов, получены данные о наблюдаемом и ожидаемом распределении генотипов и их соответствии закону Харди-Вайнберга. Ассоциации SNPs генов-кандидатов c преэклампсией оценивали при помощи логистической (лог-линейной) регрессии согласно аддитивной, рецессивной и доминантной моделей, с поправкой на ковариаты. Для оценки направленности ассоциаций SNPs с осложнениями беременности использовался показатель отношения шансов (ОR) и его 95% доверительный интервал (95%CI). Анализ ассоциаций осуществлялся с помощью программы gPLINK v2.050 [22]. Конструирование гаплоблоков на основе алгоритма «Confidence intervals» (при D’>0,8) и анализ ассоциаций гаплотипов с ПЭ методами логистической регрессии осуществлялись с помощью gPLINK v2.050 [22].
Была изучена связь изученных полиморфных локусов с несинонимическими заменами (при помощи онлайн-ресурсов SIFT, PolyPhen-2), эпигенетическими эффектами (HaploReg (v4.1)), экспрессией (Blood eQTL browser, GTEx portal) и альтернативным сплайсингом генов (GTEx portal). Также оценивались функциональные эффекты SNPs, сильно сцепленных с изученными полиморфными локусами. Данные по сильно сцепленным SNPs получены с использованием портала HaploReg (версия 4.1) [21].
Результаты и их обсуждение. Проведено изучение распределения SNPs генов кандидатов-менархе у 366 беременных с преэклампсией и 631 женщин контрольной группы (таблица 1). Наблюдаемое распределение генотипов по всем рассматриваемым SNPs соответствовало ожидаемому при равновесии Харди-Вайнберга. Ассоциации полиморфизма генов-кандидатов менархе с развитием преэклампсии представлены в таблице 2. Установлено, что аллель G rs3020394 ESR1 ассоциирован с развитием преэклампсии в рамках рецессивной модели (OR=1,74, 95%Сl 1,06-2,85, р=0,029). В рамках аддитивной и доминантной моделей результаты оказались статистически незначимы (OR=1,20, 95%Сl 0,96-1,51, р=0,108 и OR=1,13, 95%Сl 0,84-1,52, р=0,406, соответственно).
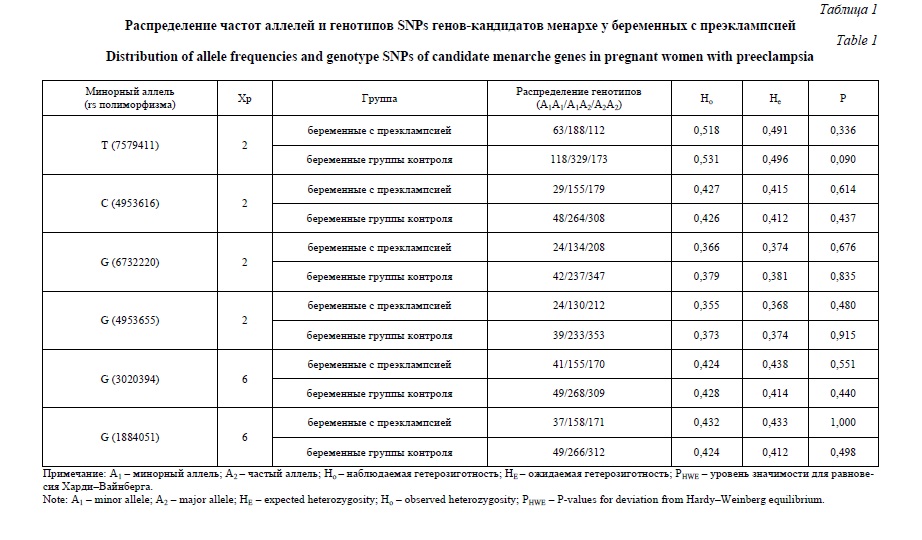
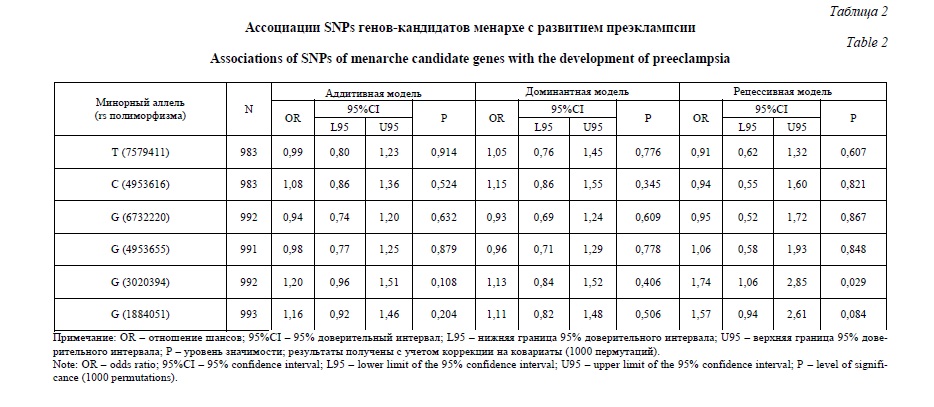
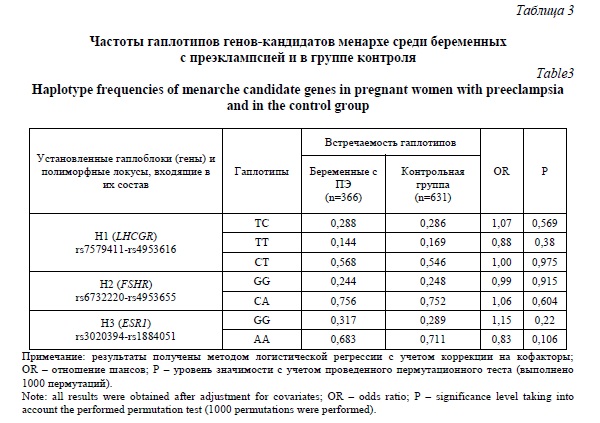
На основе алгоритма «Confidence intervals» (при D’>0,8) выявлены 3 гаплоблока по изучаемым SNPs. Гаплоблок H1 включает rs3020394 и rs1884051 ESR1, гаплоблок H2 – rs6732220 и rs4953655 FSHR и в состав гаплоблока H3 входят rs7579411 и rs4953616 LHCGR. При анализе ассоциаций гаплотипов в рамках выявленных гаплоблоков с развитием ПЭ статистически значимых различий выявлено не было (таблица 3).
Оценка функционального значения rs3020394 ESR1, ассоциированного с повышенным риском развития преэклампсии, показала, что данный полиморфный маркер имеет регуляторное значение (результаты получены с использованием онлайн-ресурса HaploReg (v4.1)). Данный SNP локализован в сайте модифицированных гистонов в областях энхансеров в 6 тканях, в ДНКаза-гиперчувствительном сайте в 1 ткани. Помимо этого изученный в данной работе rs1884051 и дополнительно 11 SNPs, находящиеся в неравновесии по сцеплению с rs3020394 ESR1, имеют важное регуляторное значение: находятся в сайте модифицированных гистонов в областях энхансеров (1-8 тканей), в сайтах связывания с ДНКазой (1-7 тканей), области регуляторных паттернов (TF-связывающие домены), являющихся сайтами связывания с факторами транскрипции (2-13 факторов).
Ген альфа-рецептора эстрогена кодирует одноименный рецептор, являющийся фактором транскрипции, активируемым лигандом. Кодируемый белок содержит N-концевой лиганд-независимый домен трансактивации, центральный ДНК-связывающий домен, шарнирный домен и C-концевой лиганд-зависимый домен трансактивации. Данный рецептор локализуется в ядре, где может образовывать гомо- или гетеродимеры с бета-рецептором эстрогена. Белок, кодируемый этим геном, регулирует транскрипцию многих индуцируемых эстрогенами генов, которые связаны с процессами роста, метаболизма, репродуктивной функции организма (половое развитие, беременность и др.) (http://www.genecards.org). ESR1 экспрессируется преимущественно в яичниках, матке, семенниках и плаценте [23] и опосредует биологические эффекты эстрогенов в данных тканях-мишенях. Поскольку трофобласт является основным источником плацентарных гормонов, экспрессия ESR1 клетками трофобласта может участвовать в стимуляции выработки плацентарных эстрогенов [24]. Так в исследовании Yin et al. [24] было показано, что экспрессия ESR1 значительно повышается при беременности, осложненной развитием преэклампсии
В нашей работе впервые были установлены ассоциации rs3020394 ESR1 с формированием преэклампсии. Другие ассоциативные исследования связаны с изучением роли данного SNP в формировании гиперплазии эндометрия [25], возраста менархе [26].
Заключение. Аллель G rs3020394 ESR1 ассоциирован с повышенным риском развития преэклампсии у женщин Центрально-Черноземного региона России (OR=1,74). Выявленные ассоциации данного SNP могут быть связаны с его регуляторным значением: rs3020394 ESR1 локализован в сайте модифицированных гистонов в областях энхансеров и в ДНКаза-гиперчувствительном сайте.
Информация о финансировании
Работа выполнена при финансовой поддержке гранта Президента Российской Федерации для ведущих научных школ Российской Федерации (проект НШ-2609.2020.7).
Конфликт интересов
Автор заявляет об отсутствии конфликта интересов.




















Список литературы