Фармакологическая эффективность комбинированных глазных лекарственных пленок на основе левофлоксацина и декспантенола, а также дексаметазона и декспантенола при лечении инфицированных ожогов роговицы
Aннотация
Актуальность: При лечении инфицированных ожогов роговицы часть пациентов не способна соблюдать график частых инстилляций лекарственных препаратов, что влечет за собой стойкое необратимое снижение остроты зрения из-за формирования помутнений роговицы. Цель исследования: Повышение эффективности лечения инфицированных ожогов роговицы с использованием комбинированных глазных лекарственных пленок на основе левофлоксацина и декспантенола, а также дексаметазона и декспантенола. Материалы и методы: Спустя 1 час после формирования стандартного инфицированного ожога роговицы в группе сравнения проводили лечение по классической методике с использованием инстилляций, а в экспериментальной группе проводили терапию с использованием комбинированных глазных лекарственных пленок на основе левофлоксацина и декспантенола, а также дексаметазона и декспантенола. Фиксировалась площадь дефекта эпителия роговицы. Морфологическое исследование с окраской гематоксилин-эозином проводили по стандартной методике на различных сроках наблюдения. Результаты: Зафиксирована выраженная клеточная реакция уже спустя 1 час после формирования стандартного инфицированного ожога роговицы. Площадь дефекта эпителия роговицы уменьшалась быстрее в группе с лечением с использованием комбинированных глазных лекарственных пленок. Толщина наружного эпителия роговицы, а также количество клеток в его слоях нормализовалось на 3 сутки в экспериментальной группе, а в группе сравнения с лечением по стандартной методике на 5 сутки эксперимента. При исследовании толщины эндотелия роговицы не было зафиксировано статистически значимых отличий от нормальной роговицы. Заключение: При лечении стандартного инфицированного ожога роговицы применение комбинированных глазных лекарственных пленок позволяет сократить процесс морфологического восстановления роговицы до 3 суток, в сравнении с лечением с использованием инстилляций, где восстановление роговицы к показателям интактного глаза наступает на 5 сутки.
Ключевые слова: ожог роговицы, глазные лекарственные пленки, левофлоксацин, дексаметазон, декспантенол
Введение. На данный момент по данным ВОЗ в мире по меньшей мере 2,2 миллиарда человек имеют нарушения зрения или слепоту, из которых более 11,9 миллионов человек во всем мире имеют умеренное или тяжелое необратимое снижение остроты зрения, которое можно было бы предотвратить [1, 2]. Количество населения, страдающего слепотой вследствие помутнения роговицы в мире к 2015 г. составило 4,47% [3, 4]. Наиболее распространенным микроорганизмом, вызывающим острую инфекцию переднего отрезка глаза, является Staphylococcus aureus (55%) [5-8]. Необратимое стойкое снижение остроты зрения влечет за собой инвалидизацию трудоспособного населения, снижение качества жизни, существенные экономические потери государства (как прямые, так и косвенные) [9, 10]. К причинам, приводящим к нарушению прозрачности роговицы относят бактериальный и вирусный кератит ожоги, дистрофии роговицы, гнойные язвы, травматические эрозии, последствия травм и другие причины [11-13].
При отсутствии своевременно начатого лечения инфекционного заболевания, процесс в роговице усугубляется и способствует образованию обширных дефектов роговицы или инфильтратов. Несвоевременность или неполноценное лечение, а также его отсутствие может привести к стойкому снижению прозрачности роговицы или ее васкуляризации [14, 15]. В связи с этим актуальным является исследование фармакологической эффективности комбинированных глазных лекарственных пленок, которые позволяют эффективно лечить инфицированные ожоги роговицы с низкой кратностью использования (1 раз в сутки).
Цель исследования. Повышение эффективности лечения инфицированных ожогов роговицы с использованием комбинированных глазных лекарственных пленок на основе левофлоксацина и декспантенола, а также дексаметазона и декспантенола.
Материалы и методы исследования. Исследования были выполнены на половозрелых лабораторных кроликах мужского пола породы шиншилла массой 3,0-3,5 кг. В каждую экспериментальную группу входило по 35 кроликов (70 глаз). Лабораторные кролики являются стандартной тест-системой в опытах по изучению специфической активности офтальмологических препаратов. Животные содержались в стандартных условиях в соответствии с санитарно-эпидемиологическими требованиями к устройству, оборудованию и содержанию экспериментально-биологических клиник. Уход и содержание экспериментальных животных проводился в соответствии с стандартами, описанными Ассоциацией исследований в области зрения и офтальмологии [16].
Перед введением в эксперимент все животные находились на 14-дневном карантине в экспериментально-биологической клинике Курского государственного медицинского университета. Во время этого периода осуществлялся ежедневный осмотр и визуальный контроль потребления корма и воды. Животных с отклонениями в период карантина не зарегистрировано. Перед началом исследования все животные, прошедшие карантин, были включены в эксперимент и распределены на группы, которые формировали случайным образом, отклонение массы тела животных от среднего значения допускалось не более чем на 10%.
С целью формирования стандартного инфицированного ожога роговицы в условиях местной анестезии после двукратной инстилляции Oxybuprocaine 0,4% формировали стандартный ожог роговицы, затем в конъюнктивальный мешок вносилась взвесь микроорганизмов в количестве 1 млн. колоний Staphylococcus aureus.
В группе сравнения спустя 1 час после формирования инфицированного ожога роговицы проводили инстилляции левофлоксацина 0,5% 4 раза в сутки и декспантенола 5% 6 раз в сутки. После фиксации полной эпителизации дефекта эпителия роговицы применяли инстилляции дексаметазона 0,1% 3 раза в сутки и декспантенола 5% 4 раз в сутки. В экспериментальной группе спустя 1 час после формирования инфицированного ожога роговицы использовали комбинированные глазные лекарственные пленки на основе левофлоксацина 1,5 мг и декспантенола 15 мг. После завершения процесса эпителизации роговицы применяли комбинированные глазные лекарственные пленки на основе дексаметазона 0,5 мг и декспантенола 15 мг, общая масса пленок 30 мг. Суточные дозы препаратов рассчитаны в соответствии с рекомендациями по лечению ожогов роговицы Американской академии офтальмологии и других [17-20].
Методика определения площади дефекта роговицы
С целью визуализации площади дефекта производилась окраска 1% раствором флуоресцеина натрия непосредственно после формирования инфицированного ожога роговицы, а также через 1 час, спустя 1, 2, 3, 5, 7 и 14 суток после формирования стандартного инфицированного ожога роговицы. Площадь дефекта фиксировалась фоторегистрацией с созданием макрофото с помощью фотокамеры в синем свете (длина волны 465 нм) в темном помещении.
Морфологическое исследование роговицы
По окончании эксперимента животных выводили из опыта путем передозировки хлоралгидратом при внутривенном введении. Морфологическое исследование роговицы с окраской гематоксилин-эозином проводили по стандартной методике через 1 час, а также 1, 2, 3, 5, 7, 14 суток с момента начала эксперимента. Исследована толщина роговицы, плоского неороговевающего эпителия и эндотелия роговицы (мкм), подсчитано количество клеток в базальном, шиповатом и плоском слоях наружного эпителия и эндотелия роговицы (шт), а также оценена площадь их ядер (мкм2). Изучение микропрепаратов производили с помощью светового лабораторного микроскопа Levenhuk D320L ×80, ×320 и ×800 с фоторегистрацией.
Обработка данных
Статистическую обработку результатов исследования проводили путем вычисления значений среднего арифметического (M), среднего квадратического отклонения (δ), среднеквадратической (стандартной) ошибки среднего арифметического (m). После определения показателей описательной статистики (среднее арифметическое, медиана, мода) и обнаружении существенных отклонений от кривой Гауссова распределения, в качестве основной методики определения уровня статистической значимости отличий использовали определение границ доверительного интервала (t) при допустимом для экспериментальных медико-биологических исследований уровне с вероятностью 95% (p≤0,05).
Результаты и их обсуждение. В ходе проведения эксперимента общее состояния животных было удовлетворительным, температура тела не повышалась, летальных исходов зафиксировано не было. По результатам проведенного эксперимента было выявлено, что непосредственно после нанесения создания стандартного ожога роговицы и внесения микроорганизмов в конъюнктивальный мешок площадь дефекта во всех экспериментальных группах не имела статистически значимых отличий между собой. При окраске флуоресцеином натрия площадь дефекта составила около 150 мм2. Спустя 1 час после нанесения травмы в обоих экспериментальных группах площадь дефекта снизилась на 6,6%, что свидетельствует о самоограничении процесса.
Формирование стандартного инфицированного ожога роговицы влечет за собой формирование отека в течение 1 час после травмирования. Толщина роговицы увеличилась на 23,1% в сравнении с интактной роговицей. При проведении морфологического исследования не было зафиксировано статистически значимых различий между группами в толщине роговицы. Спустя одни час после формирования ожога и инфицирования резкое утолщение многослойного плоского неороговевающего эпителия на 61,9±0,1% в обоих исследуемых группах в сравнении с интактной роговицей за счет формирования выраженного отека. Спустя 1 час после формирования стандартного инфицированного ожога роговицы зафиксирована клеточная реакция в обоих исследуемых группах. В базальном слое наружного эпителия роговицы зафиксировано увеличение количества клеток на 7,76±0,81% в сравнении с аналогичным показателем интактного глаза кроликов (рисунок 1). В шиповатом слое наружного эпителия роговицы количество клеток возросло на 11,68±0,52%. В плоском слое плоского неороговевающего эпителия роговицы количество клеток уменьшилось на 1,7±0,91% в обоих исследуемых группах в сравнении с не травмированной роговицей. Начата терапия первой волны.
Спустя 1 сутки после начала эксперимента зафиксирована динамика снижения площади эпителиального дефекта роговицы, однако, скорость изменений была различна. В группе сравнения, где лечение проводили с использованием левофлоксацина и декспантенола в виде инстилляций площадь дефекта уменьшилась на 36,56% в сравнении с исходной. В экспериментальной группе с лечением с использованием комбинированных глазных лекарственных пленок на основе левофлоксацина 1,5 мг и декспантенола 15 мг выявлено снижение площади дефекта эпителия роговицы на 50,62% и она составила 74,16±4,821 мм2. В группе сравнения толщина роговицы составила 275,20±23,930 мкм. В экспериментальной группе толщина роговицы составила 282,36±24,553 мкм.
Спустя 1 сутки эксперимента в обоих исследуемых группах прослеживалась динамика снижения толщины поверхностного эпителия роговицы. В группе сравнения с лечением в виде инстилляций левофлоксацина и декспантенола толщина эпителия составила 26,93±2,341 мкм. В экспериментальной группе с лечением с использованием комбинированных глазных лекарственных пленок на основе левофлоксацина 1,5 мг и декспантенола 15 мг толщина плоского неороговевающего эпителия роговицы составила 26,25±2,283 мкм. Зафиксирована выраженная клеточная пролиферация с наибольшим проявлением в базальном слое эпителия роговицы. В базальном слое зафиксировано увеличение количества клеток на 30,76±0,71% во всех экспериментальных группах в сравнении с показателем интактной роговицы кроликов. В шиповатом слое поверхностного эпителия роговицы зафиксировано увеличение количества клеток на 23,02±3,59% в сравнении с интактной роговицей. В плоском слое плоского неороговевающего эпителия роговицы произошло увеличение количества клеток на 28,15±5,99% в сравнении с интактной роговицей. Между группами не зафиксировано статистически значимых отличий.
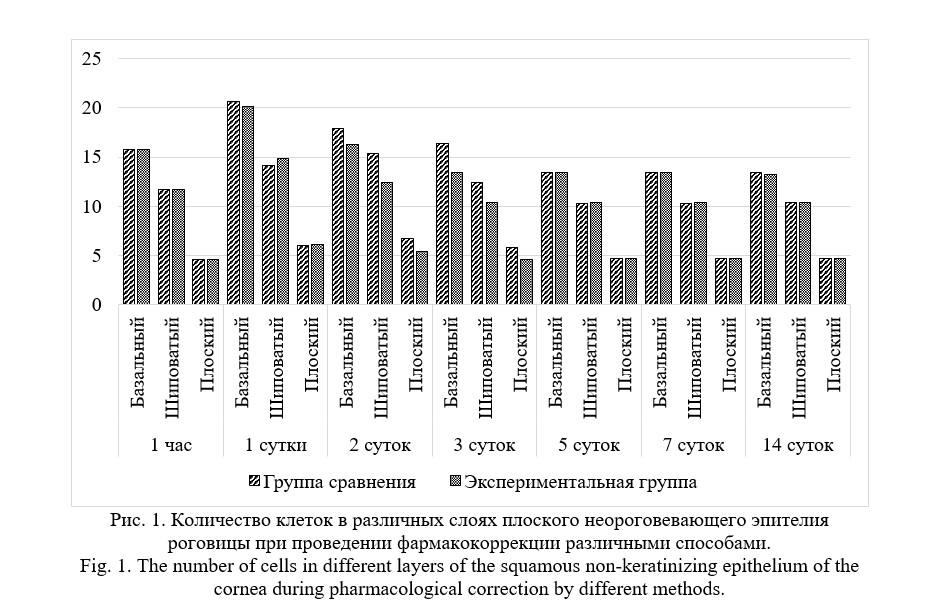
На 2 сутки эксперимента сохранялась динамика снижения площади дефекта эпителия роговицы. В группе сравнения площадь дефекта уменьшилась в 2,67 раза и составила 56,34±3,802 мм2. В экспериментальной группе с лечением с использованием комбинированных глазных лекарственных пленок на основе левофлоксацина 1,5 мг и декспантенола 15 мг площадь дефекта эпителия роговицы уменьшилась в 3,94 раза в сравнении с исходным показателем и составила 38,14±2,654 мм2, при этом зафиксированы статистически значимые отличия от группы сравнения (p≤0.05).
При морфологическом исследовании толщины роговицы зафиксировано её увеличение в различной степени в обоих исследуемых группах. В группе сравнения толщина роговицы увеличилась на 10,5%. В экспериментальной группе с лечением с использованием комбинированных глазных лекарственных пленок на основе левофлоксацина 1,5 мг и декспантенола 15 мг зафиксировано большее увеличение толщины роговицы в сравнении с группой сравнения. Толщина роговицы возросла на 12,2%.
На вторые сутки наблюдения в обоих исследуемых группах продолжала прослеживаться динамка уменьшения толщины наружного неороговевающего эпителия роговицы. В группе сравнения с лечением в виде инстилляций левофлоксацина и декспантенола толщина эпителия уменьшилась на 12,4%. В экспериментальной группе с лечением с использованием комбинированных глазных лекарственных пленок произошло уменьшение толщины наружного эпителия роговицы на 17,5%. Между обоими исследуемыми группами зафиксировано наличие статистически значимых отличий (p≤0.05).
В группе сравнения с лечением в виде инстилляций левофлоксацина и дексаметазона количество клеток в базальном слое составило 18,37±0,49 в стандартном поле зрения, в шиповатом слое плоского неороговевающего эпителия роговицы – 15,33±0,48, а в плоском слое – 6,70±0,47 в стандартном поле зрения. В экспериментальной группе с проводимым лечением с использованием комбинированных глазных лекарственных пленок на основе левофлоксацина 1,5 мг и декспантенола 15 мг в базальном слое наружного неороговевающего эпителия роговицы количество клеток составило 17,30±0,47 в поле зрения. В шиповатом слое количество клеток составило 12,47±0,51, а в плоском слое наружного эпителия роговицы 5,37±0,49 в стандартном поле зрения. Продолжена терапия первой волны.
На третьи сутки эксперимента в группе сравнения с лечением в виде инстилляций левофлоксацина 0,5% 4 раза в сутки и декспантенола 5% 6 раз в сутки площадь дефекта эпителия роговицы составила 28,38±2,117 мм2. Также зафиксировано утолщение роговицы до 342,60±23,476 мкм. В группе сравнения с толщина плоского неороговевающего эпителия роговицы в зоне рядом с ожогом составила 20,15±1,752 мкм. Количество клеток снизилось в сравнении с морфологическим исследованием роговицы на 2 сутки. В базальном слое наружного эпителия роговицы уменьшилось на 10,7%, в шиповатом слое уменьшилось на 16,5%, а количество клеток в плоском слое уменьшилось на 12,9%.
В экспериментальной группе с лечением с использованием комбинированных глазных лекарственных пленок на основе левофлоксацина 1,5 мг и декспантенола 15 мг не было зафиксировано дефекта эпителия роговицы. Толщина роговицы в этой экспериментальной группе составила 378,14±32,881 мкм. Толщина плоского неороговевающего эпителия роговицы составила 18,13±1,576 мкм. В экспериментальной группе с лечением с использованием комбинированных глазных лекарственных пленок зафиксировано уменьшение количества клеток в базальном слое наружного эпителия роговицы на 22,4%. В шиповатом слое количество клеток уменьшилось на 16,8%, а плоском слое зафиксировано уменьшение на 13% в сравнении с аналогичными показателями на 2 сутки. В экспериментальной группе с лечением с использованием комбинированных глазных лекарственных пленок на основе левофлоксацина 1,5 мг и декспантенола 15 мг не зафиксировано статистически значимых отличий от интактной роговицы. В экспериментальной группе начата терапия второй волны.
На 5 сутки эксперимента в группе сравнения, в которой лечение проводилось с использованием инстилляций левофлоксацина и декспантенола не выявлено дефекта эпителия роговицы. В группе сравнения толщина роговицы увеличилась на 9,9%. Толщина плоского неороговевающего эпителия уменьшилась на 11,4% и соответствовала толщине интактной роговицы. В группе сравнения с лечением в виде инстилляций левофлоксацина и декспантенола зафиксировано соответствие количества клеток с показателями интактной роговицы. Начата терапия второй волны. В экспериментальной группе не было зафиксировано статистически значимых отличий от предыдущего срока наблюдения. Продолжена терапия 2 волны.
Спустя 7 суток после формирования стандартного инфицированного ожога и инфицирования роговицы в обоих экспериментальных группах не было зафиксировано статистически значимых отличий от предыдущего срока наблюдения и была продолжена терапия второй волны. На 10 сутки эксперимента в экспериментальной группе с лечением с использованием комбинированных глазных лекарственных пленок на основе дексаметазона и декспантенола было завершено лечение второй волны, которое продолжалось 7 суток с момента эпителизации роговицы. На 12 сутки было прекращено лечение в группе сравнения с лечением в виде инстилляций дексаметазона и декспантенола. Дефекта эпителия роговицы при окраске 1% раствором флуоресцеином натрия при осмотре в синем свете в темном помещении дефекта эпителия роговицы зафиксировано не было. При морфологическом исследовании в обоих исследуемых группах на 14 сутки эксперимента роговица не имела статистически значимых отличий от интактной роговицы кроликов.
При исследовании толщины эндотелия роговицы не было зафиксировано статистически значимых отличий на всех сроках наблюдения и при различном лечении, что свидетельствует о поверхностном течении воспалительного процесса.
Была подсчитана площадь ядер клеток в базальном, шиповатом и плоском слоях эпителия роговицы. По результатам исследования было зафиксировано отсутствие статистически значимых отличий от интактной роговицы при различных способах лечения на всех сроках наблюдения. Было подсчитано количество клеток и оценена площадь ядер эндотелия роговицы в стандартном поле зрения в обоих исследуемых группах. При этом не было выявлено статистически значимых отличий от интактной роговицы на всех сроках наблюдения.
В исследовании M.Т. Азнабаева и Г.А. Азаматовой [21] проведено экспериментальное изучение фармакологической эффективности глазных лекарственных пленок, содержащих левофлоксацин, которые использовались для профилактики послеоперационных инфекционных осложнений в хирургии катаракты. По результатам проведенного исследования была доказана безопасность и высокая биосовместимость глазных лекарственных пленок с левофлоксацином в комплексе с арабиногалактаном, а также отсутствие негативного влияния на структуры и физиологические функции глазного яблока и придаточного аппарата в эксперименте. Доказано, что при использовании глазных лекарственных пленок с левофлоксацином в комплексе с арабиногалактаном концентрация антибактериального препарата во влаге передней камеры глаза лабораторных животных сохраняется в течение 24 часов, в отличии от использования левофлоксацина в виде инстилляций, когда концентрация антибиотика значительно снижается уже через 2 часа после применения препарата. При использовании глазных лекарственных пленок с левофлоксацином в качестве профилактики послеопрационных осложнений после хирургии катаракты зафиксировано быстрое купирование инфекционной воспалительной реакции и отсутствие патологических морфологических изменений в тканях глазного яблока. При исследовании комбинированных глазных лекарственных пленок также зафиксирована десорбция спустя 24 часа нахождения в конъюнктивальной полости.
В исследовании Г.Я. Гайсиной [22] были изучены темпы десорбции моксифлоксацина из глазной лекарственной пленки на основе поливинилового спирта и дигидрокверцетина. Зафиксировано замедление десорбции в 5 раз из глазной лекарственной пленки на основе поливинилового спирта в сравнении с пленкой на основе дигидрокверцетина. Автором доказано отсутствие токсико-аллергического воздействия на ткани глаза, а также отрицательного влияния глазных лекарственных пленок с моксифлоксацином на состояние глаза и его придаточного аппарата. Рассмотрен вопрос целесообразности профилактики послеоперационных осложнений инфекционного характера после проведения хирургических вмешательств по поводу экстракции катаракты с использованием глазных лекарственных пленок с моксифлоксацином. В экспериментальной модели животным вводили в водянистую влагу передней камеры глаза 0,3 мл. культуры Staphylococcus aureus. В результате эксперимента установлено, что глазные лекарственные пленки с моксифлоксацином обладают выраженным антибактериальным эффектом и успешно предотвращают развитие острого воспаления внутренних оболочек глаза. В настоящем исследовании также не зафиксировано какого-либо токсико-аллергического или негативного влияния комбинированных глазных лекарственных пленок на состояние глазного яблока.
Таким образом, использование комбинированных глазных лекарственных пленок на основе левофлоксацина 1,5 мг и декспантенола 15 мг 1 раз в сутки позволяет ускорить процесс эпителизации инфицированного дефекта роговицы до 3 суток. А также позволяет ускорить процесс восстановления толщины роговицы к показателям интактного глаза. Включение в терапию первой волны стимуляторов тканевой репарации в виде декспантенола стимулирует ускорение стабилизации исследуемых морфологических показателей к уровню нормальной роговицы. Применение комбинированных глазных лекарственных пленок на основе дексаметазона 0,5 мг и декспантенола 15 мг 1 раз в сутки также позволяет успешно проводить профилактику возникновение осложнений после лечения инфицированных ожогов роговицы за счет включения в состав лекарственной пленки стероидного противовоспалительного препарата. Таким образом, в связи с высокой эффективностью и малой кратностью применения комбинированных глазных лекарственных пленок при лечении инфицированных ожогов роговицы целесообразно проведение дальнейших клинических исследований и дальнейшее практическое применение.
Выводы:
- При лечении стандартного инфицированного ожога роговицы применение комбинированных глазных лекарственных пленок позволяет сократить процесс морфологического восстановления роговицы до 3 суток, в сравнении с лечением с использованием инстилляций, где восстановление роговицы к показателям интактного глаза наступает на 5 сутки.
- Применение стероидного противовоспалительного препарата после момента фиксации полной эпителизации роговицы позволяет успешно проводить профилактику развития посттравматических осложнений инфицированных ожогов роговицы.
- Добавление в состав комбинированных глазных лекарственных пленок стимуляторов тканевой репарации позволило на начальном этапе лечения ускорить процесс деления и миграции клеток эпителия роговицы, а после эпителизации дефекта укрепляет вновь образованные эпителиальные клетки и защищает роговицу от агрессивных факторов внешней среды




















Список литературы