Влияние ингибиторов натрий-глюкозного котранспортера второго типа на динамику функциональных и структурных нарушений при моделировании постконтрастного острого повреждения почек
Aннотация
Актуальность: Ингибиторы натрий-глюкозного котранспортера второго типа за последние несколько лет существенно изменили стратегии нефропротекции у различных категорий пациентов. Однако данные об их влиянии на течение постконтрастного повреждения почек, отсутствуют. Цель исследования: Изучить влияние ингибиторов натрий-глюкозного котранспортера второго типа на динамику морфофункциональных показателей при моделировании постконтрастного острого повреждения почек. Материалы и методы:Эксперимент выполнен на 50 крысах-самцах линии Wistar. Моделирование постконтрастного острого повреждения почек осуществлялось путем последовательного введения ингибитора циклооксигеназы, блокатора синтаз оксида азота и йогексола. Введение ингибиторов натрий-глюкозного котранспортера осуществляли до моделирования постконтрастного острого повреждения почек: дапаглифлозин в дозе 1 мг/кг, канаглифлозин – 25,7 мг/кг, эмпаглифлозин –2 мг/кг, с учетом их фармакокинетики. Ренопротективные эффекты оценивали через 48 часов по совокупности функциональных (скорость клубочковой фильтрации и сывороточная концентрация креатинина) и структурных (описательная морфология и балльная оценка тяжести нарушений) изменений в почках. Результаты:Предварительное введение дапаглифлозина, канаглифлозина и эмпаглифлозина на фоне постконтрастного острого повреждения почек приводило к статистически достоверному изменению следующих показателей: сывороточной концентрации креатинина и скорости клубочковой фильтрации. Улучшение патоморфологической картины в совокупности с уменьшением балльной оценки степени выраженности эпителиальных, клубочковых, интерстициальных и эндотелиальных повреждений, также подтверждали защитные эффекты ингибиторов натрий-глюкозного котранспортера. Заключение:Результаты исследования демонстрируют высокий нефропротективный потенциал ингибиторов натрий-глюкозного котранспортера 2 типа: дапаглифлозина, канаглифлозина и эмпаглифлозина на модели постконтрастного острого повреждения почек при однократном предварительном введении
Ключевые слова: острое повреждение почек, постконтрастное острое повреждение почек, ингибиторы натрий-глюкозного котранспортера, дапаглифлозин, эмпаглифлозин, канаглифлозин, EGTI
Введение. Согласно рекомендациям KDIGO (Kidney Disease Outcomes Quality Initiative – Инициатива по улучшению качества исходов заболеваний почек) острое повреждение почек (ОПП) определяется как: повышение сывороточной концентрации креатинина на ≥0,3 мг/дл (≥26,5 мкмоль/л) в течение 48 часов; или повышение сывороточной концентрации креатинина до ≥1,5 раз по сравнению с исходным уровнем (если это известно, или предполагается, что это произошло в течение предшествующих 7 дней); или объем мочи <0,5 мл/кг/час за 6 часов [1].
Исследования демонстрируют, что эпизод острого повреждения почек связан с высоким уровнем госпитальной летальности, достигающий 70-80% у пациентов с сепсисом [2, 3], что создает предпосылки для увеличения уровня затрат на лечение таких пациентов. Кроме того, даже один эпизод ОПП может формировать различные патогенетические звенья и сигнальные пути, способствующие развитию и прогрессированию хронической болезни почек, вплоть до терминальной стадии и стойкой диализной зависимости, а также увеличению долгосрочной летальности от сердечно-сосудистых заболеваний [3].
Неполное или дезадаптивное восстановление различных структурных элементов почек после эпизода острого повреждения почек может привести к активации процессов фиброза в почках, потере почечных клеток и клубочков, воспалению, а также к формированию патологических сигнальных путей, способствующих развитию и прогрессированию хронической болезни почек [4, 5].
Выделяют несколько патогенетических вариантов острого повреждения почек, наиболее частыми и клинически значимыми из которых являются: ишемия почек с последующей реперфузией, сепсис и действие нефротоксичных агентов, в том числе рентгенконтрастных средств [6]. Общими звеньями указанных повреждений можно назвать прямое повреждающее действие на клетки канальцев [5], эндотелиальную дисфункцию [7] и воспаление [8]. В связи с этим, фармакологические агенты, обладающие совокупностью эффектов, препятствующих развитию указанных патогенетических звеньев, могут быть успешно использованы с целью профилактики и терапии ОПП у различных категорий пациентов для уменьшения рисков развития осложнений, в том числе необратимого повреждения структурных элементов почки с развитием терминальной стадии хронической болезни почек.
Безусловно, важный вклад в изучение патогенеза тех или иных синдромов вносят экспериментальные исследования на животных моделях. Комбинированное использование экспериментальных моделей для разработки механистических гипотез и проверки этих гипотез на людях продолжает оставаться успешной стратегией, способствующей прогрессу в медицине, в том числе в области изучения ОПП [9-13]. Подходы к моделированию постконтрастного острого повреждения почек у лабораторных животных существенно варьируются, однако, по нашему мнению, наиболее близкой к клинической практике является модель с последовательным введением неселективного ингибитора циклооксигеназы (индометациона или диклофенака), блокатора эндотелиальной синтазы оксида азота (N-нитро-L-аргинин метилового эфира) и йодсодержащего рентгенконтрастного средства [14, 15]. Таким образом, формируется комплекс нарушений, соответствующий классическим факторам риска развития постконтрастного повреждения почек у пациентов различного профиля.
Ингибиторы натрий-глюкозного котранспортера второго типа являются одним из новых классов лекарственных средств для лечения сахарного диабета. Данные крупных клинических исследований продемонстрировали не только их высокую эффективность по снижению уровня глюкозы в крови, но и многочисленные плейотропные эффекты [16].
Одним из таких эффектов стала их способность предупреждать и замедлять прогрессирование диабетической нефропатии [17, 18, 19], что создает преимущества над остальными классами лекарственных средств для лечения сахарного диабета из-за снижения рисков развития межлекарственных взаимодействий и улучшения исходов у данной категории пациентов. Однако, механизмы нефропротективных эффектов ингибиторов натрий-глюкозного котранспортера второго типа, такие как: активация обратной тубуло-гломерулярной связи, натрийурез, снижение артериального давления и увеличение гематокрита [20] могут способствовать более тяжелому течению острого повреждения почек (являются патогенетическими звеньями его развития и факторами риска его развития). Эта гипотеза, а также первичные пострегистрационные данные продемонстрировали повышение риска острого повреждения почек на фоне применения ингибиторов натрий-глюкозного котранспортера 2 типа [21]. Однако, последующие клинические исследования, напротив, продемонстрировали снижение риска развития острого повреждения почек на фоне их приема [22].
Цель исследования. Изучение влияния ингибиторов натрий-глюкозного котранспортера второго типа на структурные и функциональные изменения при постконтрастном остром повреждении почек, как одного из наиболее часто встречающихся патогенетических вариантов острого повреждения почек.
Материалы и методы исследования. Эксперимент выполнен на 50 половозрелых крысах-самцах линии Wistar весом 200-250 г. Эксперименты выполнялись в соотвествие с «European Convention for the Protection of Vertebral Animals Used for Experimental and Other Scientific Purposes. CETS No. 123» (с правками CETS No. 170)
Животные были рандомизированы на следующие группы (n=10):
Группа 1. Интактные.
Группа 2. Моделирование постконтрастного острого повреждения почек.
Группа 3. Дапаглифлозин в дозе 1 мг/кг + моделирование постконтрастного острого повреждения почек.
Группа 4. Канаглифлозин в дозе 25,7 мг/кг + моделирование постконтрастного острого повреждения почек.
Группа 5. Эмпаглифлозин в дозе 2 мг/кг + моделирование постконтрастного острого повреждения почек.
Животные и протокол эксперимента
Моделирование постконтрастного острого повреждения почек производили путем последовательного введения диклофенака в дозе 10 мг/кг внутрибрюшинно, N-нитро-L-аргинин метилового эфира (статистически достоверному росту сывороточного креатинина) в дозе 10 мг/кг внутрибрюшинно и йогексола в дозе 3 г йода/кг. Через 48 часов производился отбор проб крови и мочи, забор почек для последующих патоморфологических исследований.
Фармакологические агенты
Дапаглифлозин вводили в дозе 1 мг/кг за 120 минут до моделирования постконтрасного острого повреждения почек, канаглифлозин – в дозе 25,7 мг/кг за 90 минут до моделирования постконтрасного острого повреждения почек; эмпаглифлозин – в дозе 2 мг/кг за 90 минут. Указанные фармакологические агенты вводили внутрижелудочно. Используемые дозы рассчитаны с учетом межвидовых коэффициентов доз, режим введения основан на фармакокинетических свойствах агентов.
Оценка функционального состояния почек
Определение концентрации креатинина в сыворотке крови и моче выполнено с использованием автоматического биохимического анализатора AU480.
Скорость клубочковой фильтрации вычисляли следующим образом, основываясь на клиренсе эндогенного креатинина, по общепринятой формуле (мл/мин):
* – Cr (urea) – концентрация креатинина в моче (мкмоль/л); V (urea) – объем мочи (мл); Cr (serum) –концентрация сывороточного креатинина (мкмоль/л); t – время (мин).
Описательная морфология
Почки лабораторных животных фиксировали путем погружения в 10% раствор формалина. Затем производили гистологическую обработку тканей путем промывания под водой и парафиновой проводки. После этого изготавливали парафиновые срезы и окрашивали гематоксилином-эозином по общепринятой методике. Изображения были получены с помощью светового микроскопа «МИКМЕД-6» и проанализированы с помощью «МСview».
Оценка тяжести структурных повреждений с использованием шкалы EGTI
Для оценки степени тяжести структурных повреждений, во всех группах была произведена полуколичественная их оценка по шкале EGTI (Endothelial, Glomerular, Tubular, and Interstitial components – эндотелиальные, клубочковые, канальцевые и интерстициальные компоненты) (таблица 1) [23]:

Статистическая обработка данных
Полученные данные проверяли на нормальность распределения с использованием критерия Шапиро-Уилка. В случае нормального распределения, данные представлялись как среднее (M) и стандартная ошибка среднего (m). В случаях ненормального распределения признаков, рассчитывались медиана (Me) и квартильный размах (QR). Для межгрупповых сравнений был использован t-критерия Стьюдента или критерий Манна-Уитни, в зависимости от типа распределения. р<0,05 указывало на статистически значимое различие.
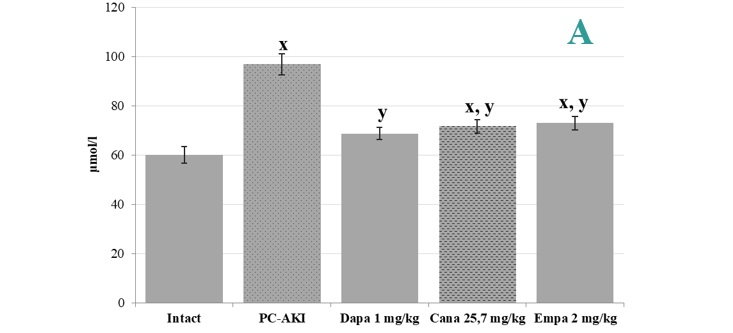
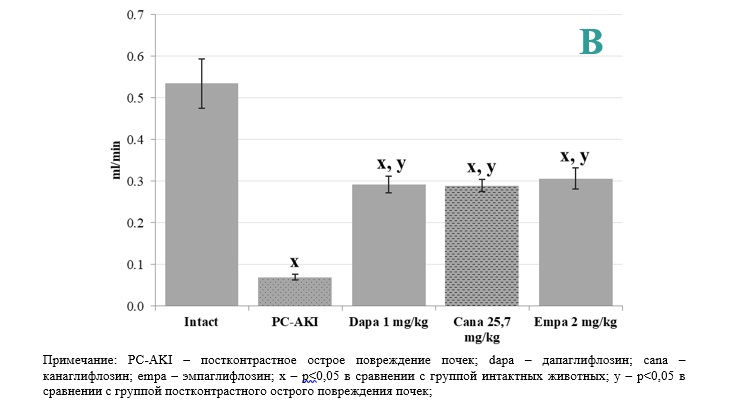
Результаты и их обсуждение. Моделирование постконтрастного острого повреждения почек у лабораторных животных приводило к статистически достоверному росту сывороточного креатинина до 97±4,3 мкмоль/л в сравнении с группой интактных животных (значения более, чем в 1,5 раза превосходили показатели интактных животных, что соответствует критериям острого повреждения почек согласно подходам KDIGO). Скорость клубочковой фильтрации падала пропорционально падению сывороточного креатинина и составила 0,07±0,01 мл/мин в сравнении с 0,54±0,06 мл/мин в группе интактных животных (рис. 1).

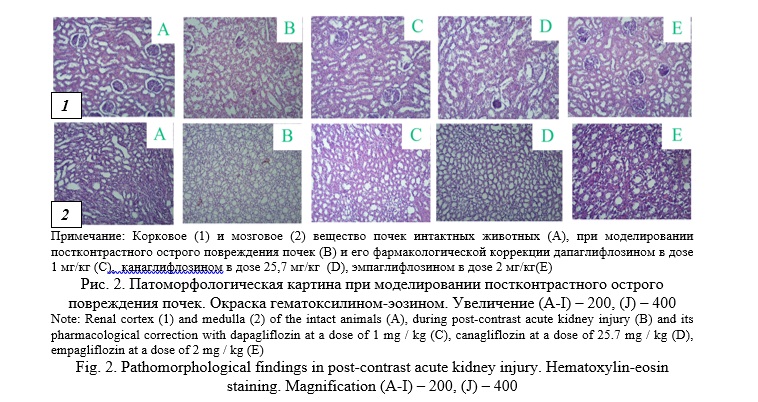
Тяжесть структурных повреждений коррелировала с выраженностью изменений функциональных параметров: визуализировалось уменьшение количества почечных телец на стандартной площади среза и их сморщивание, а также мелкоочаговые участки некроза эпителия проксимальных и дистальных канальцев и их дистрофические изменения (рис. 2). Также в канальцах наблюдались участки с отрывом клеток от базальной мембраны с обтурацией их просвета. В мозговом веществе отделы петель Генле и собирательных трубочек расширены, их эпителий уплощен. Сосуды коркового и мозгового вещества неравномерно кровенаполнены. Отмечается набухание и скудная пролиферация эндотелия сосудов микроциркуляторного русла.
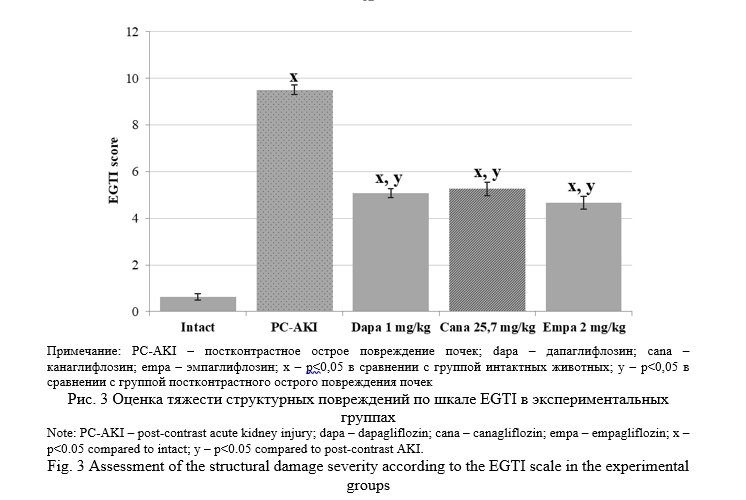
При подсчете суммы баллов по шкале EGTI, также характеризующей тяжесть структурных повреждений, у крыс-самцов при моделировании постконтрастного острого повреждения почек отмечается рост данного показателя до 9,5±0,24 против 0,64±0,14 в группе интактных животных (рис. 3).
На фоне предварительного введения дапаглифлозина, как и канаглифлозина и эмпаглифлозина, отмечалось снижение сывороточных концентраций креатинина более, чем в 1,3 раза при моделировании постконтрастного острого повреждения почек, что статистически достоверно отличалось от показателей группы с моделированием постконтрастного острого повреждения почек (p<0,05). Кроме того, следует отметить, что предварительное введение дапаглифлозина позволило достичь уровня сывороточного креатинина, сопоставимого с показателями интактных животных, что свидетельствует о высоком ренопротективном потенциале указанной группы фармакологических агентов.
Патоморфологическую картину при предварительном введении ингибиторов натрий-глюкозного котранспортера второго типа можно охарактеризовать следующим образом: в корковом веществе наблюдаются немногочисленные сморщенные клубочки: эпителий проксимальных и дистальных канальцев местами с умеренно выраженными дистрофическими изменениями; в мозговом веществе нисходящие и восходящие отделы петель Генле и собирательных трубочек преимущественно без особенностей; отмечается набухание эндотелия сосудов микроциркуляторного русла (рис. 2).
Динамика изменений суммы баллов при оценке изменений по шкале EGTI полностью соответствовала динамике показателей скорости клубочковой фильтрации и сывороточной концентрации креатинина: для дапаглифлозина указанное значение составило 5,08±0,28, канаглифлозина – 5,26±0,19 и эмпаглифлозина – 4,66±0,25. Существенный вклад в формирование более низких показателей по шкале EGTI внесло улучшение состояния эпителия канальцев и эндотелия почечных сосудов.
В последние годы прогресс в области интервенционной кардиологии позволил более безопасно вести диагностические и интервенционные процедуры пациентов из группы риска. Однако одним из способов получения точных изображений коронарной и периферической сосудистой сети в клинической практике до сих пор остаются исследования с использованием внутривенных рентгенконтрастных средств, которые являются потенциальными нефротоксичными агентами [24]. Несмотря на то, что уровень сывороточного креатинина у пациентов с эпизодом постконтрастного острого пвореждения почек или контраст-индуцированной нефропатии, возвращается к исходному уровню через 1-3 недели, более высокие риски неблагоприятных клинических исходов, включая краткосрочную и долгосрочную летальность, сохраняются [25].
Оценка патоморфологической картины, характеризующей некоторые патогенетические звенья развития острого повреждения почек и его тяжесть, также является важным аспектом доклинических исследований, так как возможности проведения данных исследований в клинической практике, в значительной мере, ограничены. Помимо описательной морфологии, определяющей качественные характеристики имеющихся структурных повреждений, особую ценность представляют различные количественные и полуколичественные шкалы. Одной из наиболее ранних шкал является шкала Jablonski [26]. Несмотря на кажущуюся простоту и малое количество критериев, во-первых, необходимо оценить более ста канальцев в каждом образце, что требует достаточных ресурсов и временных затрат. Во-вторых, данная система позволяет оценить лишь тяжесть канальцевых повреждений, а при ишемии-реперфузии и постконтрастном повреждении почек имеются различного рода травмы во всех структурных элементах почки.
Другая полуколичественная шкала была предложена командой Takehiko Miyaji [27]. Однако, несмотря на меньшие трудозатраты (для оценки предлагается выбрать 30 канальцев в каждом образце), она также позволяет оценить лишь тяжесть канальцевых повреждений. Одним из подходов к расширению спектра оцениваемых параметров является морфометрия клубочковых и канальцевых структур: измерение высоты эпителия проксимальных и дистальных канальцев и расчет площадей сосудистого клубочка и сосудистого тельца [28, 29]. Однако, не всегда данная система была показательной для оценки степени выраженности изменений, статистически достоверно не отличаясь от показателей интактных и ложнооперированных животных при моделировании двусторонней почечной ишемии-реперфузии.
По нашему мнению, наиболее эффективной стратегией оценки патоморфологической картины при ОПП является шкала EGTI. В представленном исследовании, помимо патогномоничной картины, наблюдалось существенное увеличение суммы показателей по указанной шкале, достигающее 9,5±0,24 баллов при постконтрастном остром повреждении почек, что в значительно мере коррелировало с показателями функционального состояния почек.
Ингибиторы натрий-глюкозного котранспортера 2 типа, как продемонстрировано в клинических исследованиях, снижают риски формирования острого повреждения почек [18, 20]. Однако, остается открытым вопрос об их эффективности по снижению рисков ОПП при однократном приеме. Потенциальными механизмами нефропротективных эффектов данной фармакологической группы служат: повышение напряжения кислорода в корковом слое почек, что позволяет сохранить целостность канальцевых эпителиальных клеток [30], повышение экспрессии гипоксией-индуцированного фактора 1α [31] и улучшение функционирования сердечно-сосудистой системы с восстановлением кардиоренальной обратной связи и регуляции нейрогуморальной системы [32, 33]. С другой стороны, дапаглифлозин в клиническом исследовании по изучению его влияния на маркеры повреждения клубочков и канальцев, продемонстрировал способность уменьшать экскрецию провоспалительного цитокина – интерлейкина-6 с мочой, что косвенно свидетельствует о реализации нефропротективных свойств ингибиторов натрий-глюкозного котранспортера 2 типа через противовоспалительную активность [34].
Полученные в нашем исследовании данные продемонстрировали защитные эффекты трех ингибиторов натрий-глюкозного котранспортера второго типа: дапаглифлозина, канаглифлозина и эмпаглифлозина, при постконтрастном остром повреждении почек. Об этом свидетельствовало сопоставимое снижение концентрации сывороточного креатинина и рост скорости клубочковой фильтрации, а также улучшение патоморфологической картины и уменьшение суммы баллов при полуколичественной оценке тяжести структурных изменений по шкале EGTI. Также необходимо отметить тот факт, что снижение суммарной балльной оценки по указанной шкале происходило преимущественно за счет улучшения структурной организации канальцевых и эндотелиальных структур.
Заключение. Результаты представленного исследования демонстрируют высокий нефропротективный потенциал ингибиторов натрий-глюкозного котранспортера 2 типа: дапаглифлозина, канаглифлозина и эмпаглифлозина в условиях моделирования у половозрелых крыс-самцов линии Wistar постконтрастного острого повреждения почек, при однократном предварительном введении. Таким образом, требуются дальнейшие исследования по изучению более сложных молекулярных механизмов, характеризующих фармакологические пути защиты почечной ткани ингибиторами натрий-глюкозного котранспортера второго типа при остром повреждении почек и их места в профилактике и лечении постконтрастного острого повреждения почек в клинической практике.




















Список литературы