Коррекция митохондриальной дисфункции коричными кислотами при экспериментальной гиперцитокинемии
Aннотация
Актуальность: Митохондриальная дисфункция является существенной составляющей патогенеза гиперцитокиновой нейротоксичности и представляет собой перспективную фармакотерапевтическую мишень. Цель исследования: Оценить влияние коричных кислот на изменение митохондриальной функции в ткани головного мозга у крыс в условиях экспериментальной гиперцитокинемии. Материалы и методы: Гиперцитокинемию моделировали у крыс путем внутрибрюшинного введения липополисахарида в дозе 10 мг/кг. Исследуемые соединения (коричную, феруловую, кумаровую, кофейную, синаповую кислоты) и препарат сравнения (этилметилгидроксипиридина сукцинат) вводили в дозе 100 мг/кг, перорально на протяжение 14 дней с момента введения липополисахарида. Далее у крыс оценивали изменение неврологического дефицита и в митохондриальной фракции головного мозга определяли активность сукцинатдегидрогеназы и цитохром-с-оксидазы, концентрацию митохондриального пероксида водорода и супероксид-радикала. Результаты: Применение препарата сравнения, кофейной и кумаровой кислот и в меньшей степени коричной кислоты способствовало уменьшению неврологического дефицита у крыс (на 38,5%; 42,3% 40,4% и 21,2% соответственно, все показатели p<0,05 относительно группы животных негативного контроля), при увеличении активности сукцинатдегидрогеназы (на 23,0% (p<0,05); 30,0% (p<0,05) и 20,0% (p<0,05), коричная кислота значимого влияния на активность фермента не оказала) и цитохром-с-оксидазы (на 22,2%; 34,4%; 32,2%; и 22,2% соответственно, все показатели p<0,05 относительно группы животных негативного контроля), а также снижении концентрации супероксид радикала (на 38,8%; 48,8%;46,3%;и 33,4% соответственно, все показатели p<0,05 относительно группы животных негативного контроля) и пероксида водорода (на 25,0% (p<0,05); 54,2% (p<0,05); 50,4% и 27,9% (p<0,05) соответственно). При этом, антирадикальная активность и изменение активности сукцинатдегидрогеназы коррелировало с нормальным градиентом молекул. Заключение: Исследование показало возможность применения коричных кислот, содержащих свободные гидроксильные группы в ароматическом кольце, для коррекции постгиперцитокиновой нейротоксичности.
Введение. Гипперцитокиновые расстройства, такие как «цитокиновый шторм» наносят огромный ущерб организму человека. В результате массированного выброса в системный кровоток провоспалительных цитокинов отмечается развитие полиорганной недостаточности, в ходе которой прежде всего повреждаются сердечно-сосудистая, дыхательная и выделительная системы [1]. Также было установлено, что гиперпродукция цитокинов (фактор некроза опухоли -α (ФНО-α), интерлейкин-6 (ИЛ-6) и интерлейкин 1-β (ИЛ-1β)) и вызываемые ими эффекты негативно отражаются на структурно-функциональной целостности нейронов головного мозга, запуская процессы нейровоспаления [2]. Активация процессов воспаления мозговой ткани приводит к повреждению эндотелия мозговых сосудов, увеличению проницаемости гемато-энцефалического барьера, эксайтотоксичности, дегенерации аксонов, нейромедиаторному дисбалансу и ухудшению клеточного метаболизма [3].
Также, воспалительные процессы в ткани головного мозга могут активироваться не только провоспалительными цитокинами или хемокинами. Не последнюю роль в нейровоспалении играют активные формы кислорода (АФК), провоспалительные ферменты, такие как индуцибельная синтаза оксида азота (iNOS) и вторичные мессенджеры. На сегодняшний день установлено, что повышению интенсивности нейровоспалительных реакций способствуют «неклассические» соединения, например, вещества, образующиеся в ходе деструкции митохондрий клетки [4]. Митохондрии содержат целый ряд потенциально сильных провоспалительных агентов, таких как митохондриальная ДНК (мтДНК), цитохром С, кардиолипин, формилпептиды, которые в определенных условиях могут приобретать иммуногенные свойства. Одной из таковых причин является окислительная модификация митохондрий под действием прооксидантов с последующей их гибелью [5]. В результате лизиса митохондрий окисленная мтДНК инициирует вторичный выброс цитокинов/хемокинов глиальными клетками, усиливая нейровоспалительные процессы. Также клетки глии могут активироваться избытком молекул АТФ, увеличивая экспрессию гена ИЛ-6 [6].
В этой связи можно предположить, что сохранение целостности митохондрий, а также стабилизации их функции может уменьшить негативное влияние цитокинов на клетки головного мозга [7].
В коррекции митохондриальных нарушений все большую актуальность приобретают соединения природного происхождения, которые выгодно отличаются от веществ, полученных синтетическим путем, оптимальным соотношением эффективность/безопасность. Установлено положительное влияние на изменение функциональной активности митохондрий ресвератрола, диосмина, куркумина, ди/ и тритепеноидов, гераниола и ряда других соединений [8]. В литературе приводятся сведения о митохондриотропной активности производных коричной кислоты, в частности, модифицированная трифенилфосфониевым катионом кофейная кислота проявляла свойства эффективного антиоксиданта, подавляя образование митохондриального пероксида водорода [9]. Также ранее проведенные исследования показали, что применение производных коричной кислоты при ишемии мозга способствовало восстановлению активности ферментов митохондриального происхождения – аконитазы, цитратсинтазы и α-кетоглутаратдегидрогеназы [10]. Таким образом, можно предположить, что на фоне введения коричных кислот будет отмечаться снижение степени повреждения головного мозга, опосредованного гиперпродукцией цитокинов.
Цель исследования. Оценить влияние производных коричной кислоты на изменение митохондриальной функции в головном мозге у крыс в условиях экспериментальной гиперцитокинемии.
Материалы и методы исследования. Исследование выполнено на 80 крысах-самцах линии Wistar (половозрелые, масса тела – 200-220 грамм). Животные были получены из лаборатории живых систем Пятигорского медико-фармацевтического института и на время исследования содержались в контролируемых условиях экспериментального вивария при температуре воздуха 18-22 ⁰С, относительной влажности 50-60% и 12-ти часовой смене суточного цикла. Дизайн исследования, биометодологические техники и содержание животных соответствовали принципам ARRIVE 2.0. [11]. Гиперцитокинемию у крыс воспроизводили путем интраперитонеального введения липолисахарида E.coli в дозе 10 мг/кг [12]. В ходе проведения исследования экспериментальные группы формировались методом рандомизации по массе тела. Были выделены следующие группы животных: ИН – интактные животные, НК – негативный контроль, группа животных, которой вводили референтный препарат этилметилгидроксипиридина сукцинат (Мексидол, ФАРМАСОФТ, Россия) в дозе 100 мг/кг (peros) и группы крыс, получавших изучаемые соединения – коричную кислоту, кофейную кислоту, кумаровую кислоту, синаповую и феруловою кислоты в дозе 100 мг/кг (peros) каждое соединение [10]. Выбор препарата сравнения основан на исследовании, проведенном Кировой Ю.И., с соавт. 2020, в котором показано, что применение этилметилгидроксипиридина сукцината увеличивает митохондриогенез в головном мозге, посредством взаимодействия с регуляторным сукцинатным рецептором SUCNR1. [13].
Исследуемые объекты были предоставлены HunanWarrantPharmaceuticals (КНР). Препарат сравнения и анализируемые вещества вводили на протяжение 14 дней с момента введения бактериального липополисахарида. Продолжительность введения исследуемых соединений и референта обусловлена особенностями экспериментальной модели гиперцитокинемии. Далее у животных оценивали изменение неврологического дефицита по шкале МcGraw [14], производили забор биоматериала и осуществляли оценку изменения митохондриальной функции в ткани головного мозга.
Митохондриальную фракцию головного мозга получали путем градиентного центрифугирования гомогената головного мозга, для чего головной мозг гомогенизировали в среде 1 ммоль ЭГТА + 215 ммоль маннита + 75 ммоль сахарозы + 0,1% раствор БСА + 20 ммоль HEPES, при рН 7,2. Гомогенат центрифугировали в течение 2 минут при ускорении 1100g. Супернатант переносили в пробирки Эппендорф и наслаивали 10%-раствор перколла (Sigma-Aldrich). Полученную смесь повторно центрифугировали в течение 10 минут при ускорении 18000g. Надосадочную жидкость отбрасывали, осадок ресуспендировали в 1 мл изолирующей среды и центрифугировали в течение 5 минут при 10 000 g. [15].
Полученную надосадочную фракцию удаляли для определения активности цитохром-с-оксидазы и сукцинатдегидрогеназы, а также концентрации митохондриального пероксида водорода и супероксид-радикала. Активность цитохром-с-оксидазы определяли в митохондриальной фракции по изменению оптической плотности среды реакции окисления цитохрома С (II) в присутствии KCN при 500 нм. [16]. Активность сукцинатдегидрогеназы оценивали спектрофотометрически в реакции сукцинат-зависимого восстановления дихлорфенолиндофенола при добавлении в анализируемую среду ротенона при 600 нм. [17]. Оптическую плотность смесей регистрировали на спектрофотометре ПРОМЭКОЛАБ ПЭ-5300В в кюветах с длиной оптического пути 10 мм. Активность ферментов выражали в Ед/мг белка. Содержание белка в анализируемых образцах оценивали по методу Бредфорда. Концентрацию митохондриального пероксида водорода измеряли по изменению флуоресцентного сигнала, окрашенного резоруфина при длине волны возбуждения/эмиссии 570/585 нм. Содержание супероксид-радикала в анализируемых образцах определяли по изменению флуоресцентного сигала дигидроэтидий бромида при длине волны возбуждения/эмиссии 480/610 нм. [18]. С целью выявления некоторых закономерностей соотношения структура-активность в ряду исследуемых веществ был произведен расчет квантово-химических параметров, характеризующих целевые свойства молекул: теплота образования (ккал/моль), общая энергия (ЕВ), электронная энергия (ЭВ), энергия межъядерного взаимодействия (ЕВ), нормальный градиент, дипольный момент, потенциал ионизации (ЕВ), энергия наивысшей занятой молекулярной орбитали (ЕВ) и энергия низшей занятой молекулярной орбитали (ЕВ). Расчет произведен с применением программного обеспечения MOPAC 2016 c протоколом PM7.
Статистическую обработку полученных результатов осуществляли с применением программного пакета STATISTICA 6.0 (StatSoft). Данные выражали в виде M±SEM (среднее ± стандартная ошибка среднего). Нормальность распределения оценивали с помощью критерия Шапиро-Уилка, однородность дисперсия – с применением критерия Левена. Статистическую значимость отличий между группами проводили методом однофакторного дисперсионного анализа с пост-обработкой Ньюмена-Кейсла при критическом уровне значимости p<0,05. Корреляционный анализ выполнен согласно критерию Пирсона.
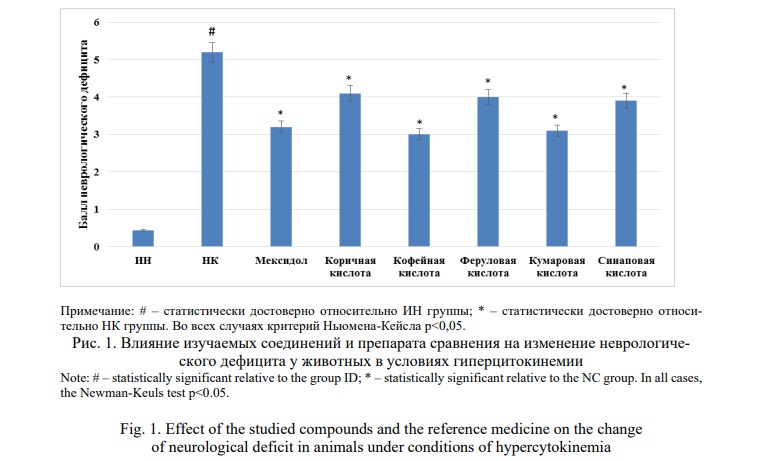
Результаты исследования. В ходе оценки изменения неврологического дефицита (рис.1) было установлено, что у НК группы крыс по отношению к ИН крысам наблюдалось повышение суммарного балла неврологического дефицита в 12,1 раза (p<0,05). На фоне введения Мексидола отмечено снижение степени выраженности неврологической симптоматики в сравнении с НК группой на 38,5% (p<0,05), в то время как при применении изучаемых соединений - коричной, кофейной, феруловой, кумаровой и синаповой кислот данный показатель уменьшился на 21,2% (p<0,05), 42,3% (p<0,05), 23,1 %(p<0,05),40,4% (p<0,05) и 25,0 % (p<0,05) соответственно.
Дальнейший ход исследования показал, что концентрация митоходриального пероксида водорода (рис.2) и супероксид-радикала (рис.3) в мозговой ткани у крыс НК группы была выше такового у ИН группы животных в 3,0 (p<0,05) и 4,0 (p<0,05) раза соответственно. Применение Мексидола способствовало уменьшение содержания в митохондриальной фракции, как пероксида водорода, так и супероксид-радикала по отношению к НК группе животных на 25,0% (p<0,05) и 38,8% (p<0,05) соответственно.
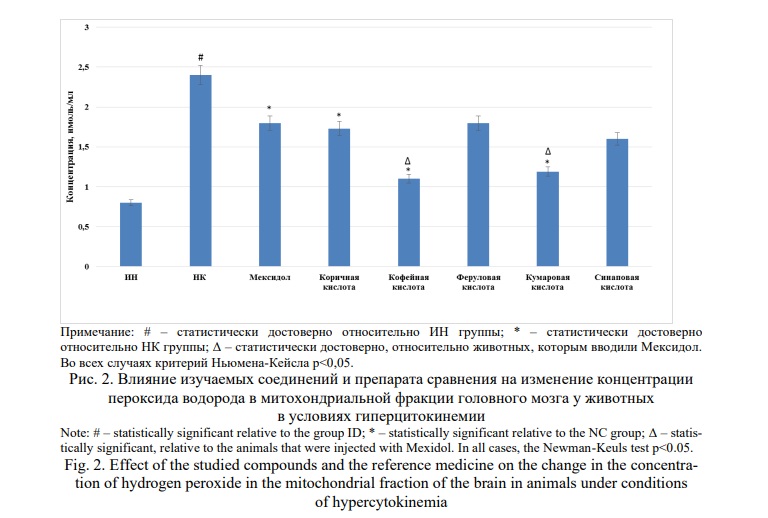
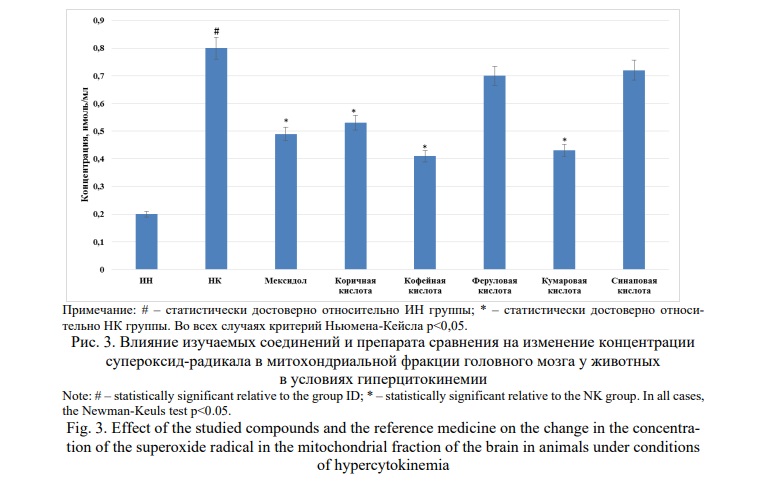
В ряду изучаемых веществ наиболее выраженные антирадикальные свойства были установлены для кофейной и кумаровой кислот, введение которых способствовало уменьшению концентрации пероксида водорода на 54,2% (p<0,05) и 50,4% (p<0,05) соответственно, а супероксид-радикала на 48,8 % (p<0,05) и 46,3% (p<0,05) соответственно. Несколько меньшую активность проявляла коричная кислота, на фоне применения которой содержание митохондриального пероксида водорода и супероксид-радикала уменьшилось на 27,9% (p<0,05) и 33,4% (p<0,05) в сравнении с показателями НК группы крыс. При этом, концентрация пероксида водорода при применении кофейной и кумаровой кислот была ниже, чем у группы крыс, получавшей Мексидол на 38,8 (p<0,05) и 33,3% (p<0,05) соответственно. Стоит отметить, что применение феруловой и синаповой кислот значимого влияния на изменение содержания пероксида водорода и супероксид-радикала в митохондриальной фракции головного мозга не оказало.
Анализ изменения активности сукцинатдегидрогеназы (рис.4) позволил установить, что у крыс НК отмечено снижение активность данного энзима относительно ИН группы на 38,9% (p<0,05), при уменьшении активности цитохром-с-оксидазы (рис.4) в 2,0 раза (p<0,05). Применение Мексидола способствовало повышению активности сукцинатдегидрогеназы и цитохром-с-оксидазы в сравнении с НК группой животных на 23,6% (p<0,05) и 22,2% (p<0,05) соответственно. Также каталитические свойства сукцинатдегидрогеназы и цитохром-с-оксидазы увеличились при введении животным кофейной кислоты (на 30,0% (p<0,05) и 34,4%(p<0,05) соответственно) и кумаровой кислоты (на 20,0 %(p<0,05) и 32,2% (p<0,05) соответственно). У крыс, получавших коричную кислоту отмечено повышение активности цитохром-с-оксидазы в сравнении с показателем НК группы на 22,2%(p<0,05).
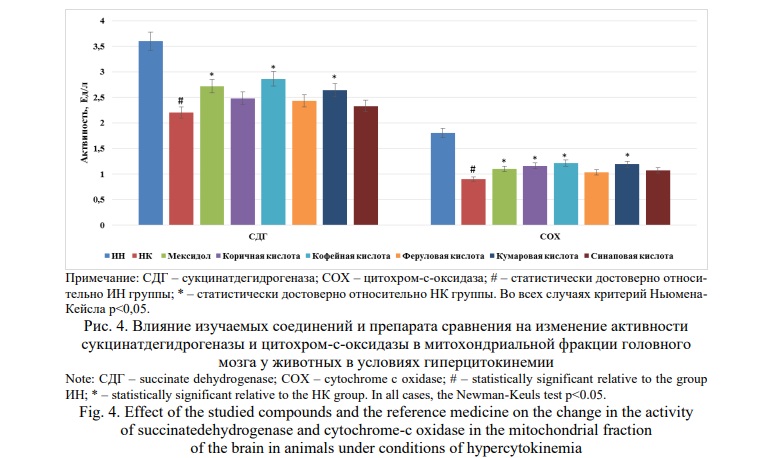
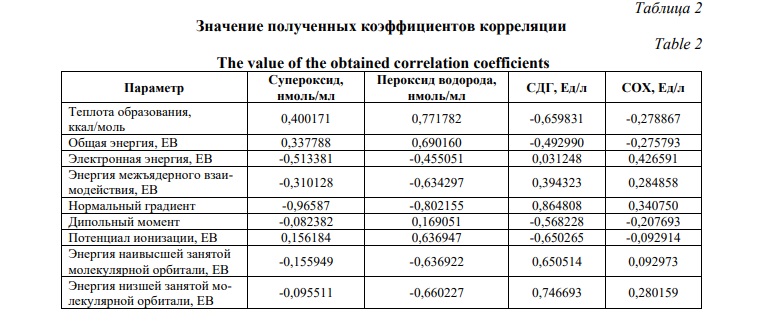
Проведенный в дальнейшем корреляционный анализ взаимосвязи активности и изменения квантово-химических параметров молекул (табл.1) позволил установить, что в ингибирующая активность в отношение супероксид-радикала в наибольшей степени зависит от нормального градиента (r=-0,96587).

Сильная корреляция была установлена между способностью изучаемых веществ ингибировать образование пероксида водорода и нормальным градиентом (r=-0,802155). Также с изменением нормального градиента сильно коррелировало изменение активности сукцинатдегидрогеназы (r=0,864808). Стоит отметить, что выраженных взаимосвязей между квантово-химическими параметрами исследуемых веществ и изменением активности цитохром-с-оксидазы не прослеживалось (табл.2).
Обсуждение результатов. Гиперцитокинемия как самостоятельный патологический синдром, так и как часть патогенеза других заболеваний сопровождается значительной смертностью населения, в ряде случаев составляющей более 40%. Установлено, что провоспалительные цитокины оказывают неспецифическое повреждающее действие практически на все органы и ткани, что приводит к полиорганной недостаточности. Высокая степень цитокин-опосредованных нарушений отмечается прежде всего в органах с интенсивным метаболизмом, например, в головном мозге, что выражается в развитии нейротоксического эффекта [19].
Повреждение головного мозга, вызываемое цитокинами, в основном происходит за счет индукции нейровоспаления, в ходе которого отмечается развитие каскада взаимосвязанных реакций, таких как, повреждение гемато-энцефалического барьера, развитие отеков цитотоксического и вазогенного типа, лактат-ацидоз, окислительный стресс, энергодефицит [20]. В связи с высокой патогенетической ролью нейровоспаления данный патогенетический механизм все чаще становиться мишенью для целенаправленного фармакологического вмешательства, в том числе и в условиях системой гиперцитокинемии. Так, Yang, et al., 2020 было показано, что применение дигидротестростерона у животных с экспериментальной гиперцитокинемией способствовало уменьшению степени повреждающего действия на мозговую ткань провоспалительных цитокинов – ИЛ-1, ИЛ-6 и ФНО-α. Также в данном исследовании продемонстрирована связь воспаления и апоптотического каскада, что является характерной особенностью липополисахарида как индуктора гиперцитокинемии [21]. Известно, что введение бактериального липополисахарида приводит к выраженной нейротоксичности за счет повышенного образования провоспалительных цитокинов и индукции нисходящих провоспалительных сигнальных путей, контролируемых NfkB, что приводит к инициированию программы апоптоза, развитию окислительного стресса в нейронах и клетках глии, приводя к их гибели с развитием клинических проявлений поражения ЦНС [22]. Одним из основных медиаторов липополисахарид-индуцированной нейротоксичности являются митохондриальные активные формы кислорода (АФК), представленные, как правило, суперокcид-радикалом и пероксидом водорода [23]. АФК считаются токсичными интермедиатами аэробного метаболизма и основной причиной клеточного повреждения. Высокая интенсивность окислительных процессов, происходящих в митохондриях, делают данные органеллы основными продуцентами АФК. В митохондриях идентифицировано 11 сайтов генерации АФК, образующихся при утечке протонов в митохондриальной дыхательной цепи [24]. Важное значение в образовании митохондриальных АФК играет изменение активность комплексов митохондриальной дыхательной цепи, в том числе макромолекулярными комплексами сукцинатдегидрогеназы и цитохром-с-оксидазы. Сукцинатдегидрогеназа или митохондриальный комплекс II генерирует значительное количество АФК, связанных с дефицитом флавопротеина. Цитохром-с-оксидаза (комплекс IV) менее склонна к генерации АФК, но образующиеся радикалы могут инициировать альтернативные каскады клеточного повреждения [25]. В этой связи наблюдаемое на фоне введения изучаемых соединений – кофейной и кумаровой кислот повышение активности сукцинатдегидрогеназы и цитохром-с-оксидазы может являться причиной снижения интенсивности реакций образования АФК, что было подтверждено в ходе оценки изменения концентрации митохондриального пероксида водорода и супероксид-радикала. Кроме того, данные ферментативные комплексы (сукцинатдегидрогеназа и цитохром-с-оксидаза) служат маркерами митохондриального биогенеза и повышение их активности свидетельствует о повышении синтеза митохондрий denovo [26]. При этом, увеличение биогенеза митохондрий в условиях липополисахарид-индуцированной нейротоксичности может иметь решающее значение для выживаемости нейронов, поскольку вновь образующиеся митохондрии содержат на порядок меньше дефектной ДНК и менее склонны к генерации АФК и инициированию апоптоза [27]. Также немаловажно, что при введении исследуемых соединений отмечено снижение выраженности неврологического дефицита. Стоит отметить, что наибольший уровень активности продемонстрировали соединение, содержащие в своей структуре свободные гидроксильные группы в ароматическом кольце. В этой связи был проведен корреляционный анализ, на основе методов вычислительной химии, целью которого являлось установить наличие определенных закономерностей изменения фармакологического эффекта от квантово-химических параметров молекул, наиболее полно характеризующих их состояние. Квантово-химические дескрипторы играют фундаментальную роль в химии и биомедицинских исследованиях, поскольку они определяют корреляции между химическими структурами и свойствами молекул (количественное соотношение структура-активность). Данные параметры могут предоставить исчерпывающую информацию о пространственно-геометрических, электростатических и реакционных свойствах молекул. Таким образом, многие дескрипторы отражают свойства молекул и могут дать представление о химической природе соединений, что несомненно важно в ходе целенаправленного синтеза новых родственных веществ.
Проведенный корреляционный анализ показал, что радикал-ингибирующие свойства в большей степени коррелируют с изменением нормального градиента (r=-0,96587 для супероксид-радикала и r=-0,802155 для пероксида водорода), что и отражает вклад гидрокси групп в изменение плотности электронного заряда в ароматическом кольце [28]. Стоит отметить, что активность сукцинатдегидрогеназы также коррелировало с изменением нормального градиента (r=0,864808), в то время как в отношение цитохром-с-оксидазы существенных корреляционных взаимосвязей не установлено.
Заключение. Проведенное исследование показало, что в условиях липополисахарид-индуцированной нейротоксичности применение кумаровой и кофейной кислот способствовало восстановлению митохондриальной функции, что отразилось в повышении активности сукцинатдегидрогеназы и цитохром-с-оксидазы, снижению генерации митохондриальных активных форм кислорода, что в итоге привело к уменьшению степени выраженности неврологического дефицита.




















Список литературы