Аномальные маточные кровотечения: этиология и патогенез (описательный обзор)
Aннотация
Актуальность: Несмотря на прогресс в медицине маточные кровотечения остаются общеизвестной медицинской проблемой. Аномальные маточные кровотечения оказывают негативное влияние на физическое, эмоциональное, социальное, в т.ч. материальное благополучие женского населения. Около трети женщин обращается за медицинской помощью к гинекологу в связи с аномальными маточными кровотечениями. Их частота увеличивается с возрастом: если в репродуктивном возрасте она составляет 20-30%, то в период пери- и постменопаузы возрастает до 80%. Аномальные маточные кровотечения занимают 2-е место среди причин госпитализации женщин в гинекологические стационары, служат показанием для большей части хирургических вмешательств, в т.ч. деструктивных. Цель исследования:Рассмотреть этиологию и патогенез аномальных маточных кровотечений, их современную терминологию и классификационные системы, опираясь на данные руководств и исследований последних лет, что позволит систематизировать знания исследователей и клиницистов о данной проблеме, выбрать оптимальный метод терапии. Материалы и методы:Нами был проведен анализ литературных данных по проблеме аномальных маточных кровотечений, опубликованных за последние 10 лет. Были использованы следующие источники: PubMed, Elibrary, Scopus. Результаты:Анализ литературных источников продемонстрировал, что проблема аномальных маточных кровотечений актуальна и находится в центре внимания клиницистов, исследователей, международных гинекологических обществ, рассматривается в международных рекомендациях. Использование единой терминологии и универсальной классификационной системы аномальных маточных кровотечений, предложенной Международной федерацией гинекологии и акушерства, позволило систематизировать знания об этой проблеме, разрешить трудности в проведении научных исследований и разработке стандартов ведения больных. Заключение:Международная федерация гинекологии и акушерства рекомендует для классификации причин аномальных маточных кровотечений использовать систему PALM-COEIN, которая включает структурные и неструктурные причины кровотечения, исключая гестационные причины. Этиологический диагноз определяет метод терапии маточных кровотечений и напрямую связан с успехом лечения. Знание основ патогенеза развития маточного кровотечения при тех или иных состояниях позволит разработать новые инструменты диагностики и мониторинга, которые помогут стратифицировать лечение женщин с аномальными маточными кровотечениями, особенно в отношении «эндометриальных» и «неклассифицированных» причин
Ключевые слова: маточное кровотечение, аномальное маточное кровотечение, тяжелое менструальное кровотечение, полип эндометрия, аденомиоз, миома матки, рак эндометрия, гиперплазия эндометрия
Введение. Согласно клиническим рекомендациям Российского общества акушеров-гинекологов термином аномальное маточное кровотечение (АМК) определяются кровотечения чрезмерные по длительности (более 8 дней), объему кровопотери (более 80 мл) и/ или частоте (менее 24 дней). Нормальный менструальный цикл имеет длительность от 24 до 38 дней, продолжительность менструации находится в пределах от 7 до 9 дней, с потерей от 5 до 80 миллилитров крови [1, 2]. Вариации любого из этих 4 параметров представляют собой аномальное маточное кровотечение (Табл. 1). Кроме того, NICE (National Institute for Health and Clinical Excellence) был предложен термин тяжелое менструальное кровотечение (ТМК), который определяет чрезмерную менструальную кровопотерю, оказывающую негативное влияние на физическое, социальное, эмоциональное и/или материальное благополучие женщины.

Распространенность аномальных маточных кровотечений среди женщин репродуктивного возраста во всем мире оценивается от 3% до 30%, причем более высокая частота встречается в период менархе и перименопаузы. Многие исследования ограничиваются ТМК, но, если рассматривать нерегулярные и межменструальные кровотечения, то распространенность АМК возрастает до 35% и выше. По имеющимся данным около половины женщин с АМК не обращаются за медицинской помощью, даже при ее доступности, что объясняет различия в распространенности этой патологии; некоторые компоненты диагноза являются объективными, а другие – субъективными, что так же затрудняет определение точной распространенности АМК [3, 4]. Несмотря на крайне незначительную смертность, АМК оказывают огромное влияние на физическое, социальное и эмоциональное качество жизни женщины в дополнение к экономическим потерям, включая стоимость медицинского обслуживания и потерю трудоспособности [5, 6]. Более того, АМК являются одной из основных причин анемии и железодефицитного состояния у женского населения, что приводит к увеличению материнской заболеваемости и смертности у беременных женщин с ранее существовавшей анемией [7]. Женщины с нарушениями менструального цикла чаще сообщают о тревоге, депрессии, бессоннице, чрезмерной сонливости и болевом синдроме, чем женщины без проблем с менструальным циклом [8, 9].
Классификация и терминология
Длительное время не существовало единой терминологии и универсальной классификационной системы АМК, что существенно затрудняло проведение научных исследований и разработку стандартов ведения больных. В 2011 г. Международная Федерация гинекологии и акушерства (FIGO – International Federation of Gynecology and Obstetrics) разработала новую классификационную систему АМК – PALM-COEIN.
PALM-COEIN – это аббревиатура, позволяющая классифицировать основные причины аномального маточного кровотечения. Первая часть, «PALM», описывает структурные причины кровотечений. Вторая часть, «COEI», описывает неструктурные причины. «N» означает «не классифицировано иначе».
- Р: полип
- А: аденомиоз
- L: лейомиома
- M: гиперплазия/рак эндометрия.
- С: коагулопатия/нарушение свертываемости крови
- О: овуляторная дисфункция
- E: эндометриальные причины
- I: ятрогенные причины
- N: не классифицировано иначе
Одна или сразу несколько из перечисленных выше причин могут способствовать развитию АМК у одной пациентки. Однако следует учитывать, что некоторые структурные образования, такие как полипы эндоцервикса, полипы эндометрия или лейомиомы, могут протекать бессимптомно и не являться основной причиной АМК [1].
АМК могут проявляться тяжелыми менструальными кровотечениями и межменструальными кровотечениями, ранее обозначавшимися терминами «меноррагия», «менометроррагия», «метроррагия» [2]. Эти термины уже не используются в современной классификационной системе [10].
В соответствии с длительностью кровотечения АМК также можно разделить на острые и хронические. Острое АМК представляет собой чрезмерное кровотечение, требующее незамедлительного медицинского вмешательства для предотвращения дальнейшей кровопотери. Острое AМК может возникать само по себе или развиваться на фоне уже существующего хронического AМК. Для хронического АМК характерны нарушения менструального цикла, существующие в течение большей части предыдущих 6 месяцев [11].
Допустимы специфические изменения в характере менструальных кровотечений, которые могут встречаться в начале и конце репродуктивного периода (то есть в подростковом или перименопаузальном возрасте) [2, 10, 11].
Этиология и патогенез АМК
Любой патологический процесс, приводящий к нарушению нормальных эндокринных, паракринных или гемостатических функций эндометрия, а также к нарушению сократимости миометрия, может вызвать АМК [12].
Полип: АМК-P
Вклад полипов в АМК варьирует в широких пределах от 3,7% до 65%. В то время как полипы эндометрия широко распространены при всех типах АМК, они также часто встречаются у женщин без АМК. Полипы эндометрия представляют собой выросты слизистой оболочки эндометрия, состоящими из моноклонального разрастания стромальных клеток эндометрия с включением неопухолевого железистого компонента. [13] Они могут быть единичными или множественными, в некоторых исследованиях сообщалось о самой высокой частоте полипов в пятом десятилетии жизни. Полипы, как правило, являются доброкачественными новообразованиями эндометрия, но требуется тщательное патоморфологическое исследование, чтобы исключить возможность фокального ракового перерождения в структуре полипа. По некоторым данным у женщин в пременопаузальном периоде до 2-х процентов полипов эндометрия имеют риск ракового перерождения.
Одной из основных причин развития полипов эндометрия является нарушение экспрессии эстрогеновых и прогестероновых рецепторов в эндометрии, усиление активности сигнальных путей, индуцирующих пролиферацию и ангиогенез, снижение апоптоза [14]. Кроме того, генетические мутации и сверхэкспрессия ароматазы эндометрия, которая увеличивает местный эстрогенный сигнал, также участвуют в образовании полипов эндометрия [15, 16]. Небольшие (<1 см) доброкачественные полипы эндометрия часто регрессируют, но более крупные поражения могут длительно сохраняться [17].
Патогенетический механизм увеличения менструальной кровопотери при полипах эндометрия окончательно не изучен. Аномальная густая микрососудистая сеть с выраженными мышечными стенками – это особенность полипов эндометрия, которая является важным диагностическим маркером при патоморфологическом исследовании, и это может дать некоторые объяснения.
Аденомиоз: AМК-A
Аденомиоз является распространенным заболеванием, которое характеризуется наличием желез эндометрия в миометрии, обычно окруженных гипертрофированной гладкой мышцей миометрия [18, 19]. До недавнего времени диагноз зависел от исследования образцов гистерэктомии, и распространенность заболевания колебалась от 5 до 70%. Теперь диагноз может быть также установлен с использованием визуализирующих методов исследования, таких как магнитно-резонансная томография (МРТ) или трансвагинальное ультразвуковое исследование [20, 21]. Аденомиоз наиболее распространен у женщин позднего репродуктивного возраста, имеющих роды в анамнезе [22].
Приблизительно у трети женщин с аденомиозом он протекает бессимптомно. Наиболее распространенным симптомом является ТМК, дисменорея и диспареуния. Исследование образцов гистерэктомии показало, что степень и распространение аденомиоза не влияют на симптомы АМК [23]. Симптомы, о которых сообщают женщины с аденомиозом, неспецифичны, и, поскольку часто существует сопутствующая патология матки, такая как лейомиомы, неясно, могут ли симптомы быть отнесены исключительно к аденомиозу.
Причина АМК при аденомиозе неизвестна. Аденомиоз может влиять на нормальную сократимость миометрия, и это может способствовать возникновению кровотечения. Также сообщается, что доля эндометриальных желез в аденомиозе связана с АМК. Аденомиоз часто связан с другой патологией матки, включая полипы эндометрия, лейомиомы и гиперплазию, и которые также могут быть связаны с ТМК [24].
Хотя большинство женщин с аденомиозом имели роды в анамнезе, в некоторых случаях он может быть связан с бесплодием. У женщин с аденомиозом изменяется популяции лейкоцитов эндометрия: сообщается об увеличении количества макрофагов и естественных киллеров в лютеиновой фазе эндометрия у женщин с рецидивирующей недостаточностью имплантации и аденомиозом, диагностированным с помощью МРТ таза [25].
Патогенез аденомиоза неясен, и были предложены различные объяснения. Наиболее популярной гипотезой является то, что эндометрий проникает в миометрий из базального слоя во время периодов регенерации и заживления. Это может произойти из-за механической травматизации, например, при кюретаже, при которой нарушается граница эндо-миометрия [26]. На аденомиоз также влияют стероидные гормоны. Сообщалось, что очаги аденомиоза экспрессируют более высокие уровни рецепторов эстрогена, чем соответствующий эутопический эндометрий [27, 28], что указывает на высокую чувствительность к эстрогенам в аденомиотических поражениях, приводящих к митозу. Однако есть и другие сообщения, предполагающие, что экспрессия рецепторов эстрогена при аденомиозе ниже, чем в соседнем эндометрии. Ткань аденомиоза также экспрессирует ароматазу, что приводит к локальной выработке эстрогена, что может способствовать дальнейшей стимуляции роста [29].
Альтернативным предположением является, что аденомиоз развивается из остатков Мюллерова протока [30]. Совсем недавно было высказано предположение, что аденомиоз возникает из стволовых клеток, полученных из костного мозга, которые вытесняются через сосудистую сеть или из стволовых клеток в пределах базального слоя эндометрия [31].
Неизвестно, почему у некоторых женщин развивается аденомиоз, а у других - нет. Существует семейная предрасположенность, и в нескольких исследованиях изучались генетические аномалии при аденомиозе. Сообщалось о различных хромосомных и генетических аномалиях при аденомиозе [32]. Недавние исследования указывают на явные аномалии эндометрия при аденомиозе, включая потенциально измененные местные иммунные реакции, повышенную способность эндометрия к инвазии и измененную экспрессию рецепторов стероидных гормонов [33, 34, 35].
Лейомиома: АМК-L
Лейомиомы, обычно называемые «миомами», представляют собой доброкачественные новообразования миометрия и являются самой распространенной опухолью у женщин репродуктивного возраста. Поскольку многие из них не имеют симптомов, распространенность трудно определить. Однако после гистопатологического исследования образцов гистерэктомии лейомиомы были выявлены у 77% [36]. Лейомиомы являются моноклональными опухолями, возникающими из одной клетки. Сообщалось о различных неслучайных хромосомных аномалиях, включая удаление частей 7q, трисомии 12 и перестроек 12q15, 6p21 или 10q22 [37]. Существует семейная предрасположенность, и наличие родственника первой линии родства с миомой увеличивает риск по крайней мере в два раза [38].
Заболеваемость миомой увеличивается в репродуктивном возрасте и достигает пика в пятом десятилетии [39]. По сравнению с нормальным миометрием лейомиомы имеют более высокую концентрацию рецепторов эстрогенов и прогестерона и ароматазы [40, 41].
Миомы могут как не вызывать симптомов вообще, так и, по некоторым данным, у 20-50% женщин давать симптомы, которые можно напрямую отнести к миоме [42]. Наиболее распространенным симптомом является ТМК. Несколько теорий были предложены для объяснения ТМК, которое рассматривается в связи с лейомиомами. К ним относятся увеличенная площадь поверхности матки, увеличенная сосудистая сеть и кровоток в матке, сниженная сократительная способность миометрия, особенно внутренней соединительной зоны, повреждение эндометрия над субмукозными лейомиоматозными узлами и застой крови в миометрии и эндометрии за счет механического сдавления венозного сплетения [43]. FIGO в 2018 году предложена классификация миомы матки в зависимости от местоположения, предполагается, что именно местоположение узла влияет на симптомы, при этом подслизистые лейомиомы имеют большую связь с ТМК (Рис. 1).
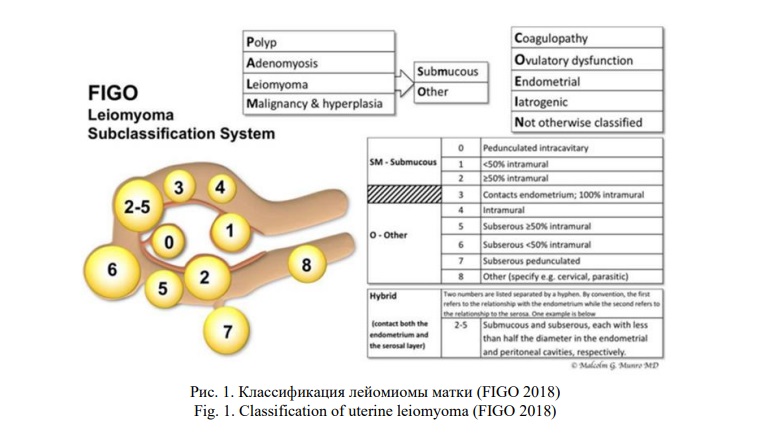
Нарушение регуляции нормальной функции сосудов при лейомиомах может быть связано с нарушениями в экспрессии ангиогенных факторов роста и их рецепторов. В недавнем исследовании кровоток и экспрессия ангиогенных генов были исследованы в миоме, перифиброзе и отдаленном миометрии. Кровоток в ткани вокруг лейомиом был выше, чем внутри лейомиомы. Экспрессия девяти генов, связанных с ангиогенезом, значительно различалась между миомой и отдаленным миометрием, и два гена значительно различались между миомой и перифиброидом [44].
Наличие лейомиом также может влиять на строение вышележащего эндометрия. Когда сравнивали лейкоциты эндометрия, покрывающего лейомиомы, с удаленным эндометрием, количество естественных клеток-киллеров матки было уменьшено в эндометрии, покрывающем лейомиомы во время средней и поздней секреторной фаз, в то время как макрофаги увеличивались в той же области в течение всего менструального цикла [45]. Как естественные клетки-киллеры матки, так и макрофаги являются потенциальными продуцентами ангиогенных факторов роста [46], которые могут влиять на сосуды эндометрия, покрывающего лейомиомы.
Злокачественная опухоль: АМК-М
Дисгормональное состояние, сопровождающееся эстрогеново-прогестеронным дисбалансом, а также чрезмерная и длительная эстрогенная стимуляция, либо факторы предотвращающие противодействующие эффекты прогестерона, будут способствовать чрезмерному росту эндометрия с потенциальным риском развития гиперплазии эндометрия (ГЭ) и канцерогенеза [47].
ГЭ гистологически определяется как аномальное разрастание эндометриальных желез по отношению к стромальному компоненту эндометрия [48]. Согласно ВОЗ в настоящее время ГЭ классифицируется на гиперплазию без атипии (включая простую и сложную гиперплазию) и на атипичную гиперплазию/эндометриоидную интраэпителиальную неоплазию [49]. Разделение на вышеперечисленные категории основано на том, что гиперплазия с атипией клеток является известным предшественником рака эндометрия (РЭ) и проявляет многие мутации, типичные для инвазивной эндометриоидной аденокарциномы [48]. Эстрогенная стимуляция, обычно связанная с овуляторной дисфункцией у женщин в пре- и перименопаузе, является частой причиной ГЭ, которая может наблюдаться у 20-ти процентов женщин с синдромом поликистозных яичников (СПЯ) с олигоменореей, а при наличии атипии в 30 процентах случаев может нести риск развития или сосуществования с РЭ [50]. К факторам риска ГЭ и РЭ также следует отнести ожирение, бесплодие, отсутствие родов, селективные модуляторы рецепторов эстрогена, диабет и синдром Линча [48].
Патогенетические механизмы развития АМК при ГЭ до конца не изучены. Одним из вариантов, объясняющим развитие АМК, является отсутствие обычного снижения уровня прогестерона, чтобы инициировать отторжение утолщенной ткани эндометрия; пролиферативная активность в эндометрии и, возможно, обильный кровоток, необходимый для ускоренного роста эндометрия; все это может вызвать длительное, сильное кровотечение.
Карцинома эндометрия является наиболее распространенным гинекологическим заболеванием в западном мире. Согласно классификация Бохмана до настоящего времени сохраняется разделение РЭ на эндометриоидные и неэндометриоидные гистологические подтипы. Эндометриоидный подтип опухолей (подтип 1) возникает на фоне ГЭ, связанной с гиперэстрогенией, часто сопровождающейся цитологической атипией. Эти опухоли наблюдаются в связи с избыточной продукцией эстрогенов, например, при ожирении и СПЯ. Напротив, неэндометриоидные опухоли (подтип 2) возникают на фоне атрофического эндометрия и не являются эстрогензависимыми. К этой группе опухолей относят серозный рак матки и прозрачно-клеточную карциному и, как правило, имеют неблагоприятный прогноз [51].
РЭ является редкой причиной АМК, так РЭ наиболее часто встречается в постменопаузе, реже наблюдается у женщин в пременопаузе, и наиболее редко встречается у пациенток в возрасте до 40 лет [52]. Тем не менее, РЭ является гормонально-обусловленным заболеванием, и считается, что непрерывный эффект митотического действия эстрогена является основным онкогенным промотором по меньшей мере в 80% случаев рака эндометрия. Таким образом, условия, которые не регулируют последовательное воздействие прогестерона в эндометрии, такие как ожирение, СПКЯ, диабет, эстроген-секретирующие опухоли яичников и использование тамоксифена, среди прочего, увеличивают риск возникновения РЭ [52, 53]. Обычная картина АМК, связанного с РЭ, является нерегулярной и непрерывной. Кровотечение развивается вторично по отношению к разрушению сосудов эндометрия из-за инвазии злокачественными клетками и аномального неоваскулогенеза [51].
Коагулопатия: AМК-С
Сообщается, что коагулопатии поражают 13% женщин с ТМК. Большинство из этих женщин страдают болезнью Виллебранда [54]. Системные нарушения гемостаза могут быть выявлены у 90% женщин при использовании специального структурированного анамнеза [1]. Ранее выделялись 4 клинических варианта AМК-C: 1 – АМК во время антикоагулянтной терапии (в настоящее время это группа АМК-I), 2 – АМК с наследственными нарушениями свертываемости, 3 – АМК, ассоциированное с цитопениями (в частности, тромбоцитопенией), 4 – АМК при серповидноклеточной анемии.
АМК-С, может возникать вторично, но фоне других нозологических форм, самостоятельно вызывающих АМК [55]. Например, компрессия, вызванная большой миомой матки, может привести к венозной тромбоэмболии, поэтому кровотечение, ранее считавшееся AМК-L, может быть усугублено последующей антикоагуляцией, что создает дополнительные проблемы при лечении.
Овуляторная дисфункция: AМК-O
Ановуляторные циклы могут вносить вклад в АМК за счет неконтролируемого воздействия эстрогена на эндометрий, которое вызывает его заметную пролиферацию и утолщение, что приводит к обильным менструальным кровотечениям и измененной частоте менструации. Как правило, АМК-О наблюдается в крайних случаях репродуктивного возраста: во время менархе и перименопаузы, но может проявляться и на любом этапе репродуктивной жизни. В эту группу также можно отнести нарушения менструального при эндокринопатиях: синдроме поликистозных яичников (СПЯ), гиперпролактинемии, гипотиреозе, а также такие состояния, как ожирение, анорексия, потеря веса, психическое перенапряжение и экстремальные физические нагрузки.
СПЯ является распространенным гинекологическим состоянием, сопровождающимся ановуляцией, ожирением, гиперандрогенией и развитием АМК. В периферической жировой ткани происходит трансформация андрогенов в эстрогены, что приводит к длительной гиперэстрогенной стимуляции эндометрия во время ановуляторного цикла [56].
Другим патологическим состоянием, получившим в настоящее время широкое распространение и нарушающим нормальное гормональное равновесие в эндометрии, является ожирение. В результате опосредованного ароматазой жировой ткани превращения андростендиона, секретируемого надпочечниками, в эстрон обеспечивается дополнительная поставка эстрогенов для эндометрия [57].
Наркотическая зависимость, которая влияет на уровень дофамина, также в настоящее время входит в эту категорию. AМК-O - это диагноз исключения, для его постановки следует исключить другие структурные и функциональные причины AМК.
Эндометриальная дисфункция: AМК-E
В настоящее время до конца не изучены регуляторные механизмы инициации и прекращения менструального кровотечения. Реэпителизацию поверхности эпителия в настоящее время нельзя считать основным фактором прекращения кровотечения [58], так как получены данные гистологических исследований, подтверждающие, что полная реэпителизация часто наблюдается уже в 1 и 2 дни менструального цикла, несмотря на сохраняющееся менструальное кровотечение.
Эндометрий человека является одним из немногих органов взрослого человека, где происходит регулярный физиологический ангиогенез. Механизмы регуляции роста сосудов эндометрия остаются неясными. Предполагается, что фактор роста эндотелия сосудов (Vascular endothelial growth factor, VEGF), продуцируемый внутрисосудистыми нейтрофилами [59]. Патологический ангиогенез приводит к формированию аномальных кровеносных сосудов с хрупкими стенками и способствует развитию АМК. Недавнее исследование сообщило, что, хотя количество сосудов не отличалось между контролем и АМК, была изменена экспрессия маркеров дифференцировки гладких мышц сосудов при АМК [60].
Ятрогенные причины: AМК-I
Ятрогенные причины AМК включают экзогенную терапию, которая может привести к маточному кровотечению. Сюда относят AМК, связанные с использованием системной фармакотерапии или внутриматочных систем или устройств. В дополнение к половым стероидам, таким как эстрогены, прогестины и андрогены, и агентам, которые непосредственно влияют на их продукцию или функцию, в эту категорию в настоящее время входят нестероидные лекарственные препараты, которые способствуют нарушениям овуляции, препараты, которые влияют на метаболизм дофамина, включая фенотиазины и трициклические антидепрессанты. В первоначальной классификации женщины с АМК, связанные с применением антикоагулянтов, были классифицированы в группу коагулопатий - АМК-С; в новом пересмотре они считаются ятрогенными и классифицируются как AМК-I [1]. Эта группа препаратов включает антагонисты витамина К и современные пероральные прямые антикоагулянты. Недавние исследования показали повышенный риск АМК при использовании ривароксабана по сравнению с другими пероральными прямыми антикоагулянтами или варфарином. Повышенный риск АМК при приеме ривароксабана имел место среди женщин без гинекологических заболеваний [61, 62].
Не классифицированные иначе: АМК-N
Категория «АМК-N», «не классифицированная как-либо иначе» была создана в исходной системе для размещения объектов, которые встречаются редко или плохо определены. Они включают, но не ограничиваются такими состояниями, как артериовенозные мальформации, нишу после кесарева сечения, гипертрофию миометрия, а также другие нарушения состояния эндометрия, которые в настоящее время нельзя определить с помощью стандартных методов диагностики [2, 54].
В настоящее время FIGO рекомендует клиницистам и исследователям рассмотреть возможность использования диагностической матрицы для оценки пациентов с АМК в репродуктивном возрасте [1] (Рис. 2).
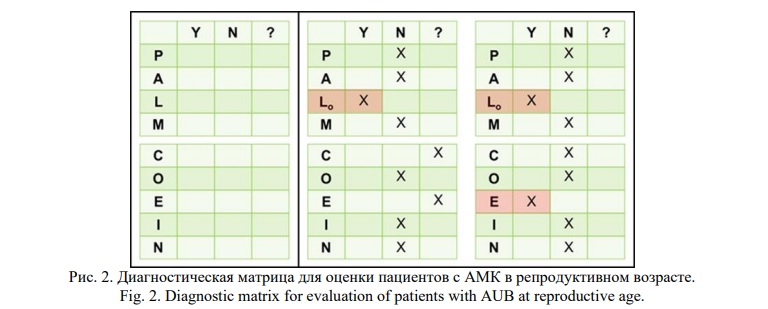
В упрощенной диагностической матрице каждый из основных элементов системы классификации перечисляется в столбце слева. Если пациент не был полностью оценен по потенциальной причине, он указан в столбце под знаком «?». Если оценка не продемонстрировала никаких признаков аномальности, помечается столбец «N», и, если оценка положительная, знак X помещается в соответствующий сектор.
Заключение. Международная федерация гинекологии и акушерства рекомендует основывать классификацию причин АМК на системе PALM-COEIN, которая включает структурные и неструктурные причины маточного кровотечения, исключая гестационные причины. Этиологический диагноз определяет выбор метода терапии при АМК и напрямую связан с успехом лечения. Знание основ патогенеза развития маточного кровотечения при тех или иных состояниях позволит разработать новые инструменты диагностики и мониторинга, которые помогут стратифицировать лечение женщин с АМК, особенно в отношении «эндометриальных» и «неклассифицированных» причин.




















Список литературы