Роль молекулярно-генетических изменений структуры гена CDH1 в развитии рака желудка у пациентов из Республики Башкортостан
Aннотация
Актуальность: Рак желудка (РЖ) является одним из тяжелейших заболеваний, занимающего лидирующие позиции среди причин смерти от злокачественных новообразований в мире. В Республике Башкортостан (РБ) также зарегистрированы высокие показатели заболеваемости и смертности по злокачественным новообразованиям желудка. К одному из основных генов, обуславливающих высокий риск предрасположенности к данной патологии, относится ген CDH1. Цель исследования:Поиск изменений последовательности нуклеотидов в гене CDH1 у больных раком желудка из Республики Башкортостан. Материалы и методы:Материалом для исследования послужили образцы ДНК больных РЖ и здоровых доноров, проживающих в РБ. Геномную ДНК выделяли из лимфоцитов периферической крови методом фенольно-хлороформной экстракции. Амплификацию проводили с использованием специфичных праймеров, фланкирующих изучаемый экзон. Исследование экзонов на наличие изменений нуклеотидной последовательности проводили методами SSCP и HRM. Для верификации молекулярно-генетических изменений использовали метод секвенирования по Сэнгеру. Результаты:В 11-ом экзоне гена CDH1 выявлен генетический вариант rs35741240 (c.1680G>C, p.Thr560=). Среди больных выявлено 4 пациента – носителя аллеля С в гетерозиготном состоянии (1,33%), частота встречаемости генотипа GC среди здоровых лиц составила 0,67% (2 человека). В 12-ом экзоне гена CDH1 такжеобнаружен редкий полиморфный локус rs33969373 (c.1896C>T, p.His571=). Вариант выявлен также в гетерозиготном состоянии, частота генотипа СТ в группе больных составила 1,00% (3 человека), среди контроля – 0,33% (1 человек). В 14 экзоне гена CDH1 выявлен синонимичный полиморфный локус rs33964119 (c.2253C>T, p.Asn751=). Показано, что данный вариант в гетерозиготном состоянии встречается у 24 пациентов (8,00%), а среди здоровых лиц частота генотипа CT составила 5,33% (16 человек). Статистически значимых различий в распределении частот аллелей и генотипов выявленных локусов между группами больных и контроля не выявлено (p>0,05). Заключение:Нами обнаружены ранее известные синонимичные изменения нуклеотидной последовательности в экзонах 11, 12 и 14 гена CDH1 (rs35741240, rs33969373, rs33964119, соответственно). Ни одно из выявленных изменений не является патогенным
Ключевые слова: рак желудка, ген CDH1, генетический вариант, поиск изменений нуклеотидной последовательности, секвенирование
Введение. Злокачественные новообразования – это одна из опаснейшей угроз для здоровья и жизни людей во всем мире. Поиск причин возникновения рака, новых способов его профилактики, ранней диагностики и терапии является приоритетной задачей для современного общества.
Рак желудка (РЖ) – тяжелое онкологическое заболевание. Распространенность злокачественных новообразований желудка в России в 2020 г. составила 94,8 случаев на 100000 населения. Летальность больных в течение года с момента установления диагноза «рак желудка» составила 44,5% и заняла 3 место в структуре онкозаболеваний. Согласно эпидемиологическим исследованиям, в Республике Башкортостан (РБ) также регистрируются высокие показатели по заболеваемости и смертности от РЖ [1]. Пятилетняя выживаемость для пациентов с РЖ при диагностировании заболевания на 3-4 стадиях составляет не более 50% [2].
Известны ряд генов, таких как CDH1, MLH1, MSH2, STK11, PT53, наследуемые патогенные варианты которых с высокой долью вероятности (1-70%) могут приводить к развитию опухолей желудка у их носителей. При этом показано, что именно мутации в гене CDH1 ассоциированы с самым высоким риском развития собственно наследственного диффузного рака желудка (HDGC), характеризующегося развитием диффузного перстневидно-клеточного рака желудка в раннем возрасте [3, 4]. Ген CDH1 кодирует E-кадгерин, трансмембранный гликопротеин типа I, обеспечивающий межклеточную адгезию в эпителиальных тканях млекопитающих. Патогенные варианты гена E-кадгерин часто способствует нарушению межклеточной адгезии, увеличению миграционного и инвазивного потенциала эпителиальных клеток, наблюдаемых при характерных опухолях желудка [5].
Впервые мутации в гене CDH1 были выявлены в соматических клетках при РЖ диффузного типа, но при этом не были обнаружены при опухолях желудка интестинального типа. Показано, что мутации зародышевой линии CDH1 присутствуют у 25% пациентов с HDGC и наследуются по аутосомно-доминантному типу. Соматические мутации CDH1 могут быть у 50% пациентов со спорадической диффузной карциномой желудка (SDGC), а эпигенетическая инактивация гена CDH1 обнаруживается при разных типах опухолей [6-9].
В России 2020 году опубликованы результаты исследования таргетного секвенирования ряда генов в образцах ДНК опухоли желудка. Ученые установили положительную взаимосвязь соматических мутаций гена CDH1 с отдаленными метастазами и перстневидно-клеточным РЖ. Кроме того, была описана связь патогенных вариантов данного гена с диффузным типом опухоли желудка [10].
Однако среди различных типов опухолей РЖ выявлены противоречивые результаты. Данные, полученные учеными из Кореи, показывают, что отсутствует достоверная связь между герминальной мутацией p.V832M гена CDH1 и гистологическим типом новообразования желудка [11]. Исследование, проведенное в Испании, показало значимую ассоциацию высокого уровня экспрессии гена CDH1 и интестинального типа РЖ [12].
Рак желудка, как и другие онкологические заболевания, характеризуется популяционно-генетической гетерогенностью. Для понимания вклада гена CDH1 в формировании наследственной предрасположенности к раку желудка важным и актуальным представляется анализ нуклеотидной структуры данного гена в выборках различных этнических групп. Выявление специфических герминальных генетических вариантов позволит понять важность использования их для превентивной диагностики РЖ.
Цель исследования. Поиск изменений последовательности нуклеотидов гена CDH1 у пациентов с раком желудка из Республики Башкортостан.
Материал и методы исследования. В качестве материала для исследования использованы образцы ДНК больных РЖ и здоровых доноров в возрасте от 30 до 80 лет, жителей РБ. Выборка больных состояла из 300 человек с установленным клинически диагнозом «рак желудка», находящихся на лечении в ГАУЗ «Республиканский клинический онкологический диспансер» г. Уфа. Диагноз поставлен на основании данных клинического и гистологического обследования. Распределение согласно этнической принадлежности среди пациентов с РЖ было следующим: 130 русских, 141 татар, 29 башкир. Контрольная группа состояла из 300 респондентов без признаков заболеваний желудочно-кишечного тракта, соответствующие по распределению этнической принадлежности (143 русских, 129 татар, 28 башкир) группе больных. Распределение респондентов по полу было следующим: среди больных – 163 мужчины и 137 женщин, среди контроля – 150 мужчин и 150 женщин. В зависимости от гистологического описания, степени дифференцировки опухоли, пациенты с РЖ были разделены по подгруппам: высоко- и умереннодифференцированный РЖ (137 пациентов), низкодифференцированный и недифференцированный РЖ (163 пациента).
Испытуемые заполнили анкеты, включающие данные об этнической принадлежности, год рождения, статус курения, тип питания, наличие у близких родственников отягощенности по РЖ или другим онкологическим заболеваниям.
ДНК была выделена из лимфоцитов периферической крови методом фенольно-хлороформной экстракции, полимеразная цепная реакция синтеза ДНК проводилась на приборе «GeneAmp PCR System 2720» («Applied Biosystems», США). Каждый экзон амплифицировали с помощью специфичных праймеров, описанных ранее Valente A.L. с соавт [13]. Скрининг на наличие изменений последовательности нуклеотидов в гене CDH1 в исследуемых образцах проводили методами SSCP-анализа (SSCP – single strand conformation polymorphism) и HRM-анализа (High resolution melting analysis) на приборе CFX96 Touch™ Real-Time PCR Detection System (США) с использованием красителя Eva Green (Biotium Inc, Hayward, CA). Верификацию выявленных изменений подвижности однонитевой ДНК и/или температуры плавления выполняли с помощью секвенирования по Сэнгеру на автоматическом секвенаторе Genetic Analyzer 3500 Аppliеd Biosystеms (США). Полученные хроматограммы анализировали с использованием программного обеспечения SnapGene Viewer.
Анализ частоты встречаемости генетических вариантов в контрольной группе проводили методом аллель-специфичной ПЦР. Список исследованных локусов и последовательности специфичных олигонуклеотидных праймеров представлены в таблице 1 (Табл. 1). ПЦР-продукты разделяли с помощью электрофореза в 7% полиакриламидном геле/

Статистическую обработку результатов исследования выполняли с использованием MS Office Excel. При сравнении частот аллелей и генотипов между разными группами применяли критерий χ2 для таблиц сопряженности 2 × 2 с поправкой Йейтса.
Результаты и их обсуждение. Ген CDH1 является основным геном-кандидатом РЖ. Изучение генетических вариантов данного гена в различных популяциях является актуальной задачей. Проведенный нами поиск различий нуклеотидной последовательности в данном гене выявил у больных РЖ и здоровых индивидов из Республики Башкортостан варианты в 11-ом, 12-ом и 14-ом экзонах.
HRM-анализ образцов ДНК больных РЖ 11-го и 12-го экзонов гена CDH1 выявил по 4 и 3 образца, соответственно, с различиями в температуре плавления, в 14-ом экзоне изменения были найдены у 25 пациентов. Плавление и SSCP-анализ образцов в остальных экзонах не показало каких-либо видимых отличий в уровнях флуоресценции и/или изменении подвижности однонитевой ДНК. Последующий анализ секвенирования по Сэнгеру образцов с измененным профилем плавления в 11-ом, 12-ом и 14-ом экзонах гена исследованного гена подтвердил наличие изменений в нуклеотидной последовательности описываемых кодирующих областей.
При исследовании экзона 11 гена CDH1 у четырех пациентов обнаружен редкий синонимичный полиморфный локус rs35741240 (c.1680G>C; p.Thr560=) (Рис. 1).

Среди больных РЖ носителями аллеля C в гетерозиготном состоянии варианта c.1680G>C являлись 4 человека С (1,33%), два их них русской этнической принадлежности и два татарской. По данным гистологического исследования два пациента характеризовались перстневидноклеточным РЖ, один – низкодифференцированной аденокарциномой и еще один – умереннодифференцированным плоскоклеточным раком. Данный полиморфный локус ранее был описан рядом исследователей. В 2017 году опубликованы результаты работы, проведенной учеными из Новой Зеландии, которые провели анализ нуклеотидной последовательности гена CDH1 у 94 пациентов с РЖ и 200 здоровых доноров из числа населения Маори, выявили полиморфный локус rs35741240. Два представителя контрольной группы являлись носителями гетерозиготного по данному изменению генотипа GC, при этом носителей альтернативного аллеля C среди больных РЖ выявлено не было [14]. Bustos-Carpinteyro A.R. с коллегами в 2019 году при поиске соматических мутаций в гене CDH1 у пациентов с диффузным и смешанным спорадическим РЖ из Мексики обнаружили и подтвердили 13 соматических генетических вариантов. Среди прочих изменений авторы выявили у пациента с диффузным РЖ полиморфный локус rs35741240, также отметив, что он не является патогенным, поскольку не приводит к замене кодируемой аминокислоты [15].
Нами было также проведено генотипирование выявленного изменения в группе здоровых доноров и выявлены 2 человека (0,67%) с генотипом GC полиморфного локуса rs35741240.
При исследовании нуклеотидной последовательности 12-го экзона гена CDH1 также обнаружен редко встречающийся ранее известный синонимичный полиморфный локус rs33969373 (c.1896C>T; p.His571=) (Рис. 2).
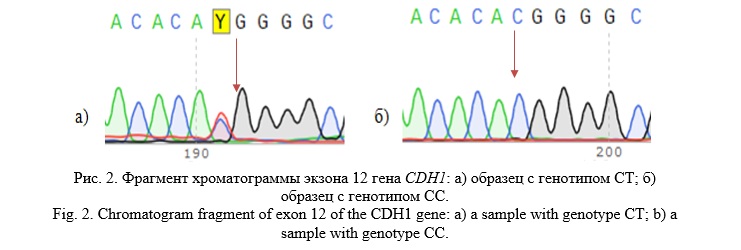
Частота гетерозиготного генотипа СТ полиморфного локуса rs33969373 в группе больных составила 1,00%, встретившись у 3 человек: одного русского и двух татар. Гистологическое исследование показало у двух больных умеренно дифференцированный рак желудка, у одного – низкодифференцированную аденокарциному.
В работе 2010 года у больных с наследственным диффузным РЖ из Польши описаны несколько «молчащих» мутаций, среди которых у 56 индивидов выявлен часто встречающийся генетический вариант c.2076T>C и у двух человек – редкие полиморфные локусы, c.2253C>T, c.1896C>T, c.2634C>T [16]. Описание данного локуса также имеется в упомянутой ранее работе Hakkaart C., где показано, что rs33969373 встречается у одного пациента с РЖ у двух здоровых доноров Новой Зеладнии [14]. Ученые из Бразилии в 2019 году опубликовали данные о наличии данной однонуклеотидной замены c.1896 C>T у больных РЖ, классифицируя ее как полиморфный вариант. В данной работе среди зародышевых изменений гена CDH1 у пациентов с РЖ также не было обнаружено патогенных вариантов [17].
Анализ оценки частоты встречаемости данного локуса среди индивидов контрольной группы нашего исследования выявил 1 человека с гетерозиготным по локусу rs33969373 генотипом СT (0,33%).
В 14 экзоне гена CDH1 у 24 пациентов нами был выявлен синонимичный полиморфный локус rs33964119 (c.2253C>T; p.Asn751=) (Рис. 3).
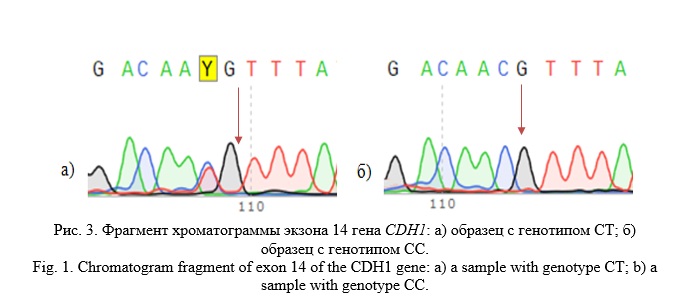
Данный вариант встречается у 24 пациентов (8,00%) – девять представителей русской этнической принадлежности, десять татар, пять башкир. Согласно гистологическому анализу двенадцать пациентов имели низкодифференцированную аденокарциному, четыре – умеренно дифференцированную, два – высокодифференцированную аденокарциному, у двух человек диагностирован перстневидно-клеточный РЖ, также были выявлены больные с недифференцированным аденогенным РЖ, плоскоклеточным РЖ, нейроэндокринной опухолью желудка, тубуло-папиллярной аденомой с переходом в рак в поверхностных отделах.
Ранее полиморфный локус rs33964119 (c.2253C>T) был описан исследователями из Тайваня, которые при анализе гена CDH1 у населения острова со спорадическим диффузным и интестинальным типами РЖ выявили ряд генетических вариантов с отсутствием значимого функционального эффекта, среди которых был 2253C>T [18]. Позже гетерозиготный генотип CT по данному локусу был выявлен в Мексике у трех больных (15%) с диффузным типом РЖ и у одного больного со спорадическим типом болезни. Исследователи также отмечают, что несмотря на локализацию варианта rs33964119 в кодирующей области, синонимичный характер замены не предполагает патогенного эффекта [15]. В 2019 году опубликованы данные об обнаружении однонуклеотидной замены c.2253C>T у четырех пациентов с диффузным типом ых РЖ из Чили, где регистрируются одни из самых высоких в мире показатели по заболеваемости и смертности от данной онкопатологии [19].
Проведенная оценка частот встречаемости замены rs33964119 (c.2253 C>T) гена CDH1 с помощью аллель-специфичной ПЦР в группе здоровых доноров показала, что данный вариант встречается у 16 человек (5,33%).
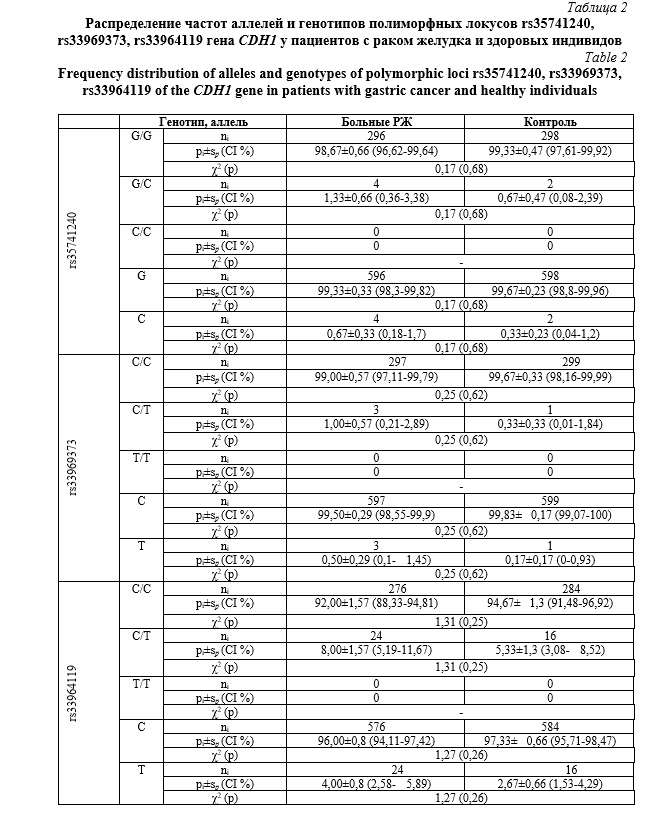
По всем трем выявленным полиморфным локусам rs35741240, rs33969373, rs33964119 гена CDH1 нами было проведено сравнение распределения частот аллелей и генотипов между выборками пациентов с РЖ и контроля (Табл. 2). В результате не было выявлено статистически значимых различий между сравниваемыми группами (p>0,05).
Заключение. Данное исследование было направлено на поиск изменений нуклеотидной структуры гена CDH1 с целью выявления функционально-значимых генетических маркеров, ассоциированных с раком желудка у жителей Республики Башкортостан. Выявлены три полиморфных локуса rs35741240 в экзоне 11, rs33969373 в экзоне 12 и rs33964119 в экзоне 14. Все обнаруженные нами генетические варианты являются доброкачественными, не приводящими к изменению аминокислоты в последовательности кодируемого белка, и ранее были установлены у пациентов с раком желудка и здоровых индивидов из других стран. Данные однонуклеотидные варианты, вероятно, не играют ключевую роль в развитии заболевания у исследованных индивидов.
Информация о финансировании
Исследование выполнено при поддержке «Государственное задание Министерства науки и высшего образования РФ №075-03-2021-193/5».




















Список литературы