Гериатрическая тактика ведения пациентов с диабетической ретинопатией
Aннотация
Актуальность: Диабетическая ретинопатия остаётся одной из ведущих причин нарушения зрения, однако дефицитарный профиль данных пациентов, за исключением когнитивных и тревожно-депрессивных нарушений, остаётся практически неизученным. Нуждается в обосновании также гериатрическая тактика ведения пациентов с диабетической ретинопатией. Цель исследования:Обоснование и оценка эффективности гериатрической тактики ведения пациентов с диабетической ретинопатией. Материалы и методы:В клинических условиях обследовано 244 пациента, страдающих диабетической ретинопатией, среди которых выполнены комплексная офтальмологическая и гериатрическая оценка в соответствии с рекомендациями Российской ассоциации геронтологов и гериатров. Изучены ведущие клинические гериатрические синдромы у 244 пациентов с диабетической ретинопатией и 200 пациентов без этого заболевания. С учётом выполненной комплексной гериатрической оценки научно обоснована и реализована гериатрическая тактика ведения пациентов с диабетической ретинопатией (основная группа, n=127). Контролем служили 117 пациентов с диабетической ретинопатией, которым выполнены стандартные лечебные мероприятия. Оценка результативности проведенного лечения проведена через 1 год. Результаты:Среди пациентов с диабетической ретинопатией статистически значимо чаще диагностировались синдром риска падений 64,2±3,1 против 12,5±2,3 случаев среди пациентов без диабетической ретинопатии на 100 обследованных, синдром падений 45,0±3,2 случаев против 19,5±2,87 случаев на 100 обследованных, тревожно-депрессивный синдром 65,8±3,2 случаев против 41,5±3,5 случаев на 100 обследованных, нарушений общей двигательной активности 47,9±3,2 против 18,5±2,7 случаев на 100 обследованных. Применение в основной группе гериатрической тактики ведения, включающей коррекцию зрительного дефицита, синдрома падений и риска падений, нормализацию сна, проведение курсов психотерапии, применение для улучшения гериатрического и оксидативного статуса «Тыквеола», применение «Сулодексида» для коррекции гемоциркуляторных нарушений, позволило существенно снизить частоту дефицитарных синдромов и прежде всего синдрома риска падений до 34,4±4,2 против 60,0±4,6 случаев на 100 пролеченных в контрольной группе, синдрома падений до 23,2±3,8 случаев против 36,5±4,5 случаев, тревожно-депрессивного синдрома до 32,8±4,2 случаев против 57,4±4,6 случаев соответственно. Заключение:Гериатрическая тактика ведения пациентов с диабетической ретинопатией является более эффективной
Введение. В 2020 году примерно 596 миллионов человек во всем мире имели нарушение зрения вдаль, а ещё 510 миллионов – нарушен6ие зрения вблизи [1]. При этом одной из ведущих причин нарушения зрения вдаль и вблизи экспертами называется диабетическая ретинопатия (ДР). По оценке исследователей, в 2020 году 4,4 миллиона человек имели различные нарушения остроты зрения в результате ДР. Однако это число невелико по сравнению с 160 миллионами людей, страдающих ДР, или примерно 463 миллионами людей, живущих с сахарным диабетом в 2019 году, всем из которых требуется регулярный доступ к получению офтальмологической помощи для снижения долгосрочного риска потери зрения.
Распространенность ДР увеличивается с ростом частоты сахарного диабета во всем мире, особенно в развивающихся странах [2, 3]. Несмотря на то, что существуют различные подходы к оценке распространенности ДР обзор современных публикаций по многим странам свидетельствует о значительной частоте обсуждаемой нозологии, варьирующей в широком диапазоне – от 10,3% в Индии до 76,7% в Южной Америке. Мета-аналитическое исследование, проведенное в США, Австралии, Европе и Азии показало, что у 34,6% обследованных была та или иная форма ДР. Признаки ДР выявлены у 79,3% людей с диабетом 1-го типа и 82,3% с диабетом 2-го типа [4]. Прогнозируется, что число людей с диабетической ретинопатией увеличится со 171 миллионов в 2000г. до 336 миллионов в 2030г., которое приведет к росту частоты ДР [5].
Гериатрический статус пациентов, страдающих ДР различной формы и стадии, на сегодняшний день остается малоизученным. Среди дефицитарных состояний при ДР в немногочисленных научных публикациях представлена информация о депрессии и когнитивных нарушениях. Результаты исследований о связи ДР и когнитивных нарушений неоднозначны [5]. Коррекция вышеназванных и других дефицитарных состояний у пациентов с ДР практически не осуществлялась, что способствует их прогрессированию и снижению функциональной активности, повышению зависимости от окружающих при выполнении бытовых и социальных задач. Кроме того, ухудшение гериатрического статуса при отсутствии должной коррекции сопровождается снижением качества жизни пациентов с ДР и приводит к дополнительным социально-экономическим расходам со стороны государства [5, 6]. Следовательно, обоснование гериатрического подхода к ведению пациентов, страдающих ДР, и анализ его результативности представляется актуальным.
Цель исследования. Обоснование и оценка эффективности гериатрической тактики ведения пациентов с ДР.
Материалы и методы исследования. Настоящее исследование проведено в Тамбовском филиале ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России в 2020-2021гг. среди 244 пациентов с ДР в сравнении с 200 пациентами без ДР. Диагностика ДР осуществлялась в соответствии с критериями, представленными в рекомендациях Американского общества диабетологов [7] и «Национальном руководстве по ДР» [8].
Гериатрический статус пациентов с ДР изучен посредством комплексной гериатрической оценки [9]. Среди обследованной группы пациентов изучены следующие дефицитарные синдромы: синдром саркопении, синдром гипомобильности, мальнутриции старческой астении, риска падений, падений, слабый или умеренный болевой синдром, нарушение общей двигательной активности, психологические проблемы, когнитивные нарушения, тревожно-депрессивный синдром, синдром нарушения сна, нарушения мочеиспускания, зрительный дефицит. Последний выявлялся по стандартной методике на основе таблиц Сивцева-Головина с определением остроты зрения без коррекции и максимально корригированной остроты зрения. Индекс старческой астении определялся с учетом приказа Министерства здравоохранения Российской Федерации от 29 января 2016г. №38н «Об утверждении Порядка оказания медицинской помощи населению по профилю «Гериатрия»» [10]. Синдром старческой астении диагностирован на основе модели Rockwood [11]. Когнитивные нарушения изучены посредством шкалы Mini Mental State Examination [12]. Качество сна исследовано при помощи Питтсбургского индекса качества сна. Тревожно-депрессивный синдром выявлялся с помощью теста Спилбергера-Ханина [13].
Обоснование гериатрической тактики ведения пациентов с ДР проведено на основе анализа распространенности и степени тяжести клинических гериатрических синдромов. Для оценки результативности предложенной гериатрической тактики ведения пациентов с ДР сформировано две группы пациентов: основная группа (n=127) и контрольная группа (n=117). В основной группе реализована гериатрическая тактика, а в контрольной группе – стандартная терапия. Анализ результатов выполнен через 1 год.
При проведении исследования получено письменное согласие на участие пациентов в обследовании и лечении.
Для статистического анализа применялась программа «Statistica 10.0» и непараметрический критерий Т-Уайта. Различие считалось статистически значимым при Р≤0,05.
Результаты и их обсуждение. Изучение распространенности основных клинических гериатрических синдромов в старших возрастных группах пациентов с наличием и отсутствием ДР выявило статистически значимые различия по некоторым из них и неодинаковую частоту.
Последняя среди пациентов 75-89 лет с рассматриваемой офтальмопатологией наиболее высока для синдрома гипомобильности по отношению к группе возрастного контроля (Р>0,05). У пациентов старческого возраста с ДР в сравнении с пациентами аналогичного возраста без неё высокую распространенность имеют психологические проблемы (Р<0,01), синдром когнитивных нарушений (Р>0,05), синдром нарушения сна (Р>0,05), синдром саркопении (Р>0,05), синдром старческой астении (Р<0,001). Практически одинаковая распространенность в сопоставляемых группах старческого возраста присуща слабому и умеренному болевому синдрому (Р>0,05) и синдрому нарушений мочеиспускания (Р>0,05). Среди пациентов 75-89 лет с ДР частота основных клинических гериатрических синдромов статистически значимо выше по сравнению с пациентами старческого возраста без ДР. Данное заключение относится к синдрому риска падений, синдрому падений, нарушений общей двигательной активности, тревожно-депрессивному синдрому (Табл. 1). Следовательно, ДР протекает с более выраженными нарушениями, что необходимо учитывать при реализации гериатрических мероприятий.
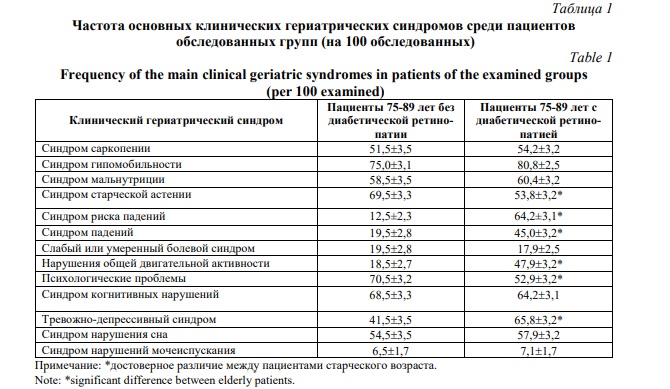
Несущественно различается распространенность синдрома мальнутриции, который почти одинаково диагностируется у больных с обсуждаемой офтальмологической патологией. Значительно отличается также в сравниваемых группах больных с ДР частота нарушений общей двигательной активности с доминированием у пациентов 75-89 лет с ДР. Эти и другие достоверные различия в распространенности изученных клинических гериатрических синдромов убедительно свидетельствуют о том, что ДР в старческом возрасте протекает с более выраженными нарушениями гериатрического статуса. Кроме того, наличие статистически значимых различий в частоте гериатрических синдромов между пациентами старческого возраста с ДР и с её отсутствием показывает на вклад рассматриваемого офтальмозаболевания в формирование этих гериатрических синдромов, что необходимо учитывать в офтальмологической и гериатрической практике.
Для коррекции функциональных дефицитов, ассоциированных у пациентов 75-89 лет с ДР, и с учётом особенностей гериатрического статуса, обусловленного высокой распространенностью синдрома падений, падений, нарушения общей двигательной активности и тревожно-депрессивного синдрома, дополнительно к лечебно-диагностическим мероприятиям, предусмотренным «Клиническими рекомендациями Сахарный диабет: ретинопатия диабетическая, макулярный отек диабетический», использовалась предложенная нами комплексная гериатрическая схема ведения, предусматривающая:
- разработку и использование информационных листов для пациентов и родственников по расширению в рационе питания продуктов, богатых полиненасыщенными жирными кислотами, витамином D;
- для коррекции синдрома риска падений и синдрома падений, выполнение упражнений на устойчивое равновесие;
- обучение выполнению и сохранению способности к сложно-двигательным актам, таким как медленные разворот в левую и правую сторону, перешагивание через низкий бордюр, поочередное касание правой и левой ногами пола по 2-3 минуты 5-10 раз в день;
- нормализация сна немедикаментозными средствами (гигиеническая гимнастика, релаксация, использование теплых ванн перед сном, методики «квадратное» дыхание);
- проведение курсов психотерапии лицензированным специалистом в период пребывания в офтальмологическом стационаре по 2 сеанса ежедневно с пролонгацией по месту жительства;
- проведение общепринятых мероприятий по коррекции когнитивных функций, а также выполнение движений в руках с мелкой моторикой в виде хаотично–чередующегося прикосновения кончиками пальцев кончиков (ногтевых фаланг) других пальцев руки, изображения пальцами рук окружностей, треугольников и других геометрических фигур, выполнение вышеуказанных движений в синхронном и асинхронном режимах правой и левой руками;
- применение для улучшения гериатрического и оксидативного статуса «Тыквеола» по 450 мг 2 раза в сутки на протяжении 2-х месяцев с повторением курсов через полгода;
- улучшение антиоксидантной защиты за счет увеличения потребления продуктов, обладающих выраженными антиоксидантными свойствами;
- применение препарата «Сулодексид» по 600 ед. внутримышечно 1 раз в день в течение 10 дней, а затем по 1 капсуле (250 ед.) 2 раза в день на протяжении 40 дней.
Сравнивая эффективность реализованных вариантов лечения у пациентов старческого возраста с ДР в аспекте влияния на распространенность основных клинических гериатрических синдромов необходимо отметить большую результативность предложенной нами гериатрической тактики. Последняя позволила уменьшить достоверно распространенность большего числа изученных клинических гериатрических синдромов, тогда как в контрольной группе на фоне стандартного протокола лечения улучшение гериатрического статуса не произошло по клиническим гериатрическим синдромам, частота которых к концу наблюдения имела тенденцию к снижению.
Среди изученных клинических гериатрических синдромов пациентов контрольной группы наибольшее улучшение функционального статуса произошло по синдрому гипомобильности и синдрому нарушения сна, частота которых практически одинаково уменьшилась после лечения, а также по синдрому когнитивных нарушений. Однако по другим клиническим гериатрическим синдромам, исследованным нами, значимых изменений на момент завершения наблюдений также не выявлено.
В основной группе больных 75-89 лет с ДР более существенно, в сравнении с рассмотренным ранее контролем, улучшился гериатрический статус. Это произошло за счет снижения распространённости, прежде всего, таких клинических гериатрических синдромов как синдром риска падений, падений, нарушений общей двигательной активности, синдром нарушения сна, распространенность которых уменьшилась после проведенного лечения (Р<0,001) (Табл. 2).
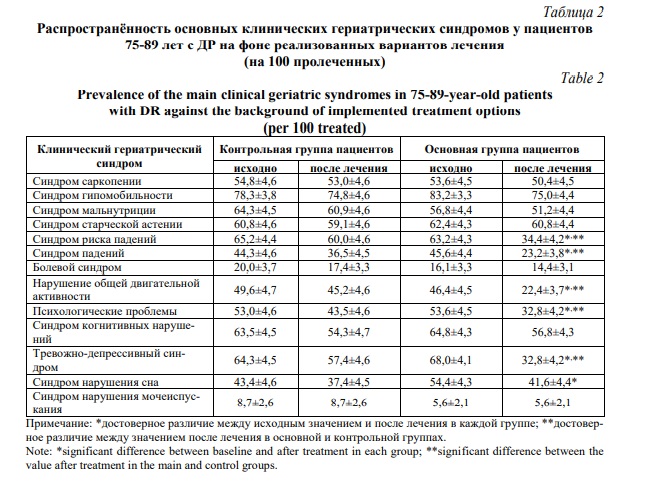
Значительное снижение частоты после завершения лечения пациентов основной группы присуще также тревожно-депрессивному синдрому. В одинаковой степени гериатрическая тактика ведения пациентов старческого возраста обусловила уменьшение распространенности синдрома падений и нарушений общей двигательной активности с достоверным различием как к исходному показателю, так и к значению после завершения наблюдения. В меньшей степени, но статистически значимо понизилось число больных с психологическими проблемами в основной группе. Вместе с тем по таким серьезным клиническим гериатрическим синдромам как синдром саркопении, мальнутриции, гипомобильности и старческой астении на фоне гериатрической тактики у больных старческого возраста с ДР достоверной динамики не отмечалось.
Следовательно, снижение зрительного дефицита у пациентов основной группы с ДР сопровождается достоверным улучшением гериатрического статуса по некоторым клиническим гериатрическим синдромам и прежде всего за счет синдрома падений, риска падений, тревожно–депрессивного синдрома и нарушения общей двигательной активности, чем у пациентов после стандартного лечения. Такой результат снижения частоты основных клинических гериатрических синдромов следует рассматривать как преимущество созданной и реализованной гериатрической тактики ведения пациентов старческого возраста, страдающих ДР, способствовавшей существенному улучшению дефицитарного профиля пациентов основной группы. Это также подтверждается и снижением распространенности клинических гериатрических синдромов в основной группе.
Превосходство проведенного лечения у пациентов 75-89 лет с ДР в основной группе подтверждается и средней частотой основных клинических гериатрических синдромов на 100 больных с достоверной динамикой распространенности после завершения наблюдения в сравнении с исходным показателем (Рис. 1).
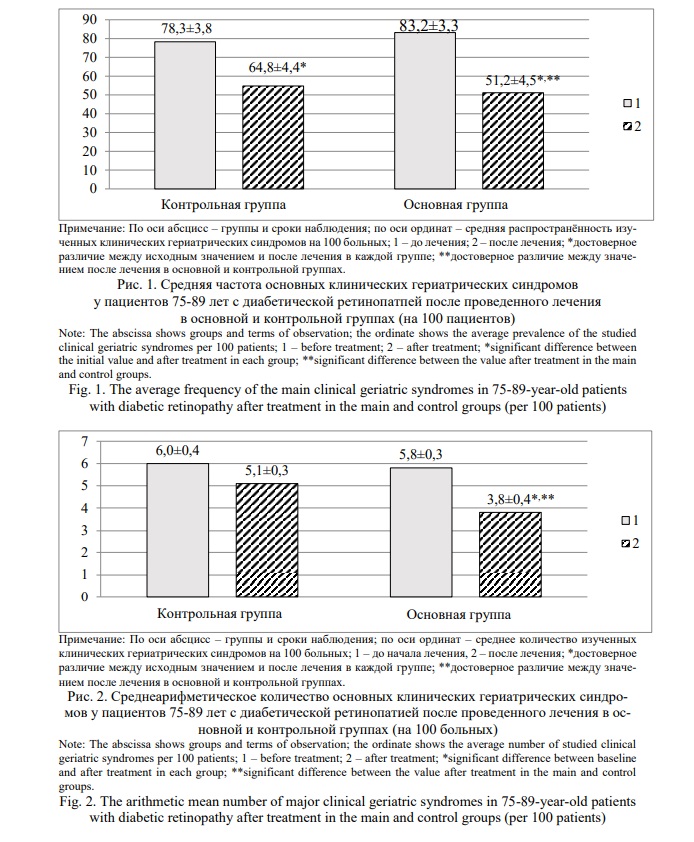
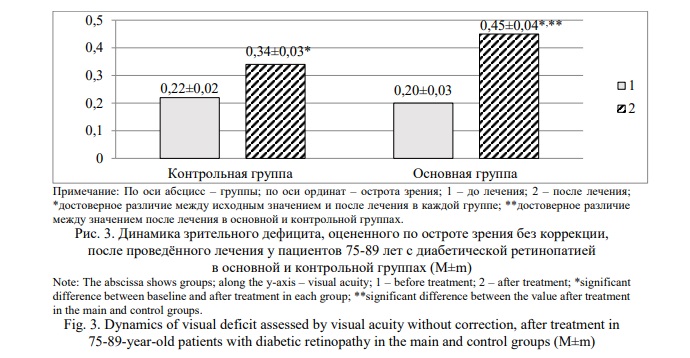
В основной группе средняя распространенность рассматриваемых клинических гериатрических синдромов к концу наблюдения уменьшилась в 1,63 раза, а в контрольной группе – в 1,20 раза. Статистически достоверное снижение средней частоты основных клинических гериатрических синдромов после завершения лечебных мероприятий в сравнении с исходным показателем произошло в обеих группах. Средняя распространенность анализированных клинических гериатрических синдромов на момент окончания лечения в сравниваемых группах достоверно различалась. Среднеарифметическое количество клинических гериатрических синдромов, приходящихся на 1-го пациента старческого возраста после завершения лечения ДР, статистически значимо уменьшилось только в основной группе (Рис. 2).
В контрольной группе, несмотря на тенденцию к снижению среднеарифметического числа клинических гериатрических синдромов, оно не достигло достоверной разницы. Кроме того, средняя величина клинических гериатрических синдромов после завершения лечения была достоверно ниже у пациентов 75-89 лет с ДР основной группы (Р<0,001) и свидетельствует о снижении зрительного дефицита существеннее в этой когорте. Сам же зрительной дефицит по остроте зрения без коррекции изменился после использованных вариантов лечения неоднозначно (Рис. 3).
В исследовании [14] обнаружена обратная взаимосвязь между статусом ретинопатии и оценками когнитивных способностей в том, что участники с отсутствием или легкой ДР, имели более низкую общую когнитивную функцию и имели дефицит внимания, ориентации, памяти, речи и зрительно-пространственных способностей по сравнению с участниками с более тяжелой формой. Эти данные предполагают, что общего патологического процесса когнитивных нарушений и ДР может не быть, и возникает вопрос, почему пациенты с более обширной ДР могут демонстрировать лучшую когнитивную способность. В проспективном исследовании изучалось влияние интенсивного контроля гликемии на осложнения диабета при диабете 2-го и 1-го типа соответственно, и оба показали дозозависимую связь между контролем гликемии и риском развития ДР. Продемонстрированная инверсия этой взаимосвязи с точки зрения познания предполагает, что мозг (или по крайней мере, части мозга, которые регулируют когнитивные функции) могут по-разному реагировать на повышенный уровень глюкозы. Возможно, из-за того, что мозг потребляет большую долю доступной глюкозы, он может быть менее восприимчив к повреждению тканей, связанных с глюкозой. Действительно, было постулировано, что мозг может предпочесть более высокие уровни глюкозы.
Однако этот аргумент противоречит влиянию повышенного содержания глюкозы на другие нервные ткани, где существует связь между глюкотоксичностью и невропатическим повреждением. Эта взаимосвязь очевидна поскольку в группе ДР было значительно больше нейропатии, чем в группе без или легкой ДР. Исследования на животных также свидетельствуют о том, что высокие концентрации глюкозы увеличивают метаболический стресс и повреждают ткани головного мозга, хотя доказательства этого у людей неоднозначны.
Таким образом, вклад глюкотоксичности в когнитивные нарушения неясен. Гликированный гемоглобин не оказал значительного эффекта в окончательной модели, и когда гликемический контроль как независимая переменная для когнитивной функции, то обнаружено, что больные с ДР с более высокими значениями гликированного гемоглобина лучше справлялись с когнтивным тестированием, чем участники с более низкими показателями. Следовательно, необходимы дополнительные исследования, чтобы установить роль гипергликемии в когнитивной функции [15].
В других исследованиях [5, 9], напротив сообщается о наличии связи когнитивных нарушений с развитием ДР и даются патогенетические обоснования таким ассоциациям. В многофакторном анализе пациентов с ДР и частотой когнитивной дисфункции обнаружено, что вероятность возникновения последней любой стадии и тяжести более чем в два раза выше – ОШ=2,32 (ДИ 1,07-5,03) [5]. У пациентов с препролиферативной и пролиферативной ДР шансы развития когнитивных нарушений увеличиваются в три раза – ОШ=3,41 (ДИ 1,06-11,00) по сравнению с пациентами без ДР.
ДР может увеличивать риск умеренных когнитивных нарушений, а частое возникновение умеренных когнитивных нарушений среди пациентов с ДР стало актуальным для многих исследователей. Доказано, что развитие когнитивных нарушений при ДР обусловлено повышенным уровнем гликированного гемоглобина поэтому ДР считается основным фактором риска когнитивного дефицита.
Некоторые китайские ученые считают, что когнитивная дисфункция у пациентов с диабетом 2-го типа связана с микросусудистыми осложнениями диабета. Исследования показали, что на ранней стадии ДР патологические изменения слоя нервных волокон предшествуют микроангиопатии сетчатки [16]. Механизм заключается в том, что набухание нервных клеток вызывает сжатие окружающих микрососудов и стеноз [17].
О связи ДР с депрессией обнаружено крайне мало публикаций, в которых имеются противоречивые данные. В нескольких клинических исследованиях сообщалось, что распространенность депрессии значительно отличается у пациентов с ДР как 1-го, так и 2-го типа диабета. Поперечное исследование в Китае показало, что 35,7% пациентов с ДР имели СД 2-го типа от легкой до тяжелой степени. В исследовании ДР среди белых неиспаноязычных людей исследователи обнаружили, что 45,0% пациентов с ДР принимали какие-либо антидепрессанты. Ситуация, по-видимому, хуже для афроамериканцев: исследование показало, что 50% пациентов с ДР при 2 типе имели депрессию различной степени тяжести. Эта более высокая распространенность может быть связана с более низким уровнем практики лечения диабета и психических расстройств среди афроамериканцев, особенно пожилых людей, по сравнению с белыми. Несмотря на то, что во многих исследованиях изучалась распространенность депрессии у пациентов с ДР, они были основаны на небольших популяциях из той же этнической группы, или ограничивались стационаром. Более того, в опубликованных исследованиях использовались различные шкалы степени тяжести для депрессии, что затрудняло получение согласованных оценок. Кроме того, в большинстве клинических испытаний игнорировалась классификация степени тяжести ДР. Следовательно, точная связь между депрессией и ДР отсутствует. По этим причинам результаты исследований сильно различались. Таким образом, большие популяционные исследования различных рас и возрастных групп с классификацией степени тяжести ДР и стандартной шкалой оценки депрессии необходимы для полного понимания взаимосвязи между депрессией и ДР [3].
Не установлено связи между ДР у пациентов и развитием депрессии [3], поскольку уровень депрессии был сопоставим с контрольной группой (Р=0,215). На развитие депрессии у больных с ДР не повлияли пол, хронотип, индекс массы тела, сезон года, дневная сонливость и качество сна. Однако эти факторы не оказали значимого воздействия на формирование тревожности при ДР, несмотря на то, что уровень тревожности был у них выше по сравнению с контролем (p<0,0001) и тревожность повышалась с возрастом.
Однако о высокой распространенности тревоги и депрессии у пациентов с ДР по шкале госпитальной тревоги и депрессии (HADS) сообщается в публикациях Zhang B. et al [18]. Величина HADS-D составила 7,14±3,84 балла, а HADS-A-7,74±3,82 балла соответственно. У 34,3% и 41,1% пациентов, страдающих ДР в возрасте 28-86 лет наблюдались клинические значимые симптомы депрессии (HADS-D≥9) и тревоги (HADS-A≥9) соответственно, из которых 24,8% имели симптомы депрессии и тревоги.
Таким образом, у пациентов с ДР изучены когнитивные нарушения, депрессия и тревожность, в отношении которых получены противоречивые результаты. Другие дефицитарные синдромы при ДР не рассматривались и требуют изучения в новых исследованиях.
Заключение. Осуществление разработанной гериатрической тактики ведения пациентов с ДР свидетельствует о её эффективности и превосходстве над стандартной терапией, направленной только на коррекцию зрительного дефицита. Реализованная гериатрическая тактика среди пациентов основной группы привела к статистически значимому снижению распространенности синдрома риска падений, синдрома падений, нарушений общей двигательной активности, психологических проблем и тревожно-депрессивного синдрома по сравнению как к исходному показателю, так и в сравнении с контрольной группой через 1 год наблюдения. Преимущество предложенного подхода подтверждается также и более существенным уменьшением в основной группе средней частоты основных клинических гериатрических синдромов. Всё это указывает на то, что гериатрическая тактика ведения пациентов с ДР обеспечивает улучшение их гериатрического статуса и имеет, безусловно, практическое значение.




















Список литературы