Ассоциации полиморфных вариантов генов-кандидатов с развитием H. pylori-негативной язвенной болезни двенадцатиперстной кишки у жителей Центрального Черноземья России
Aннотация
Актуальность: Язвенная болезнь (ЯБ) – это хроническое рецидивирующее заболевание, протекающее с чередованием периодов обострения и ремиссии, ведущим проявлением которого служит образование дефекта (язвы) в стенке желудка и двенадцатиперстной кишки. Наследственная предрасположенность является одним из этиопатогенетических факторов развития ЯБ, следовательно, требуется изучение генетических детерминант заболевания. Цель исследования: Изучить роль специально отобранных для исследования 9 полиморфных вариантов генов-кандидатов Н. pylori-негативной ЯБ ДПК (GWAS-значимые для ЯБ: rs2294008 PSCA, rs505922 ABO; гены молекул клеточной адгезии, патогенетически значимые для развития Н. pylori-негативной ЯБ ДПК: rs6136 SELP; rs8176720, rs2519093, rs507666 ABO; rs651007, rs579459, rs649129 ABO/RF00019) в развитии Н. pylori-негативной ЯБ ДПК у жителей Центрального Черноземья России. Материалы и методы: Объем выборки: 78 больных Н. pylori-негативной ЯБ ДПК, 347 лиц контрольной группы. Регуляторный потенциал выбранных для исследования локусов оценивался с помощью интернет-реcурсов HaploReg v4.1, PolyPhen-2 и GTEx Portal. Анализ ассоциаций проводился методом логистической регрессии в рамках аллельной, аддитивной, доминантной и рецессивной генетических моделей. Результаты: Аллель С гена SELP (rs6136) (аллельная модель: OR=1,88; 95%CI 1,13-3,13; pperm=0,024; аддитивная модель: OR=1,77; 95%CI 1,06-2,96; pperm=0,023; доминантная модель: OR=1,93; 95%CI 1,06-3,53; pperm=0,043) и аллель С гена PSCA (rs2294008) (рецессивная модель: OR=2,34; 95%CI 1,34-4,08; pperm=0,003) ассоциированы с повышенным риском развития Н. pylori-негативной ЯБ ДПК. Полиморфный вариант rs6136 SELP и 1 сильно сцепленный (r2≥0,8) с ним SNP влияют на экспрессию генаF5 и альтернативный сплайсинг гена BLZF1. Полиморфизм rs2294008PSCA и 48 сильно сцепленных (r2≥0,8) с ним локусов оказывают действие на экспрессию 11 генов (ARC, CTD-2292P10.4, JRK, LY6D, LY6K, LYNX1, LYPD2, PSCA, RP11-706C16.7, SLURP1, THEM6) и альтернативный сплайсинг 4 генов (JRK, LY6D, LYNX1, THEM6). Указанные гены играют роль в ключевых этиопатогенетических процессах при язвенной болезни: рост и деление клеток, посттрансляционная модификация гликозилфосфатидилинозитол-заякоренных белков, клеточная адгезия, реакции иммунной системы, активность никотиновых ацетилхолиновых рецепторов, гемостаз. Заключение: Аллель С гена SELP (rs6136) и аллель С гена PSCA (rs2294008) ассоциированы с повышенным риском развития Н. pylori-негативной ЯБ ДПК.
Введение. Язвенная болезнь (ЯБ) – это хроническое рецидивирующее заболевание, протекающее с чередованием периодов обострения и ремиссии, ведущим проявлением которого служит образование дефекта (язвы) в стенке желудка и двенадцатиперстной кишки [1]. Поражение двенадцатиперстной кишки (ДПК) характерно для лиц 30-55 лет [2], и регистрируется в 4 раза чаще, чем поражение желудка [1].
Согласно современным представлениям, образование язвенного дефекта происходит при нарушении равновесия между защитными факторами (бикарбонаты, простагландины, слизистый барьер, адекватное кровообращение слизистой оболочки) и агрессивными (инфекция H. рylori, кислотно-пептический фактор, прием НПВС) с перевесом последних [3-6]. Наряду с курением, употреблением алкоголя, несоблюдением режима и структуры питания, нарушением нервно-гуморальной регуляции, вклад в повышение активности кислотно-пептического фактора вносят наследственные факторы, в т.ч. за счет гиперплазии париетальных и увеличения количества гастрин-продуцирующих клеток [6]. Таким образом, изучение генетических детерминант ЯБ ДПК представляется весьма интересным.
В настоящее время в литературе имеется информация только о двух GWAS-исследованиях ЯБ [7, 8]. В них приводятся значимые ассоциации 10 локусов 8 генов: PSCA (rs2294008, rs2976388), АВО (rs505922, rs687621), MUC6 (rs78459074), FUT2 (rs681343), CCKBR (rs10500661), MUC1 (rs147048677), GAST (rs34074411), CDX2 (rs9581957) с развитием патологии. Из этих локусов для rs2294008 и rs505922 проведены репликативные исследования [9, 10, 11], причем с ЯБ ДПК значимо ассоциирован лишь полиморфизм rs2294008 [10, 11]. Изучение ассоциаций различных генов с развитием ЯБ ДПК разрозненны, неоднозначны и нередко противоречивы [12-17].
Для изучения ассоциаций с развитием ЯБ ДПК представляют интерес гены молекул клеточной адгезии в связи с их ролью в развитии хронического воспалительного процесса [18]. Согласно GWAS-исследованиям, обнаружена связь более 20-ти SNPs с уровнем молекул клеточной адгезии в плазме крови, причем в большинстве работ показана значимая роль полиморфизма гена ABO (rs579459, rs8176719, rs651007, 8176746, rs2519093, rs649129, rs507666) [19-29]. А учитывая ассоциации полиморфных локусов гена ABO (rs505922 и rs687621) с риском развития ЯБ по данным полногеномных исследований [7, 8], можно предположить наличие связи между полиморфными вариантами, детерминирующими уровень молекул клеточной адгезии и, в том числе, расположенными в регионе гена АВО, c риском развития ЯБ. Данное предположение нуждается в подтверждении в генетико-эпидемиологических исследованиях ЯБ. Также необходимо проведение репликативных исследований GWAS-значимых для ЯБ полиморфных локусов в различных популяциях России, так как до настоящего времени эти исследования не проводились.
Цель исследования. Изучить ассоциации однонуклеотидных полиморфизмов (ОНП) генов-кандидатов (rs2294008 PSCA, rs505922 ABO, rs6136 ABO, rs8176720 ABO, rs2519093 ABO, rs507666 ABO, rs651007 RF00019/ABO, rs579459 RF00019/ABO, rs649129 RF00019/ABO) с развитием Н. pylori-негативной ЯБ ДПК.
Материалы и методы исследования. Формирование выборки проводилось на базе гастроэнтерологического отделения ОГБУЗ «Белгородская областная клиническая больница Святителя Иоасафа» после подписания каждым участником добровольного информированного согласия на включение его в исследование. Все обследуемые лица - коренные жители Центрального Черноземья РФ русской национальности, между которыми отсутствует родство. Группа больных Н. pylori-негативной ЯБ ДПК составила 29 женщин и 49 мужчин (всего 78 человека). Контрольная группа: 230 женщин и 117 мужчин (всего 347 человек). В обеих группах средний возраст участников исследования составил 48 лет. Каждому из них проведено клиническое, лабораторное и инструментальное обследование (эзофагогастродуоденоскопия с биопсией), выделение ДНК из периферической крови. Все отобранные 9 полиморфных вариантов генов-кандидатов имеют выраженный регуляторный потенциал по данным онлайн-баз данных HaploReg v4.1, GTEx Portal и PolyPhen-2 и являются GWAS-значимыми: ассоциированные с ЯБ rs2294008, rs505922 [7], ассоциированные с уровнем молекул клеточной адгезии в сыворотке крови (rs6136, rs8176720, rs2519093, rs507666, rs651007, rs579459, rs649129) [20-29]. Генотипирование на термоциклере CFX-96 (Bio-Rad) проведено методом полимеразной цепной реакции, наборы реагентов, подготовлены ООО «ТестГен» (г. Ульяновск) [30]. Проведено популяционно-генетическое исследование полиморфных вариантов генов-кандидатов ЯБ, определено соответствие эмпирического распределение генотипов теоретически ожидаемому согласно закону Харди-Вайнберга, рассчитаны частоты минорных аллелей по каждому из рассматриваемых локусов. Анализ ассоциаций однонуклеотидных полиморфизмов (ОНП) генов-кандидатов Н. pylori-негативной ЯБ ДПК осуществлен с помощью метода логистической регрессии в рамках 4х генетических моделей (аллельной, аддитивной, доминантной и рецессивной) с учетом коррекции на ковариаты (пол, возраст, индекс массы тела) (программа gPLINK v2.050http://zzz.bwh.harvard.edu/plink/). Характер ассоциаций оценивался с помощью отношения шансов (OR – odds ratio) и его 95% доверительного интервала (95%CI). При OR>1 ОНП определялся как фактор риска развития Н. pylori-негативной ЯБ ДПК, при OR<1 – как фактор защиты. Также был проведен адаптивный пермутационный тест. Достоверными считались результаты при pperm<0,05.
Результаты и их обсуждение. При оценке соответствия эмпирического распределения генотипов теоретически ожидаемому у больных Н. pylori-негативной ЯБ ДПК наблюдается отклонение от равновесия Харди-Вайнберга для полиморфных локусов rs2294008 гена PSCA и rs507666 гена АВО (рhwe=0,014, рhwe=0,041 соответственно), однако при введении поправки Бонферрони на количество анализируемых локусов (n=9, pbonf<0,05/9<0,006 ), распределение генотипов соответствует теоретически ожидаемому как в группе больных Н. pylori-негативной ЯБ ДПК, так и в контрольной группе; частота минорных аллелей по всем изучаемым полиморфным вариантам была больше 5% (Табл. 1).
Изучение ассоциаций аллелей полиморфных локусов генов-кандидатов с развитием заболевания показало значимую роль аллеля С гена SELP (rs6136) (OR=1,88; 95%CI 1,13-3,13; p=0,014; pperm=0,024; Nperm=797) (Табл. 2).
При рассмотрении трех генетических моделей обнаружена ассоциация аллеля С гена PSCA (rs2294008) (рецессивная модель: OR=2,34; 95%CI 1,34-4,08; p=0,003; pperm=0,003; Nperm=6608) и аллеля С гена SELP (rs6136) (аддитивная модель: OR=1,77; 95%CI 1,06-2,96; p=0,030; pperm=0,023; Nperm=820; доминантная модель: OR=1,93; 95%CI 1,06-3,53; p=0,032; pperm=0,043; Nperm=437) с повышенным риском развития Н. pylori-негативной ЯБ ДПК (Табл. 3).
Наши данные согласуются с полногеномными исследованиями ЯБ ДПК [7]: реплицирован локус rs2294008 PSCA среди жителей Центрального Черноземья России, показана роль GWAS-значимого полиморфизма rs6136 SELP, ассоциированного с уровнем Р-селектина (p=1×10-25, p=3×10-105) [26, 27] и его растворенной формы (р=4,05×10-61) [23], в развитии Н. pylori-негативной ЯБ ДПК.
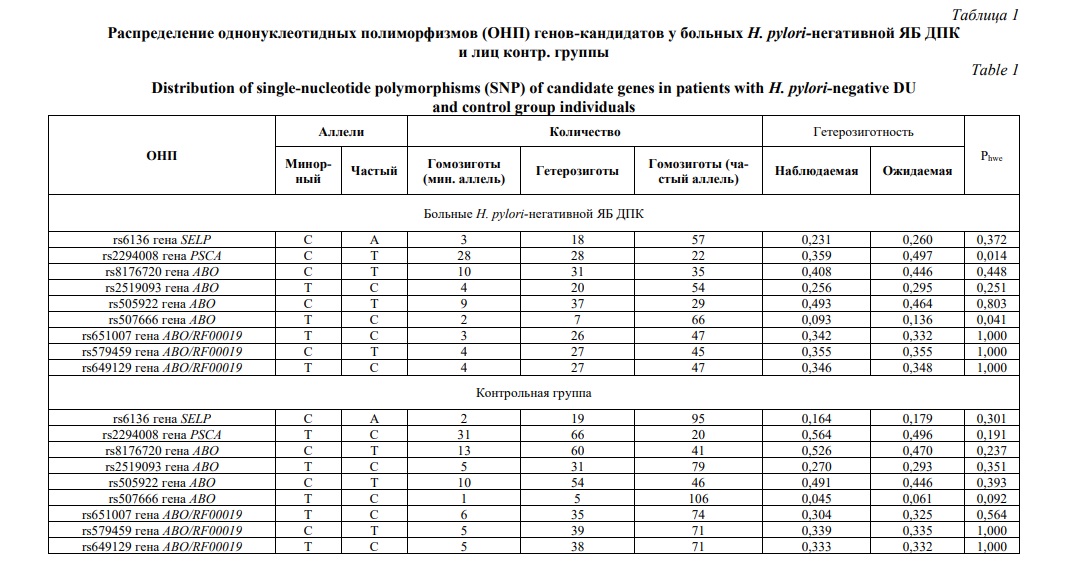
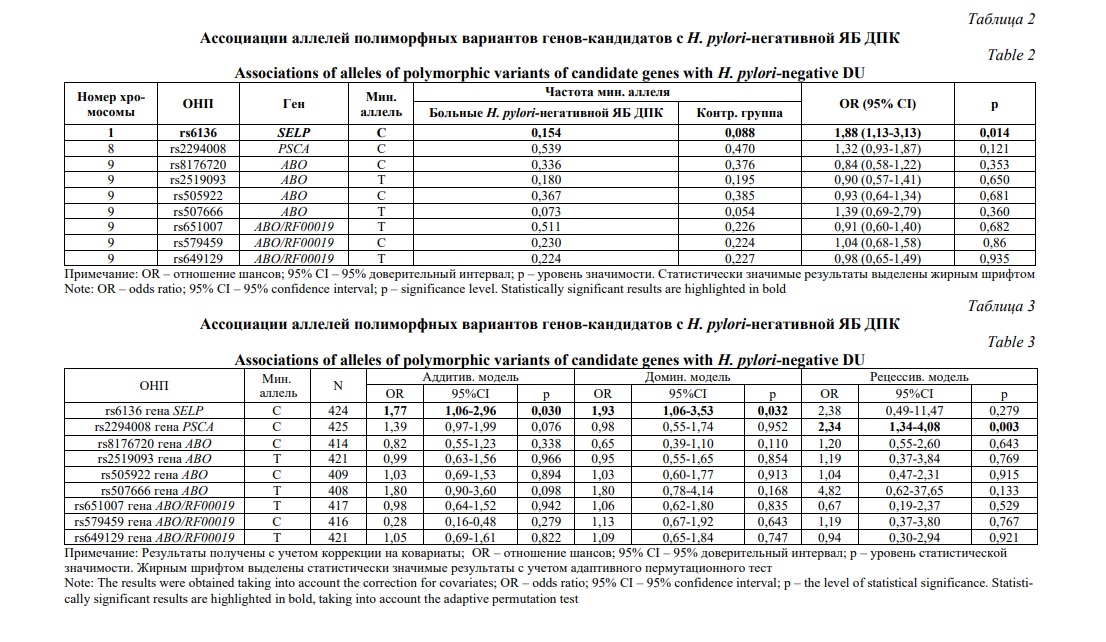
Полиморфный вариант rs6136 SELP приводит к замене треонина на пролин. Предикторный потенциал данной миссенс-мутации, по данным онлайн-ресурса PolyPhen-2 обозначен как вероятно патогенный (score=0,758; чувствительность=0,85; специфичность=0,92). Локус rs6136 находится в областях гистоновых белков, маркирующих промоторы и энхансеры, гиперчувствительности к ДНКазе и связывания с регуляторными белками NFKB, EBF1, PAX5N19. Один сильно сцепленный (r2≥0,8) с ним rs9332575 локализован в регионах гистоновых белков, маркирующих энхансеры, и 8 регуляторных мотивов (HaploReg v4.1). Оба варианта влияют на экспрессию гена F5 (кровь: p=7,7е-7, NES=-0,19, слизистая оболочка пищевода: p=0,00019, NES=-0,28) (Рис. 1) и альтернативный сплайсинг гена BLZF1 (Рис. 2) (слизистая оболочка пищевода: Intron Id 169368362:169369473:clu_52454, NES=0,36, p=0,0000066) (GTEx Portal).
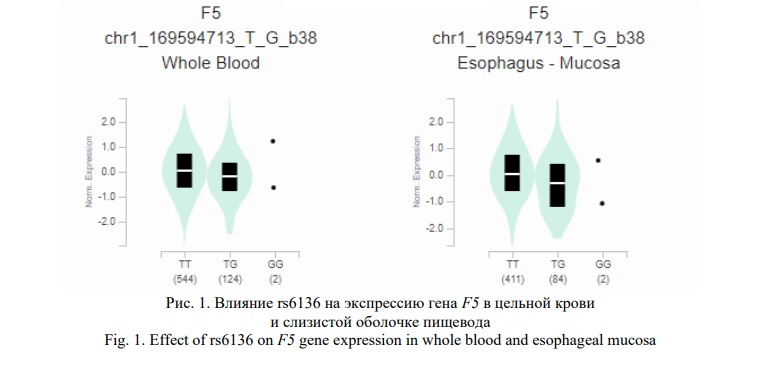
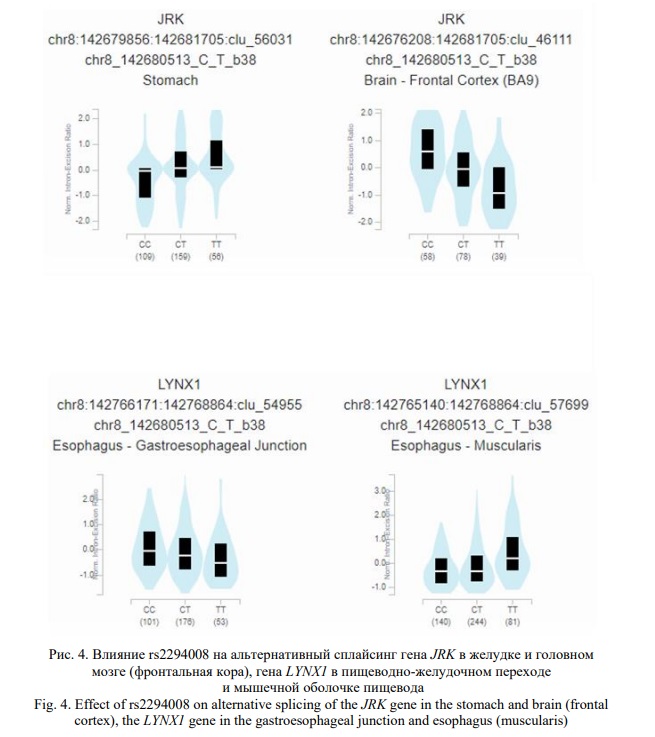
Полиморфизм rs2294008 PSCA и 48 сильно сцепленных с ним SNPs (r2≥0,8) также имеют выраженный регуляторный потенциал. В эволюционно консервативном районе находится rs2294008, 35 и 43 локуса располагаются в областях гистоновых белков, маркирующих промоторы и энхансеры соответственно, 42 – в регионах гиперчувствительности к ДНКазе, 12 и 43 – в районах связывания с регуляторными белками и регуляторными мотивами соответственно (HaploReg v4.1). Согласно базе GTEx Portal, эти 49 SNPs оказывают влияние на экспрессию 11 генов (ARC, CTD-2292P10.4, JRK, LY6D, LY6K, LYNX1, LYPD2, PSCA, RP11-706C16.7, SLURP1, THEM6) (например, ген PSCA - желудок: p=2,4е-48, NES=0,64; слизистая оболочка пищевода: p=8,1е-45, NES=0,33, и др.) (Рис. 3) и альтернативный сплайсинг 4 генов (JRK, LY6D, LYNX1, THEM6) (например, ген JRK – желудок: Intron Id 142679856:142681705:clu_56031, NES=0,47, p=2,2e-8; ген LYNX1 – гастро-эзофагеальное соединение: Intron Id 142766171:142768864:clu_54955, NES=-0,29, p=0,0000050 и др.) (Рис. 4).
При развитии Н. pylori-негативной ЯБ ДПК (в условиях отсутствии инфекции) ограниченный по площади язвенный дефект (некроз) может возникнуть при локальной ишемии слизистой оболочки двенадцатиперстной кишки. Прочие этиопатогенетические факторы (нарушение моторики гастро-дуоденальной зоны, изменение уровня соляной кислоты, стрессовые состояния, вегетативные нарушения, несоблюдение режима питания с длительными перерывами между приемами пищи и едой всухомятку) – вспомогательные. Их роль заключается в усилении неблагоприятного действия ишемии до критического уровня с последующим образованием некроза слизистой оболочки. Нарушение кровообращения в слизистой оболочке двенадцатиперстной кишки возникает вследствие врожденной гипоплазии сосудов мелкого и среднего калибра [6, 31]. Генетической основой данного механизма может являться влияние rs6136 на экспрессию гена F5, белковый продукт которого совместно с активированным X фактором свертывания крови участвует в превращении протромбина в тромбин [32, 33].
Р-селектин, относящийся к молекулам клеточной адгезии, является белковым продуктом гена SELP. Его роль заключается во влиянии на взаимодействие активированных эндотелиальных клеток или тромбоцитов с лейкоцитами, т.е. Р-селектин участвует в развитии хронического воспалительного процесса, в том числе при Н. pylori-негативной ЯБ ДПК [18, 32, 33]. В процессах клеточной адгезии и работе иммунной системы также играют роль гены PSCA, LY6K, LYPD2, LY6D за свет их действия на посттрансляционную модификацию гликозилфосфатидилинозитол-заякоренных белков.
При образовании язвенного дефекта имеет важное значение нарушение равновесия между пролиферацией и обновлением клеток. В этих разнонаправленных процессах принимают участие гены PSCA,LY6K, SLURP1, LYPD2 [7, 10, 11, 32, 33].
Таким образом, полиморфные варианты rs6136 и rs2294008 посредством влияния на 14 генов (SELP, F5, BLZF1, ARC, CTD-2292P10.4, JRK, LY6D, LY6K, LYNX1, LYPD2, PSCA, RP11-706C16.7, SLURP1, THEM6) участвуют в процессах роста и деления клеток (PSCA,LY6K, SLURP1, LYPD2) [7, 9, 10, 11, 32, 33, 34], посттрансляционной модификации гликозилфосфатидилинозитол-заякоренных белков, т.е. в клеточной адгезии и реакции иммунной системы (PSCA, LY6K, LYPD2, LY6D) [32, 35], действуют в качестве модуляторов активности никотиновых ацетилхолиновых рецепторов (LYNX1,LY6D, SLURP1, LYPD2) и кофактора в регуляции гемостаза (F5) [32, 33]. Следовательно, rs6136 и rs2294008 действуют на ключевые этиопатогенетические процессы при развитии язвенной болезни [18, 22, 23, 35].
Заключение. Аллель С гена SELP (rs6136) и аллель С гена PSCA (rs2294008) ассоциированы с повышенным риском развития Н. pylori-негативной ЯБ ДПК. Указанные SNPs посредством влияния на экспрессию и альтернативный сплайсинг 14 генов (SELP, F5, BLZF1, ARC, CTD-2292P10.4, JRK, LY6D, LY6K, LYNX1, LYPD2, PSCA, RP11-706C16.7, SLURP1, THEM6) участвуют в ключевых этиопатогенетических процессах при развитии язвенной болезни.
Информация о финансировании
Финансирование данной работы не проводилось.




















Список литературы
DOI: https://doi.org/10.18413/2658-6533-2023-9-1-0-1