Связь однонуклеотидного полиморфизма rs4880 гена SOD2 с развитием микрососудистых осложнений сахарного диабета 2-го типа
Aннотация
Актуальность: Ген супероксиддисмутазы 2 (SOD2) кодирует митохондриальный фермент, главной функцией которого является превращение супероксид-аниона в перекись водорода. Генетически детерминированное снижение активности фермента SOD2 в случае однонуклеотидной замены rs4880 (А>G) может способствовать развитию нарушения редокс-баланса митохондрий бета-клеток поджелудочной железы и других тканей, имеющих патогенетическое значение для возникновения сахарного диабета 2 типа (СД2) и его микрососудистых осложнений. Цель исследования:Провести анализ ассоциаций миссенс-варианта rs4880 SOD2, приводящего к замене валина на аланин в белковом продукте гена,с риском развития СД2 и его микрососудистых осложнений – диабетической ретинопатии (ДР) и нефропатии (ДНФ). Материалы и методы:В исследованиевключено 3206 человек, жителей Центральной России, у 1579 из которых диагностирован СД2. При этом у 991 пациента с СД2 установлено наличие ДР, у 544 больных СД2 выявлена ДНФ. Генотипирование выполнено методом полимеразно-цепной реакции в реальном режиме времени на термоциклере CFX1000 Bio-Rad с использованием TaqMan зондов.Статистический анализ ассоциацийвыполнен с помощью онлайн программы SNPStats. Результаты:Установлена ассоциация минорного аллеля G (OR=1,26, 95% CI=1,02-1,56, P=0,033), а также генотипов А/G и G/G rs4880 (OR=1,51, 95% CI=1,09-2,11, P=0,015) c риском развития ДР у больных СД2 женщин. Статистически значимых ассоциаций rs4880 с СД2 и с развитием ДНФ ни у мужчин, ни у женщин выявлено не было: Р>0.05. По данным транскриптомного анализа поджелудочной железы, нервной и сосудистой тканей (GTEx Portal), вариантный аллель Gсвязан со снижением экспрессии белка MRPL18, необходимого для транспортировки важнейшего компонента рибосом 5S рРНК из цитозоля в митохондрии и обеспечения рибосомального синтеза белка. Заключение:Носительство минорного аллеля rs4880-G является генетическим маркером повышенного риска развития диабетической ретинопатии у женщин с СД2
Ключевые слова: сахарный диабет 2 типа, диабетическая ретинопатия, диабетическая нефропатия, однонуклеотидный полиморфизм, ген SOD2, супероксиддисмутаза 2
Введение. Сахарный диабет 2 типа (СД2) представляет собой серьезное хроническое заболевание, которое развивается на фоне дисфункции инсулин-продуцирующих бета-клеток поджелудочной железы и инсулинорезистентности периферических тканей [1]. За последние двадцать лет общее число больных сахарным диабетом в мире выросло более чем в три раза – с 151 млн человек в 2000 г. до 537 млн человек в 2021 г., при этом абсолютное большинство пациентов имеют СД2 [2]. Если эта тенденция пандемического роста заболеваемости сохранится, то по прогнозам экспертов к 2030 г. число пациентов превысит 643 млн человек, что составит 11,3% населения Земного шара [3].
СД2 характеризуется нарушениями всех видов обмена веществ и входит в группу свободно-радикальной патологии, поскольку именно сдвиг в редокс-гомеостазе является движущей силой естественного течения заболевания и формирования его осложнений [4, 5, 6]. Хроническая гипергликемия, избыточное образование свободных радикалов НАДФН-оксидазами [7] и дыхательной цепью митохондрий [8], дефицит эндогенных антиоксидантов [9] являются главными факторами, приводящими к структурным и функциональным изменениям в сетчатке, нервах и сосудах различных тканей и органов, что, в частности, провоцирует развитие микрососудистых (диабетической ретинопатии (ДР) и диабетической нефропатии (ДНФ)) и макрососудистых (ишемическая болезнь сердца, острые нарушения мозгового кровообращения) осложнений СД2 [10, 11].
Исследования последних лет показали, что образование активных форм кислорода в митохондриях служит основой нескольких связанных с гипергликемией патогенетических механизмов развития болезни, таких как ингибирование глицеральдегид-3-фосфатдегидрогеназы, активация аутоокисления и полиолового пути метаболизма глюкозы, активация протеинкиназы С, 12/15-липоксигеназного пути, а также образования конечных продуктов гликирования [12, 13, 14]. Перечисленные процессы способны усугублять окислительный стресс. Так, ферменты полиолового пути расходуют НАДФН·Н+, тормозя его использование для восстановления окисленного димера клеточного антиоксиданта глутатиона в исходную активную мономерную форму [14]. В то же время взаимодействие конечных продуктов гликирования с их рецепторами приводит к новому витку генерации активных форм кислорода [15], что грозит инициацией сигналинга белка р53 и, как следствие, высвобождением цитохрома с из внутренней мембраны митохондрий с запуском апоптоза клетки [16]. В этой связи первостепенное значение для защиты клетки в условиях избыточного окисления субстатов имеют митохондриальные изоформы антиоксидантных ферментов, к которым относится супероксиддисмутаза 2 (СОД2), катализирующая превращение супероксид-аниона в перекись водорода согласно уравнению: 2H+ + 2О2.- = H2O2 + O2 [17]. Фермент кодируется расположенным на длинном плече шестой хромосомы (6q25.3) геном SOD2. Согласно литературным данным, миссенс-вариант SOD2 rs4880 (A>G) характеризуется заменой валина на аланин, что снижает ферментативную активность белка [17]. Ранее были описаны ассоциации варианта rs4880 с диабетической нефропатией у европейцев [18], японцев [19] и китайцев [20], однако валидационных исследований выявленной ассоциации в русской популяции выполнено не было, что обосновывает актуальность настоящей работы.
Цель исследования. Провести анализ ассоциаций миссенс-варианта rs4880 SOD2 с риском развития СД2 и его микрососудистых осложнений – диабетической ретинопатии и нефропатии у жителей Центральной России.
Материалы и методы исследования. Дизайн исследования одобрен Региональным этическим комитетом при Курском государственном медицинском университете (выписка из протокола №10 от 12.12.2016 г.). Все пациенты дали письменное информированное согласие на участие в исследовании. Группа больных СД2 (1579 человек – 591 мужчина и 988 женщин, средний возраст 61,3±10,4 года) была набрана из числа пациентов эндокринологического отделения Курской городской клинической больницы скорой медицинской помощи в период с 2016 по 2019 годы. Диагноз СД2 устанавливали врачи-эндокринологи на основании критериев ВОЗ [21]. При этом у 991 пациента с СД2 установлено наличие ДР, у 544 больных СД2 выявлена ДНФ. Группу контроля (1627 человек – 601 мужчина и 1026 женщин, средний возраст 60,8±6,4 года) составили относительно здоровые доноры Курского областного клинического центра крови. Критерии включения и исключения из исследования были подробно изложены нами ранее [22]. У всех участников исследования был организован забор 5 мл крови натощак в вакуумные пробирки с ЭДТА для последующей фенольно-хлороформной экстракции геномной ДНК. Генотипирование выполнено методом полимеразно-цепной реакции в реальном режиме времени на термоциклере С1000 Touch Thermal Cycler CFX96 (Bio-Rad) с использованием TaqMan зондов. Праймеры и зонды были синтезированы компанией Синтол (Москва). Статистический анализ полученных данных проведен методом логистической регрессии с поправками на пол, возраст и индекс массы тела с помощью онлайн программы SNPStats [23]. Ассоциация считалась значимой при Р<0,05.
Результаты и их обсуждение. Распределение частот генотипов в исследуемой популяции соответствовало равновесию Харди-Вайнберга (P>0,05). В таблице 1 приведены результаты расчета ассоциаций изучаемого однонуклеотидного варианта с предрасположенностью к СД2. Как видно из таблицы 1, носительство полиморфизма rs4880 не было связано с развитием СД2 ни в общей группе, ни отдельно у мужчин и женщин.
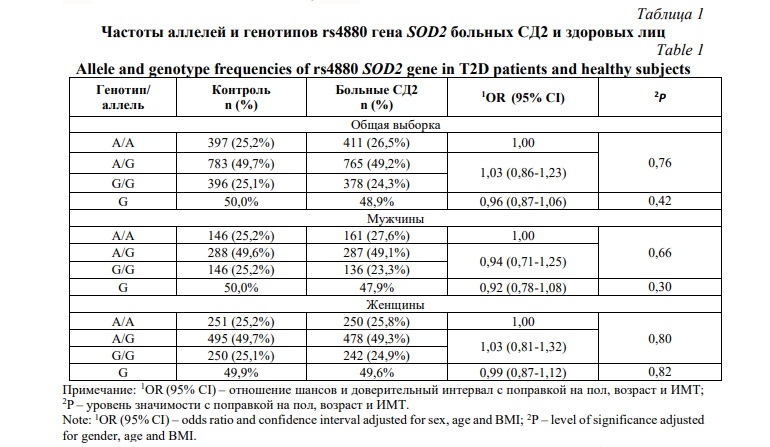
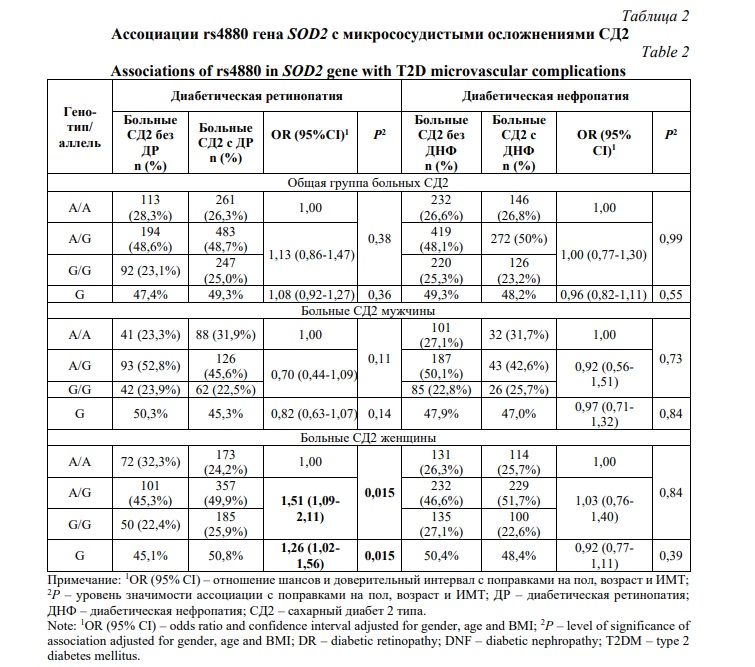
В таблице 2 показаны результаты анализа ассоциаций rs4880 с микрососудистыми осложнениями СД2. Установлена ассоциация минорного аллеля G (OR=1,26, 95% CI=1,02-1,56, P=0,033), а также генотипов А/G и G/G (OR=1,51, 95% CI=1,09-2,11, P=0,015) c риском развития ДР у больных СД2 женщин, тогда как статистически значимых ассоциаций с развитием ДНФ выявлено не было: Р>0,05.
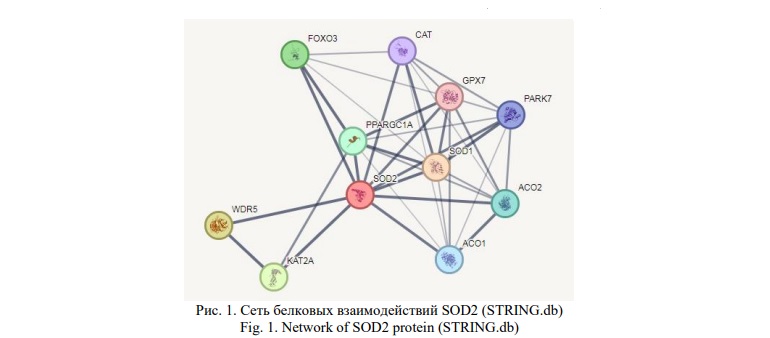
Анализ взаимодействий кодируемого геном SOD2 фермента с другими белками (Рис. 1), выполненный с использованием инструмента STRING, показал, что интерактом супероксиддисмутазы 2 включает в себя супероксиддисмутазу 1 (SOD1), каталазу (CAT), глутатионпероксидазу 7 (GPX7), 1-альфа коактиватор рецептора гамма, активируемого пролифераторами пероксисом (PPARGC1A), дегликазу DJ-1 (PARK7), транскрипционный фактор (FOXO3), гистоновую деацетилазу (KAT2A) и WD-повтор содержащий белок 5 (WDR5). Анализ генных онтологий выявил основные функции описанной белковой сети: клеточный ответ на окислительный стресс (FDR=1,38×10-7), положительная регуляция биосинтеза активных форм кислорода (FDR=0,00015) и отрицательная регуляция индуцированного окислительным стрессом сигнального пути апоптоза (FDR=0,0102).
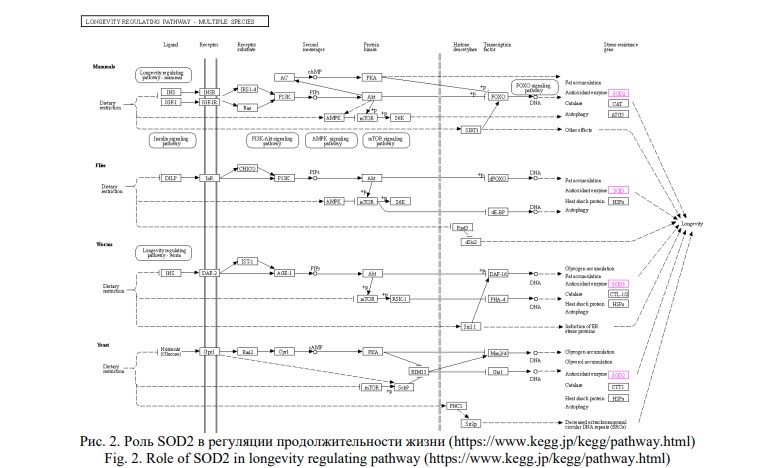
Как фермент, обеспечивающий устойчивость к окислительному стрессу, супероксиддисмутаза 2 является частью белкового интерактома (также включающего шапероны, белки энергетического метаболизма, репарации ДНК и аутофагии), регулирующего процессы старения и продолжительность жизни человека и других биологических видов (Рис. 2, KEGG Pathways).
Изучаемый однонуклеотидный вариант rs4880 (A>G) приводит к замене валина на аланин в 16-м положении полипептидной цепи белкового продукта. В исследовании Bastaki [24] показано, что активность фермента у носителей генотипов A/A и A/G была на 33% выше по сравнению с носителями генотипа G/G, однако в более ранней работе Sutton [25] были получены противоположные результаты. В этой связи нами был проведен биоинформатический анализ эффектов альтернативного аллеля rs4880-G на экспрессию SOD2. По данным транскриптомного анализа (GTEx Portal) аллель rs4880-G ассоциирован со снижением экспрессии гена SOD2 в сердечной мышце (NES=-0,11, P=0,0000053). Этот же аллель связан со снижением экспрессии гена MRPL18 в поджелудочной железе (NES=-0.19, P=0,000026), сердце (NES=-0,21, P=6,1×10-10), аорте (NES=-0,17, P=2,9×10-8), скелетной мышечной ткани (NES=-0,15, P=6,8×10-12), подкожной жировой клетчатке (NES=-0,24, P=6,2×10-18), большеберцовой артерии (NES=-0,19, P=1,5×10-16) и большеберцовом нерве (NES=-0,25, P=1,8×10-21). Следует отметить, что митохондриальный рибосомальный белок L18 (MRPL18) необходим для транспортировки из цитозоля в митохондрии важнейшего компонента рибосом 5S рРНК, кодируемого не митохондриальной, а геномной ДНК (Uniprot, https://www.uniprot.org/). Снижение экспрессии MRPL18 способно оказать негативное влияние на рибосомальный синтез белков в митохондриях тканей, патогенетически связанных с развитием СД2 и его осложнений.
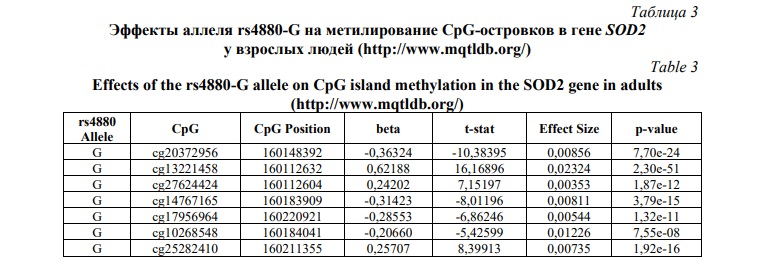
По данным ресурса mqtl.db (http://www.mqtldb.org/), депонирующего результаты анализа метилирования ДНК у человека в различные возрастные периоды жизни, влияние аллеля rs4880-G на метилирование CpG-островков в гене SOD2 у взрослых людей носит неоднозначный характер: носительство минорного аллеля G ассоциировано с гипометилированием одних CpG-островков и с гиперметилированием других (Табл. 3).
Нами впервые установлена ассоциация rs4880 с диабетической ретинопатией у женщин с СД2. В литературе описаны ассоциации изучаемого полиморфного варианта с диабетической нефропатией при сахарном диабете 1 типа в популяции финнов и шведов [18], а также с диабетической нефропатией у больных СД2 японцев [19] и китайцев [20]. Недиабетические фенотипы, ассоциированные с rs4880, включают кардиомиопатию у пациентов с гемахроматозом [26], идипатическую кардиомиопатию [27], плевральную мезотелиому [28], рак простаты [29] и болезнь Альцгеймера [30].
Семейство супероксиддисмутаз у человека включает в себя три изоформы – цитозольную супероксиддисмутазу 1, митохондриальную супероксиддисмутазу 2 и внеклеточную супероксиддисмутазу 3 [17]. Установленный нами факт ассоциации с ДР loss-of-function варианта rs4880 в гене, кодирующем супероксиддисмутазу 2, имеет непосредственное патогенетическое значение для развития этого осложнения СД2 ввиду того, что снижение каталитической активности фермента у носителей минорного аллеля rs4880-G способствует формированию окислительного стресса в митохондриях и их дисфункции. Показано, что хроническая гипергликемия индуцирует генерацию АФК в митохондриях, что изменяет экспрессию генов за счет ковалентной модификации транскрипционных факторов [31, 32] и вызывает увеличение содержания в сетчатке проапоптотических митохондриальных белков, таких как цитохром с и апоптоз-индуцирующий фактор (AIF) [33]. Действительно, исследования in vitro установили усиление фрагментации митохондрий и активацию апоптоза клеток в условиях гипергликемии [34]. Кроме того, в экспериментальной работе на мышах с СД2 выявлено значительное повышение генерации АФК в сетчатке, причем подавление синтеза АФК ингибировало опосредованный каспазой 3 апоптоз нейронов и замедляло потерю зрения [35]. Считается, что именно дисфункция митохондрий является причиной нейродегенерации сетчатки, предшествующей появлению сосудистых нарушений при ДР [36].
Заключение. Носительство минорного аллеля rs4880-G является генетическим маркером повышенного риска развития диабетической ретинопатии у женщин с СД2. Повышенный риск развития ДР у носительниц минорного аллеля rs4880-G может быть связан со снижением активности митохондриальной супероксиддисмутазы 2 как в результате аминокислотной замены валина на аланин, так и в результате отрицательного влияния аллеля G на экспрессию генов SOD2 и MRPL18 в сосудистой и нервной тканях, что способствует становлению митохондриальной дисфункции – важнейшего звена патогенеза ретинальной нейродегенерации и поражения сосудов сетчатки при сахарном диабете 2 типа.
Информация о финансировании
Исследование выполнено за счет гранта Российского научного фонда (проект № 20-15-00227).




















Список литературы