МЕТОДИКА АНАЛИЗА КАРТИРОВАНИЯ ЭЛЕМЕНТНОГО СОСТАВА ТКАНИ МИОКАРДА С ПРИМЕНЕНИЕМ СКАНИРУЮЩЕГО ТРАНСМИССИОННОГО МИКРОСКОПА
Aннотация
В статье представлена методика количественного определения распределения концентраций химических элементов в биологическом образце. Предложен способ картирования макроэлементного состава биологических образцов методом РФА, заключающийся в определении референтных значений концентраций макроэлементов методом атомно-эмиссионной спектрометрии и калибровке детектора РФА при помощи дискриминатора , что позволяет увеличить точность картирования макроэлементного состава биологических образцов в сто раз до 10-30 ppm.
Ключевые слова: картирование макроэлементного состава, рентгенофлуоресцентный анализ, сканирующая электронная микроскопия
Введение.
Известны высокоточные методы, определяющие 10−8% — 10−9% (1 ppb) практически по любому элементу, количественного анализа элементного состава биологических образцов, такие как атомно-эмиссионная спектрометрия и масс-спектрометрия существенным недостатком которых является деструкция образца в процессе исследования [2,3]. В то же время к недеструктивным методам относится рентгенофлуоресцентный анализ [4], однако, ввиду сложности структуры органических образцов и низким пределам разрешения (1000 – 3000 ppm), в каноническом виде не подходит для количественного анализа органических образцов [5,7]. Наиболее близким по своим признакам, принятым за прототип, является картирование элементного состава образца при помощи сканирующего электронного микроскопа FEI Quanta 200 и программного пакета Edax Genesis (copyright 2015 EDAX inc.), заключающийся в анализе характеристического рентгеновского излучения от исследуемого объекта, возникающего вследствие его облучения электронами с энергией 15-30 КэВ. Основным недостатком прототипа является то, что он дает приемлемые результаты в случаях, когда исследуемые образцы – материалы неорганического происхождения и не деформируются под длительным воздействием электронного излучения.
Цель исследования: для устранения данных недостатков разработать специальный метод пробоподготовки с использованием атомно-эмиссионной спектрометрии в качестве источника референтных значений концентраций интересующих химических элементов, а также разработать методику количественного картирования макроэлементного состава биологических образцов методом рентгенофлуоресцентного анализа.
Материалы исследования.
Работа выполнена на базе кафедры госпитальной терапии и госпитальной хирургии Медицинского института НИУ «БелГУ» располагающиеся на базе кардиохирургического Центра и Центра трансплантации органов Белгородской областной клинической больницы Святителя Иоасафа, а также Научно-образовательного и инновационного центра «Наноструктурные материалы и нанотехнологии» НИУ «БелГУ». Разработка методики количественного картирования макроэлементного состава проводилась на биологических образцах аутопсии органов человека (сердце). Были использованы ткани 10 практически здоровых лиц, погибших в результате несчастных случаев (травмы, не совместимые с жизнью), не страдавших сердечно-сосудистыми заболеваниями.
Работа выполнена при поддержке гранта РФФИ 15-34-51236 «Компоненты межклеточного матрикса в формировании фиброза почек и миокарда у пациентов с артериальной гипертензией».
Методы исследования.
Картирование элементного состава ткани проводилось с использованием методов нанотехнологий: сканирующей трансмиссионной (СТЭМ; FEI Nova NanoSEM) микроскопии.
Результаты исследования и их обсуждение. В исследовании произведен новый способ количественного картирования макроэлементного состава биологических образцов, заключающийся в корректировке получаемого сигнала ХРИ от биологического образца при помощи дискриминатора. Корректировка получаемого сигнала ХРИ осуществлялась таким образом, чтобы данные количественного анализа совпадали с результатами атомно-эмиссионной спектрометрии, т.е. осуществлялось увеличение точности результатов картирования до 10-30 ppm.
Исследуемый биологический образец делился на 3 части, из которых две части по 1 г и одна 0.1 г соответственно. Части массой 1 г использовались для установления референтных значений и калибровки детектора, при этом часть в 0.1 г являлась исследуемым образцом. Пробоподготовка для атомно-эмиссионной спектрометрии осуществлялась по стандартной методике. Результаты определения концентраций интересующих макроэлементов принимались за референтные значения.
Пробоподготовка для электронной микроскопии: калибровочный образец спрессовывался до размеров тонкой пластинки толщиной 1-2 мм с целью минимизации эффекта поглощения рентгеновского излучения в образце, эффекта матрицы, а так же эффекта автофлюоресценции. Далее калибровочный образец дегидрировался при помощи ацетона или методом лиофильной сушки. Для калибровки, проводилось исследование элементного состава со всей поверхности образца. Полученные результаты корректировались при помощи дискриминатора до получения результатов количественного анализа РФА одного порядка или до совпадения с данными атомно-эмиссионной спектрометрии.
Установлено, что проведение картирования должно быть проведено по элементам, для которых определены референтные значения концентраций, полученных при помощи атомно-эмиссионной спектрометрии (р˂0,05). В других случаях эксперимента определена достоверная точность исследования, которая не превышала предела разрешения РФА (1000-3000 ppm) (р˂0,05) рис.1.
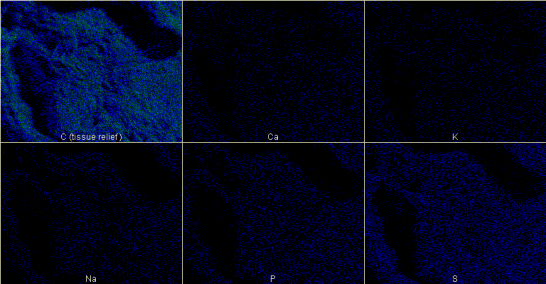
Рис. 1 Картирование ткани миокарда левого желудочка человека
Заключение. В нашем проекте, установлен способ количественного картирования макроэлементного состава биологических образцов, включающий определения референтных значений концентраций методом атомно-эмиссионной спектрометрии, калибровки детектора РФА, количественного картирования макроэлементного состава биологических образцов с точностью до 10-30 ppm.
В результате выполненного проекта впервые получена методика повышения точности картирования макроэлементного состава биологических образцов, в частности тканей органов человека, методом РФА. Используемый в данной работе способ пробоподготовки образцов биологической ткани (сердца) является простым, доступным и эффективным. Главным достоинством полученного способа картирования является минимальное количество операций и реагентов, применяемых к исследуемому образцу биоткани. При необходимости исследование может проводиться на калибровочном образце, выбор зависит от поставленных перед исследователем задач.
Разработанный способ картирования макроэлементного состава биологических образцов методом РФА, заключается в определении референтных значений концентраций макроэлементов методом атомно-эмиссионной спектрометрии и калибровке детектора РФА при помощи дискриминатора таким образом, что результаты исследования калибровочных образцов совпадали. Предлагаемый метод позволяет увеличить точность картирования макроэлементного состава биологических образцов в сто раз до 10-30 ppm, что определить количественный м макроэлементный состав биологических образцов.




















Список литературы