РАЗРАБОТКА МЕТОДИКИ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ СКВАЛЕНА В НЕКОТОРЫХ РАСТИТЕЛЬНЫХ ЖИРНЫХ МАСЛАХ
Aннотация
Сквален - природное биологически активное соединение, обладающее уникальной фармакологической активностью. Настоящий изопреноид принимает активное участие в обмене веществ, в первую очередь как предшественник биосинтеза стероидов, являясь базовым структурным фрагментом липидного слоя эпидермиса. Для данного соединения характерна пролиферативная, иммунокоррегирующая и антиоксидантная активность. Также сквален в настоящее время рассматривается как перспективная молекула в онкологии. До недавнего времени сквален извлекали из печени глубоководных рыб, поэтому он являлся весьма дорогостоящим продуктом. Однако из-за введения ограничений вылова глубоководных животных во всём мире, данный способ в настоящее время утратил свою актуальность. Поэтому, возникает необходимость в использовании других продуктов, содержащих данную молекулу. Возможными источниками сквалена могут служить жирные масла растительного происхождения. Поиск уникальных и наиболее полезных жирных масел, являющихся, в том числе источниками сквалена до сих пор остаётся актуальной проблемой. В результате настоящего исследования предложена методика обнаружения сквалена в растительных жирных маслах с помощью метода хромато-масс-спектрометрии. Определение проводилось в изотермическом режиме элюирования при температуре испарителя 270 °С, что гарантировало десорбцию образца растительного жирного масла из испарителя. Несомненным достоинством предложенной методики является то, что для определения сквалена не требуется его предварительная экстракция и очистка из жирного масла. Методом абсолютной градуировки удалось дать количественную оценку содержания сквалена в исследованных жирных маслах. Установлено, что наибольшее количество сквалена содержится в амарантовом и тыквенном маслах.
Ключевые слова: сквален, растительные жирные масла, хромато-масс спектрометрия, метод абсолютной градуировки
Введение
Сквален - природное биологически активное соединение, интерес к которому в последнее время возрос в связи с уникальностью его фармакологической активности. Сквален по химическому строению является алифитическим изопреноидом, содержащим 30 углеродных атомов и шесть двойных связей, поэтому для него свойственна цис-, транс-изомерия. Характерно, что сквален природного происхождения является транс-изомером [4].
Из-за присутствия большого количества двойных связей молекула сквалена крайне нестабильна, поэтому медленно окисляется, переходя в сквалан [9].
Указанный изопреноид найден во многих живых организмах, принимая активное участие в обмене веществ, в первую очередь как предшественник биосинтеза стероидов. Образуется он в тех организмах, где присутствуют тритерпены, которые синтезируются из него в ходе биохимической реакции, заключающейся в эпоксидировании концевой кратной связи, с одновременным замыканием цикла скваленоксида [2].
Пристальное внимание к указанному соединению в последние годы вызвано широким спектром его биологической активности. Ещё в 1906 году японскими исследователями был зафиксирован факт, что акулы почти не страдают онкологическими заболеваниями. Оказалось, что эти рыбы, живущие в глубоких водах, имеют высокую концентрацию сквалена в печени, что обеспечивает их плавучесть в воде и вместе с тем противоопухолевую активность [1].
В 1931 году учёными Цюрихского университета было доказано, что у сквалена для приобретения стабильного состояния не хватает 12-и атомов водорода, поэтому данный углеводород заимствует их у любой доступной ему молекулы, в том числе из воды. В результате реакции с водой, выделяется молекулярный кислород, который идёт на обеспечение органов и тканей [4].
Сквален - важнейший участник биосинтеза холестерина в животных организмах, являясь базовым структурным фрагментом липидного слоя эпидермиса. Данный углеводород в процессе синтеза холестерина способен превращаться в его биохимический аналог - 7-дегидрохолестерин, который под действием солнечного света переходит в витамин Д, обусловливая тем самым радиопротекторные свойства [2]. Кроме того, для данной структуры характерна пролиферативная, иммунокорригирующая и антиоксидантная активность. Сквален в настоящее время рассматривается как перспективная молекула в онкологии [6].
До недавнего времени сквален получали из печени глубоководных рыб, поэтому он являлся весьма дорогостоящим продуктом. Однако из-за введения ограничений вылова глубоководных животных во всём мире, данный способ в настоящее время утратил свою актуальность [8]. Поэтому, возникает необходимость в использовании других продуктов, содержащих данную молекулу. Возможными источниками сквалена могут служить жирные масла растительного происхождения [3, 5, 7, 10].
Жирные масла являются одними из важнейших нутриентов. Известно, что потребление растительных масел имеет важнейшее значение для роста и развития организма, и как следствие поддержания здоровья.
Первостепенное пищевое значение имеют подсолнечное, оливковое, кукурузное масла, которые обладают своими достоинствами, но поиск уникальных и наиболее полезных жирных масел, являющихся, в том числе источниками сквалена до сих пор остаётся актуальной проблемой. Поэтому разработка эффективных методов их анализа является необходимым условием для изучения любого растительного масла.
Основная часть
Для оценки жирных масел по содержанию сквалена и выявления наиболее потенциально значимых из них, необходимо предложить аналитический подход, с помощью которого можно определить качественное и количественное содержание данного компонента в указанных объектах.
Целью данной работы явилось создание аналитического подхода для качественной и количественной оценки сквалена в ряде растительных жирных масел.
Для реализации цели был поставлен ряд нижеперечисленных задач:
- Предложить методику определения подлинности сквалена в растительных жирных маслах;
- Разработать схему количественного определения сквалена в выбранных объектах.
Для исследования сквалена в растительных маслах известен ряд методов идентификации и количественного определения. Одним из них является – высокоэффективная жидкостная хроматография, характеризующаяся как один из наиболее чувствительных [3, 9].
Помимо этого для определения сквалена в следовых количествах также используют метод газовой хроматографии с пламенно-ионизационным детектором [8].
Для того чтобы оптимизировать процесс анализа сквалена в природных объектах нами разработана методика его определения.
Материалы и методы исследования
С целью определения сквалена в выбранных объектах нами использован метод хромато-масс-спектрометрии, то есть гибридный метод, сочетающий газожидкостную хроматографию с масс-спектрометрическим детектированием. Данный метод был выбран по ряду нижеперечисленных причин. Поскольку сквален является липофильной структурой, следовательно, имеет термостабильность, что позволяет использовать термическую десорбцию в ходе его определения газохроматографическим методом. Поскольку сквален представляет собой жидкость с температурой кипения около 280 оС , то другие компоненты растительных масел, а именно триглицериды, стероиды, имеющие более высокие температуры кипения, не будут мешать его прямому определению в жирных маслах. В качестве детектора наиболее рационально использовать масс-спектрометрический, который является универсальным, а также наиболее информативным и чувствительным из всех известных. Кроме того, данный метод позволит определить состав сопутствующих компонентов, содержащихся в масле – глицеридов, жирных кислот, каротиновидов.
Измерение проводили на приборе хромато-масс-спектрометр, модель GCMS-QP2010 Ultra, фирмы «Shimadzu», Япония, регистрационный номер №46022-10.
Хромато-масс-спектрометр включает в себя газовый хроматограф, модель GC-2010 Plus, квадрупольный масс-спектрометр, форвакуумный насос, персональный компьютер, программное обеспечение и дополнительные аксессуары.
Режим ионизации масс-спектрометра - электронный удар. Деление ионов совершается квадрупольным масс-фильтром, детекция – вторичным электронным умножителем с обращённым динодом. Детектирование проводится в режимах селективного ионного детектирования (SIM), или по полному ионному току (SCAN) или в режиме одновременной регистрации SIM/ SCAN.
Разделение проводили на колонке:
Zebron ZB-5MS 30 m L × 0,25 mm ID × 0,25 μm df;
Жидкая фаза: 5%-polysilarylene-95polydimethylsiloxane;
Температурные пределы: от -60 С° до 325/350 С°;
Серийный номер № 238059.
Условия хроматографирования:
Газ-носитель – гелий с постоянным потоком - 2,0 мл/мин;
Анализ осуществлялся в изотермическом режиме.
Температура колонки – 250 С°;
Температура испарителя – 270 С°;
Температура ионного источника – 250 С°;
Температура интерфейса – 250 С°;
Режим ввода пробы - без деления потока;
Напряжение на детекторе – 0,84 кВ;
Поток эмиссии – 60 µА;
Объём вводимой пробы – 5µl.
Детектирование выполняли в режиме полного ионного тока (SCAN) в диапазоне m/z 40 – 500 Da, скорость сканирования 1000 и результирующее время 0,5 сек.
Идентификацию веществ проводили путём сравнения масс-спектров, полученных в ходе эксперимента с масс-спектрами базы данных масс-спектров NIST 11.
Выбор представленного температурного режима обусловлен тем, что сквален имеет достаточно большую молекулярную массу, поэтому малолетучий, следовательно температура испарителя 270 °С обеспечивает испарение образца.
Результаты исследования и их обсуждение
На первом этапе настоящего исследования была разработана методика хромато-масс-спектрометрического определения сквалена. Для этого был взят образец сквалена с концентрацией 0,0001 г/мл, в качестве растворителя использовался н-гексан.
Приготовление образца сравнения. 10 мг (точная навеска) стандартного образца сквалена помещали в мерную колбу вместимостью 100 мл, прибавляли 20,0 мл растворителя – н-гексана, перемешивали до полного растворения сквалена, доводили объём раствора растворителем до метки и перемешивали.
Полученный образец хроматографировали в приведённых выше условиях. Хроматограмма стандартного образца сквалена изображена на рисунке 1.

На рисунке 1 видно, что время удерживания сквалена в приведённых условиях составило 9,325 мин.
Масс-спектр сквалена представлен на рисунке 2.
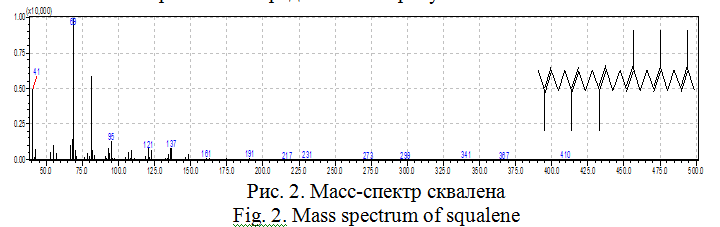
В масс-спектре сквалена имеется несколько характеристических пиков ионов, приведенных в таблице 1.
Таблица 1
Характеристические пики ионов
Table 1
Characteristic ions peaks
m/z | Абсолютная интенсивность, (%) |
39,85 | 14,39 |
40,90 | 55,39 |
42,90 | 22,76 |
43,85 | 38,30 |
54,90 | 25,20 |
56,90 | 11,45 |
66,95 | 19,80 |
68,05 | 16,35 |
69,00 | 100,00 |
81,00 | 43,94 |
Результаты, представленные в таблице, показывают, что базовый пик сквалена представлен характеристическим ионом m/z = 69, имеющим интенсивность 100%.
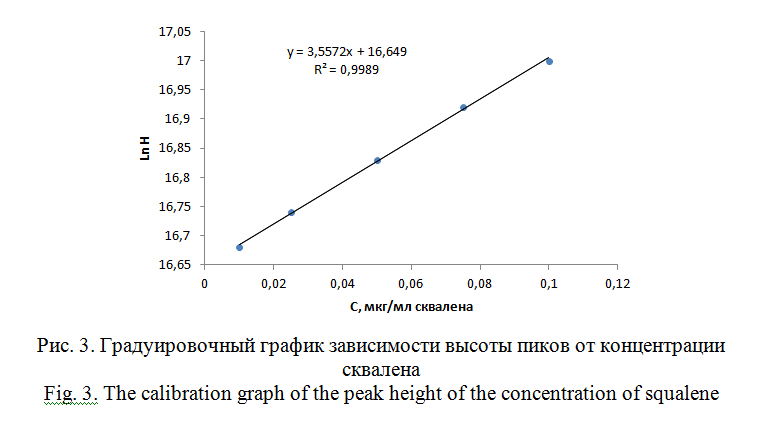
Количественное определение сквалена проводили с помощью метода абсолютной градуировки, то есть сопоставление результата определения сквалена в исследуемом образце с калибровочным графиком, построенным на основании регистрации стандартного образца сквалена с известной концентрацией.
В результате проведения градуировки, построен калибровочный график зависимости высоты пика от концентрации СО сквалена, представленный на рисунке 3. Диапазон концентраций, в которых построен градуировочный график 0,01 мкг/мл – 0,1 мкг/мл, что перекрывает весь возможный диапазон содержания сквалена в растительных маслах. В указанном диапазоне концентраций калибровочный график имел прямолинейную зависимость. Данные высоты пика преобразовали в логарифмическую форму для упрощения расчётов. Аргумент, то есть независимая функция Х, представлена массовой концентрацией, то есть мкг/мл.
В результате построения градуировочного графика (рисунок 3) получено уравнение регрессии и рассчитан коэффициент аппроксимации, составивший 0,9989, что свидетельствует о надлежащей степени соответствия концентрации логарифму высоты пика.
В качестве объектов исследования взяты 5 образцов растительных масел: пальмовое, оливковое, масло зародышей пшеницы, амарантовое и тыквенное.
Приготовление испытуемого образца. Пробу исследуемого образца масла в количестве 500 мг (точная навеска) помещали в мерную колбу вместимостью 10 мл, добавляли 5 мл н-гексана и встряхивали до растворения. Содержимое колбыдоводили н-гексаном до метки и перемешивали. 5 мкл полученного раствора каждого образца далее хроматографировали в условиях, идентичных обнаружению стандартного образца сквалена.
Пальмовое масло. В качестве образца пальмового масла было взято пищевое кондитерское пальмовое масло. Хроматограмма образца указанного масла изображена на рисунке 4.
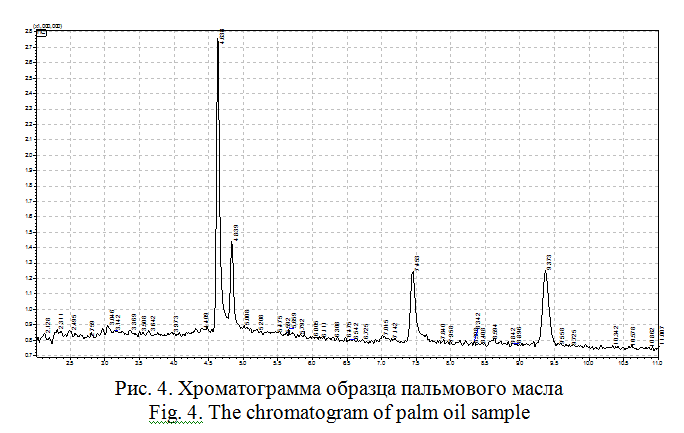
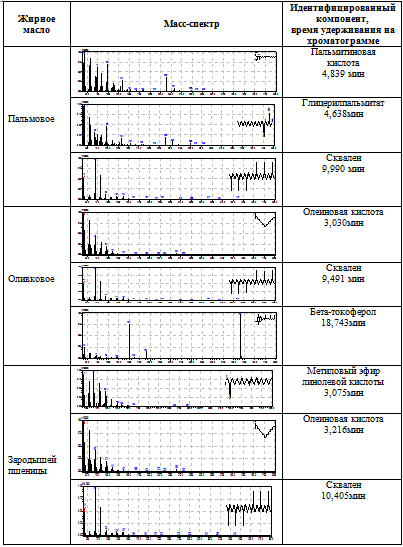
В полученной пробе обнаружены следующие доминантные компоненты: пальмитиновая кислота, глицерилпальмитат и сквален (таблица 2).
Оливковое масло. Для исследования образца оливкового масла было взято масло фирмы «Altero», которое является оливковым маслом класса «Extra Virgin». Хроматограмма раствора оливкового масла изображена на рисунке 5.
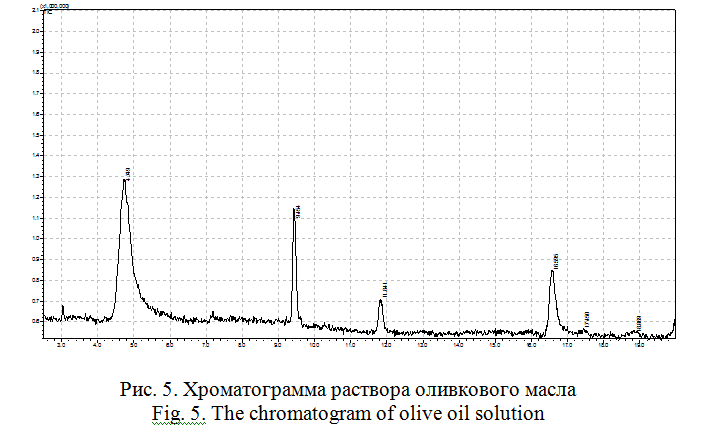
В пробе обнаружены вещества: олеиновая кислота, сквален, бета-токоферол (таблица 2).
Масло зародышей пшеницы. Для исследования был взят образец масла фирмы «Аспера». Хроматограмма образца масла зародышей пшеницы представлена на рисунке 6.

В пробе обнаружены вещества: метиловый эфир линолевой кислоты, олеиновая кислота, сквален и бета-токоферол (таблица 2).
Амарантовое масло. В качестве объекта исследования был использован образец масла «Формула жизни». Хроматограмма масла амаранта представлена на рисунке 7.
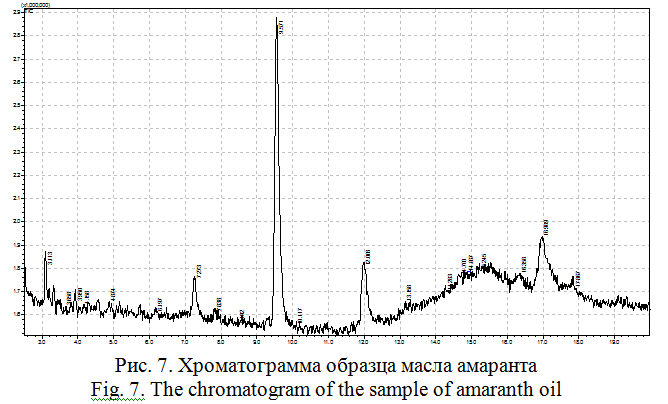
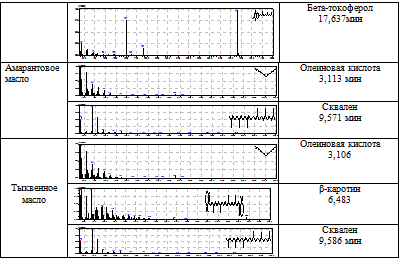
В жирном масле амаранта обнаружены олеиновая кислота и сквален (таблица 2).
Тыквенное масло. Объектом исследования тыквенного масла стало пищевое масло. Хроматограмма тыквенного масла представлена на рисунке 8.
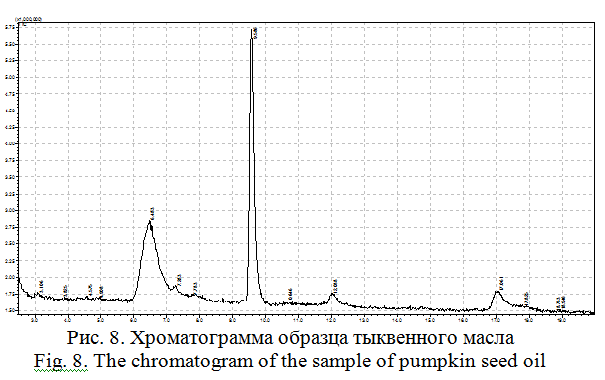
В тыквенном масле обнаружены олеиновая кислота, сквален и β-каротин (таблица 2).
Таблица 2
Компонентный состав изученных жирных масел
Table 2
Component composition of the studied fatty oils
При проведении количественного анализа было установлено, что содержание сквалена в исследуемых маслах составило: оливковое масло – 0,0248 мкг/мл, пальмовое масло – 0,031 мкг/мл, масло зародышей пшеницы – 0,035 мкг/мл, амарантовое масло – 0,058 мкг/мл и тыквенное масло – 0,18 мкг/мл. Таким образом, можно сделать вывод о том, что наибольшее количество сквалена содержится в тыквенном масле.
Заключение
В результате настоящего исследования предложена методика обнаружения сквалена в растительных жирных маслах. В качестве аналитического инструмента использован хромато-масс-спектрометрический метод. Определение проводилось в изотермическом режиме элюирования при температуре испарителя 270 °С, что гарантировало десорбцию образца растительного жирного масла из испарителя. Регистрацию сквалена и фоновых компонентов масел осуществляли с помощью базы данных масс-спектров NIST 11. В итоге эксперимента определено, что время удерживания сквалена находилось в диапазоне 9,5- 10 мин, что может служить объективным параметром его подлинности. Несомненным достоинством предложенной методики является то, что для определения сквалена не требуется его предварительная экстракция и очистка из жирного масла.
Используя метод абсолютной градуировки, разработана методика количественного определения сквалена в жирных маслах. В качестве критерия соотнесения использована функция логарифма высоты пика сквалена. Установлено, что наибольшее количество сквалена содержится в амарантовом и тыквенном маслах.




















Список литературы