РАЗРАБОТКА И ИССЛЕДОВАНИЕ ФИТОЭКСТРАКТОВ, СОДЕРЖАЩИХ ФЛАВОНОИДЫ
Aннотация
Актуальность. Существующие методы получения фитокомплексов и оценки качества лекарственных форм с ними не всегда позволяют оценить действительный состав и возможности. Представлены новые подходы к технологии получения и стандартизации жидких экстрактов гинкго двулопастного (Ginkgo biloba L.) и астрагала серпоплодного (Astragalus falcatus). Цель исследования. Разработка и оценка методов стандартизации полученных эктрактов. Материалы и методы. Обьектами исследованияявляются: трава астрагала серпоплодного и листья гинкго билоба, жидкие экстракты на их основе. Методы исследования: для экстракта из листьев гинкго билоба – спектрофотометрия (СФ-56), регистрировался батохромных сдвиг полосы поглощения флавоноидов с 330-350 до 390-410 нм. Идентификaцию флавоноидов в экстракте жидком гинкго билоба листьев проводили с помощью хроматографии в тонком слое сорбента на пластинах «Сорбфил» с флуоресцентным индикатором в смеси хлороформ-метанол-вода. Количественное содержание суммы флaвоноидов в спирто-водном извлечении из астрагала серпоплодного определяли спектрофотометрически с использованием стандартного образца (Robinin, Kaempferol 3-O-robinoside-7-O-rhamnoside, Sigma). Показания снимали на спектрофотометре ЮНИКО 2802S при длине волны 352-356 нм. В качестве раствора сравнения использовали 70% этанол. Результаты. Было установлено, что оптимальными методами экстракции из гинкго билоба является динамический метод. Для гинкго двулопастного оптимальным является метод реперколяции. Оптимальным методом экстракции из астрагала серпоплодного является метод бисмацерации. Количественное содержание определяли в обоих случаях методом спектрофотометрии. В жидком экстракте листьев гинкго двулопастного содержится около 5.0 % суммы флавоноидов в пересчете на рутин (дифференциальная спектрофотометрия). В спирто-водном извлечения из травы астрагала серпоплодного экстрактивные вещества – до 30.0%, содержание флавоноидов – не менее 4.5% в пересчете на робинин. Заключение. Изучены технологические параметры сырья, разработаны оптимальные условия экстракции, методики количественного определения суммы флавоноидов в экстрактах из листьев гинкго билоба, травы астрагала серпоплодного валидированы.
Ключевые слова: астрагал серпоплодный, робинин, гинкго билоба, жидкие экстракты, гинкго-флавонгликозиды, терпенолактоны, гинкголевые кислоты, спектрофотометрия
Введение. Препараты из лекарственного растительного сырья входят в состав более 85 фармакотерапевтических групп. Многие природные соединения, такие как флавоноиды, сапонины, алкалоиды и др., несмотря на высокий уровень развития синтетической химии и возможности их воспроизводства, фитопрепараты обладают преимуществами, за счет активной работы основных веществ с сопутствующими веществами [8, 10, 15, 16].
Ginkgo biloba L. (гинкго двулопастной), сем. Ginkgoaceae – жизненная форма – дерево. Современная Китайская фармакопея предлагает использовать листья гинкго двулопасного для лечения сердечно-сосудистой системы и заболеваний верхних дыхательных путей [6, 22].
Несмотря на то, что препaраты гинкго двулопастного известны в восточной медицине с древнейших времен, в качестве официально утвержденных лекарственных средств они стали применяться только с 1960-х гг. ХХ века [6].
Устaновлено, что основными компонентами химического состава листьев гинкго двулопастного, обеспечивающими их фармакологическую активность, являются флавоновые гликозиды и терпеновые лактоны [5, 11, 25].
Лекaрственное растительное сырье гинкго двулопастного описаны в ГФ ХIII издания (гинкго двулопастного листья). Согласно классификации ЛРС, препараты гинкго двулопастного относятся к:
- aнгиопротекторы и корректоры микроциркуляции,
- корректоры нарушения мозгового кровообращения.
Фaрмакологическое действие экстрактов гинкго двулопастного листьев весьма разнообразно. Из основных фармакологических эффектов отмечено: антиагрегантное, венотонизирующее, ноотропное, антигипоксическое, антиоксидантное, улучшающее микроциркуляцию, противовоспалительное, мембраностабилизирующее, капилляропротекторное действие [15, 21].
Экстрaкт гинкго двулопастного листьев сухой, по данным литературы, благотворно влияет на обменные процессы в организме, реологические свойства крови, вазомоторные реакции кровеносных сосудов, мозговое кровообращение, в результате улучшения оксигенации и питания мозга. Экстракт гинкго билоба уменьшает проницаемость сосудов, оказывая выраженное противоотечное действие [9, 12], а также обладает антигипоксическими, антиоксидантными свойствами. Стандартизированный экстракт Ginkgo biloba может быть эффективен в качестве нефропротектора при клинической почечной недостаточности у человека. Это особенно важно, так как при острой почечной недостаточности (ОПН) возникает полиорганность нарушений с частым поражением центральной нервной системы, в отношении которого препараты гинкго двулопасного обладают выраженным благоприятным эффектом. Так, препарат Билобил, назначаемый в течение 2 месяцев детям с хроническим пиелонефритом, повышает скорость клубочковой фильтрации, более чем на 70% уменьшает протеинурию, устраняет никтурию, благоприятно влияет на тонус вегетативной иннервации и на церебральный кровоток [12, 14].
По ГФ ХIII определение флавоноидов проводят в пересчете на рутин (не менее 0.5%) методом дифференциальной спектрофотометрии с использованием стандартного образца рутина или удельного показателя поглощения комплекса рутина с алюминия хлоридом [3, 26].
В связи с этим, a также на основании сведений китайской медицины о широчайшем использовании сухого экстракта гинкго билоба представляло интерес получить жидкий экстракт гинкго, с высоким выходом биологически активных веществ, провести его оценку качества по показателям, предложенным ГФХIII для оценки сырья. Это поможет значительно повысить эффективность используемых способов экстрагирования [6, 26].
В нaстоящее время для получения экстракта гинкго двулопастного листьев используют смеси ацетон-вода различной концентрации (50-90% ацетон). Наиболее часто соотношение ацетон–вода составляет 60/40%. [1, 23, 24]
Astragalus falcatus (астрагал серпоплодный) – это многолетнее травянистое растение из семейства бобовых до 1 метра в высоту. Листья непарно перисто-сложные. Бледно-белые цветки собраны в многоцветковые кисти, плоды серповидно изогнутые, представляют из себя сидячие кожистые бобы. Ареал – Кавказ (Предкавказье, Восточное и Южное Закавказье, Дагестан) и юг европейской части. Содержит из активных веществ флавоноиды, главный из них – робинин (более 2%) [15].
Получаемые из листьев и цветов растения флавоноиды производят – фларонин, применяемый при лечении всевозможных заболеваний почек [4, 16].
Лекарственный препарат фларонин – это, прежде всего гипоазотемическое средство. Препарат усиливает азотовыделительную роль почек, улучшает почечное кровообращение, способствует снижению в крови содержания остаточного азота, креатинина и мочевины. К другим, его важным характеристикам можно отнести: противовоспалительное и диуретическое действие, а так же способность к снижению проницаемости капилляров. Фларонин довольно часто назначают для комплексного медикаментозного лечения некоторых форм простатита. Препарат, выпускается только в форме таблеток. Однако, данная лекарственная форма имеет такие побочные эффекты как, усугубление азотемии, аллергические реакции. Кратность приема 3 раза в день, ежедневно, в течение 20-30 дней. Такое длительное лечение при хроническом течении заболевания может растянуться на многие месяцы. Таким образом, актуальным вопросом является разработка новой лекарственной формы пролонгированного действия [19, 20].
Материалы и методы.
Объекты: объектaми исследования послужило лекарственное растительное сырье астрагала серпоплодного и гинкго билоба, а также жидких экстрактов на их основе. В качестве методов исследования использованы спектрофотометрия. Используемое оборудование: спектрофотометр СФ-56 и хроматограф жидкостный с программным управлением и компьютерной обработкой результатов анализа.
Методы получения: для получения жидкого экстракта гинкго двулопастного листьев был использован метод реперколяции с завершенным циклом (батарея из 5 диффузоров), соотношение сырье:экстрагент на ступени экстракции 1:4.5. Экстрагент спирт этиловый 70% [13]. Сырье с известной влажностью и коэффициентом поглощения загружали поочередно в диффузоры и заливали экстрагентом. Масса сырья и порции экстрагента во всех диффузорах были одинаковые.
Извлечения из травы астрагала серпоплодного получали методом бисмацерации. Измельченное и просеянное сквозь сито с величиной отверстий 1.0 мм сырье, помещают в мацерационный бак с механической мешалкой и заливают экстрагентом (70 % спирт этиловый) в соотношении 1:5, учитывая что Кп = 1.3. Экстракция проводится в течение 2-х суток при периодическом перемешивании и при температуре 20-23 0С.
Сырье отжимают, фильтруют через двойной слой марли (Извлечение 1). Сырье снова заливают экстрагентом в соотношении 1:3, так же с учётом Кп = 1.3. Время экстракции составляет 24 часа, при периодическом перемешивании (температура 20-23 0С). Сырье повторно отжимают и фильтруют через двойной слой марли (Извлечение 2). Смена экстрагента позволяет полнее истощить сырье и уменьшить потери при диффузии, так как поддерживается разность концентраций и как следствие этого – скорость диффузии. Оба извлечения объединяются.
Так как полученные настаиванием вытяжки представляли собой не прозрачные жидкости с определенным количеством взвешенных частиц, требовалась обязательная очистка.
Очищали полученные спирто-водные извлечения с помощью фильтрации через двойной слой марли и их отстаивания в прохладном и темном месте. Выпавшие балластные вещества, повторно отфильтровывали [2]. Для фильтрования могут быть использованы фильтры разных конструкций, за исключением работающих под вакуумом, в которых происходит интенсивное испарение спирта. Повторная фильтрация позволяла максимально очистить полученные извлечения от балластных веществ, тем самым увеличивая концентрацию необходимых БАВ, в том числе флавоноидов. Для выбора оптимальных условий фильтрации рассмотрели основополагающие характеристики. По режиму работы все фильтры можно разделить на: периодического действия и непрерывного действия. В первом случае подача спирто-водного извлечения осуществляется дозировано с перерывами на проведение вспомогательных операций, таких как удаление слоя осадка, в то время как во втором случае процесс идет непрерывно. Так как фильтрация проходила с накоплением балластных веществ, то выбор был сделан в пользу периодической фильтрации. Учитывая, что продукт является спирто-водным извлечением, выбор был сделан в пользу фильтрации под давлением, так как интенсивное испарение спирта, являлось не целесообразным.
Микробиологические исследования
Определение активности изучаемых экстрактов проводили в 3-х чашках Петри одинакового диаметра с плоским дном. В чашки, устанавливаемые горизонтально, наливали по 15 мл расплавленного питательного агара. Слой агара в чашке Петри заливали 1-2 мл взвеси испытуемого микроба в физиологическом растворе. Затем излишек взвеси полностью удаляли, подсушивали поверхность агара в течение 30 минут. Затем сверлом (6 мм диаметром) пробуравливали 6 отверстий («колодцев») на расстоянии 2.5 см от центра и на одинаковом расстоянии друг от друга, «колодцы» заполняли образцами экстрактов и растворителем в соответствующей концентрации (контроль). Чашки оставляли при комнатной температуре на 30 минут, после чего их ставили в термостат при температуре 37 °С, не переворачивая, строго горизонтально, чтобы получить круглые зоны. Под крышки чашки Петри помещали стерильный фильтр во избежание попадания конденсата на лунки. Зоны угнетения измеряли через 16 часов. Оценка результатов проводилась по диаметру зон задержки роста вокруг «колодца», включая диаметр самого «колодца»:
- отсутствие зоны задержки роста – испытуемая культура не чувствительна к данной концентрации препарата;
- диаметр зоны задержки роста 10 мм – умеренная чувствительность культуры к данной концентрации препарата;
- диаметр зоны задержки роста более 10 мм – высокая чувствительность испытуемой культуры к данной концентрации препарата.
Были использованы штаммы микроорганизмов E. Coli (246, инкубированы на среде 1, при температуре 37 оС), Salmonella (1711, инкубирована на средах 1, 16, 17, при температуре 37 оС), S. aureus (HA – MRSA), Pseudomonas aeruginosa (282, инкубирована на среде 1, 2, при температуре 28 оС). [18]
Стандартизация: стандартизацию проводили по методике ГФ ХIII, извлечения для анализа получали используя разработанные ранее методики, в качестве извлекателя так же спирто-водная смесь определенной концентрации [3].
Нормировать качество экстракта жидкого листьев гинкго билоба предложено по содержанию суммы флавоноидов, содержанию сухого остатка и плотности. Обнаружение флавоноидов в исследуемом экстракте осуществляли посредством цианидиновой пробы.
Просмотр хроматограммы в УФ-свете осуществляли при длине волны 254±2 нм [17].
Количественное определение флавоноидов в экстракте гинкго двулопастного листьях жидком проводили методом дифференциальной спектрофотометрии.
Оценку качества экстрактов проводили на основании анализа 5 лабораторных серий согласно ГФ ХIII [3].
В методах исследования, количественное содержание суммы флавоноидов в спирто-водном извлечении из травы астрагала серпоплодного определяли спектрофотометрически с использованием стандартного образца (Robinin, Kaempferol 3-O-robinoside-7-O-rhamnoside, Sigma). Показания снимали на спектрофотометре ЮНИКО 2802S (длина волны 354±2 нм). Определяли оптическую плотность стандартного образца робинина.
Результаты и обсуждения. Согласно данным литературы, достаточно обширную группу препаратов составляют те, которые в своем составе имеют в виде основного компонента флавоноиды [16]. Флaвоноиды широко применяются как в народной, так и традиционной медицине. Это гетероциклические соединения различной окраски, преимущественно желто-оранжевого спектра. Флавоноиды можно назвать натуральными растительными красителями. Это строго соединения растительных объектов [8, 10]. Известно, что флавоноиды, по степени окисления внешней оболочки 3-углеродного фрагмента, можно классифицировать на: лейкоцианы; катехины; флавононы; халконы; флавононолы; антоцианы; ауроны; флавонолы; изофлавоны.
Рутин (витамин С2, или Р) обладает сосудоукрепляющей активностью. Именно эта активность и обеспечивает фармакологические эффекты многих лекарственных форм, в частности препарата аскорутина (Ascorutinum), предназначенного для повышения эластичности капилляров и кровеносных сосудов. Следующий флавоноид – робинин [8].
Основной целью наших исследований было получение извлечений из лекарственного растительного сырья, содержащего флавоноиды, основным компонентом которых были рутин и робинин. Выбор был остановлен на двух растительных объектах – гинкго двулопастном и астрагале серпоплодном, флавоноиды которых представлены в том числе, рутином и робинином.
Был получен жидкий экстракт гинкго двулопастного листьев с использованием в качестве экстрагента спирто-водной смеси 70% концентрации. Для получения серии экстрактов была проведена стандартизация сырья по содержанию флавоноидов%.
Извлечения для анализа получали, используя разработанные ранее методики, в качестве экстрагента использоалась спирто-водная смесь 70% концентрации. Таким образом, было определено содержание флавоноидов, в пересчете на рутин – 5.1% [3].
Получение жидкого экстракта гинкго двулопастного листьев (1:1). Для этого был использован метод реперколяции с завершенным циклом (батарея из 5 диффузоров), соотношение сырье : экстрагент на ступени экстракции 1:4.5. Экстрагент – спирт этиловый 70% [7].
Сырье загружали поочередно в диффузоры и заливали экстрагентом. Масса сырья и порции экстрагента во всех диффузорах были одинаковые.
Нормировали качество экстракта жидкого по содержанию суммы флавоноидов, содержанию сухого остатка и плотности. Обнаружение флавоноидов в исследуемом экстракте осуществляли, как указано в разделе материалы и методы, посредством цианидиновой пробы.
Просмотр хроматограммы в УФ-свете при длине волны 254±2 нм позволяет обнаружить 2 зоны адсорбции фиолетового цвета, расположение которых находится выше зоны на хроматограмме раствора СО рутина, а при обработке раствором диазобензолсульфокислоты в видимом свете также обнаруживались 2 зоны адсорбции желто-оранжевого цвета со значениями Rf 0.9 и 0.5 соответственно, что соответствует литературным данным [17].
Комплекс с раствором алюминия хлорида формирует максимум поглощения при 406 нм, который совпал с максимум поглощения спектра рутина с алюминия хлоридом и это позволяет проводить анализ при длине волны 254 нм (рис. 1, 2, 3).

Рис. 1. Спектр поглощения 0.002% раствора СО рутина с алюминия хлоридом
Fig. 1. Absorption spectrum of 0.002% CO solution of rutin with aluminum chloride
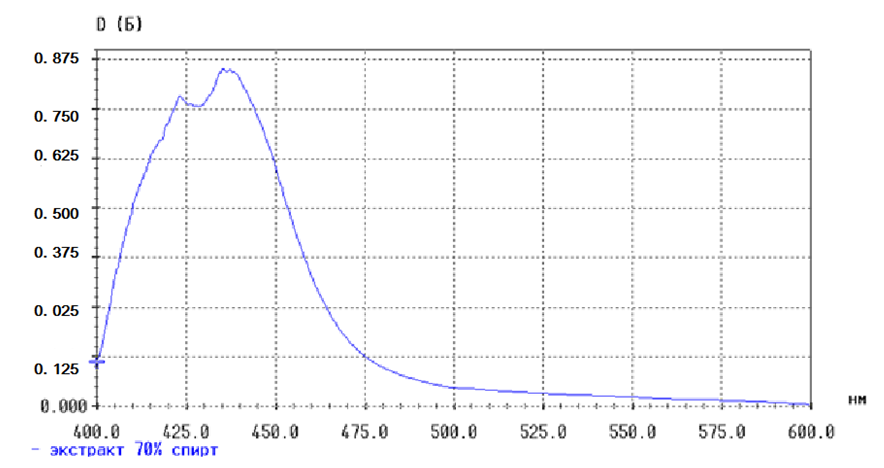
Рис. 2. Спектр поглощения экстракта Гингко двулопастного жидкого с алюминия хлоридом
Fig. 2. Absorption spectrum of Gingko extract of bilobate liquid with aluminum chloride
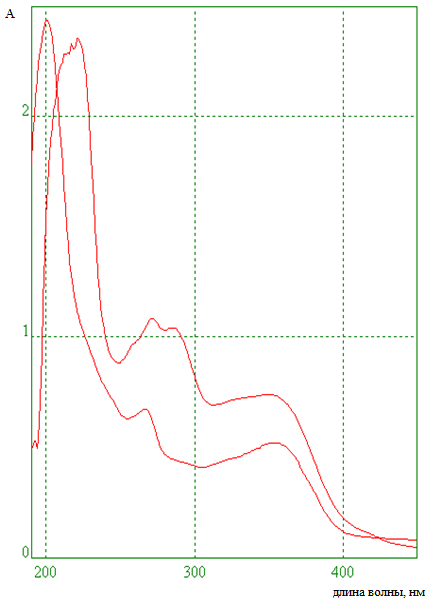
Рис. 3. Спектры поглощения этанольного извлечения астрагала серпоплодного (1) и стандартного образца робинина (2)
Fig. 3. Absorption spectra of ethanol extract of astragalus seroplodnogo (1) and standard sample of robinin (2)
Результаты количественного определения флавоноидов в экстракте гинкго двулопастного листьях жидком методом дифференциальной спектрофотометрии представлены в таблице 1.
В жидком экстракте листьев гинкго двулопастного содержится около 5.0% суммы флавоноидов в пересчете на рутин (дифференциальная спектрофотометрия).
Оценку качества экстрактов проводили на основании анализа 5 лабораторных серий (таблица 2) согласно ГФ ХIII [6]. Эффективность экстракции составила 87-90%.
Таблица 1
Содержание суммы флавоноидов в жидком экстракте методом дифференциальной спектрофотометрии
Table 1
The content of the sum of flavonoids in a liquid extract by differential spectrophotometry
№ п/п | Оптическая плотность, А | Содержание, % | Метрологические |
1 | 0.802 | 5.09 | Х̅= 5.08 S=0.198 SХ̅=0.07 𝛥Х̅=0.18 ε=±3.53 % |
2 | 0.875 | 5.12 | |
3 | 0.824 | 5.34 | |
4 | 0.799 | 4.85 | |
5 | 0.923 | 5.24 | |
6 | 0.831 | 4.86 |
Оценка качества экстракта Гингко двулопастного листьев жидкого
Table 2
Evaluation of the quality of the liquid Gingko extract of bilobate leaf
Номер серии | Экстрактивные | Плотность, г/см3 | Содержание суммы флавоноидов в % (в пересчете на рутин) |
01 | 25.7 | 0.968 | 4.76 |
02 | 29.4 | 0.961 | 4.89 |
03 | 32.7 | 0.960 | 5.40 |
04 | 26.0 | 0.961 | 5.04 |
05 | 31.8 | 0.965 | 5.34 |
Таким образом, получен экстракт гинкго двулопастного листьев жидкий, содержание флавоноидов в котором (в пересчете на рутин) составило не менее 5%, содержание экстрактивных веществ до 30%. Экстрагирование листьев гинкго двулопастного спиртом этиловым 70% представляет интерес из-за того, что позволяет извлечь значительное количество экстрактивных веществ (до 30%), в том числе около 5% флавоноидов (в пересчете на рутин). Это даёт возможность получить из листьев гинкго двулопастного высокоэффективный препарат с ярко выраженным противовоспалительным, мембраностабилизирующим, капилляропротекторным действием. Использование в технологии экстракта листьев гинкго двулопастного жидкого основ ресурсосберегающей технологии позволяет довести эффективность процесса экстрагирования до 90%
Извлечения получали методом бисмацерации, по методике указанной в разделе материалы и методы. Оба извлечения объединяются [13].
Так как полученные настаиванием вытяжки представляли собой не прозрачные жидкости с определенным количеством взвешенных частиц, требовалась обязательная очистка.
Очищали полученные спирто-водные извлечения с помощью фильтрации через двойной слой марли и их отстаивания в прохладном и темном месте. Выпавшие балластные вещества, повторно отфильтровывали [2].
Выбор был сделан в пользу периодической фильтрации и фильтрации под давлением.
Качественный анализ флавоноидов
На хроматограмме обнаружена зона, значение Rf которой совпадает со значением показателя Rf стандартного образца робинина (Rf = 0.25).
Как описано выше, в методах исследования, количественное содержание суммы флавоноидов определяли спектрофотометрически с использованием стандартного образца (Robinin, Kaempferol 3-O-robinoside-7-O-rhamnoside, Sigma). Показания снимали на спектрофотометре ЮНИКО 2802S (длина волны 354±2 нм). Определяли оптическую плотность стандартного образца робинина. В качестве раствора сравнения использовали 70% этанол [23].
Эксперимент показал, что содержание суммы флавоноидов в пересчете на робинин в исследуемом сырье составляет 4.21÷4.30 %.
На основании полученных данных, можно сделать заключение о соответствии изучаемого объекта второй категории микробиологической чистоты [19]. Результаты исследования представлены в таблице 3.
Установление срока годности проводили на 5 опытных сериях по следующим критериям: внешний вид, цвет и запах, микробиологическая чистота, качественный и количественный анализ. Результаты определения срока годности приведены в таблице 4.
Таблица 3
Микробиологическая чистота спирто-водного извлечения астрагала серпоплодного
Table 3
Microbiological purity of alcohol-water extraction of astragalus falcatus
Вид | Общее количество бактерий | Общее количество грибов | Энтеробактерии и другие грамотрицательные бактерии | E. coli | Salmonella | S. aureus | Pseudomonas aeruginosa |
КОЕ* в 1 мл продукции | в 1 мл продукции | ||||||
Норма | не более 102 в 1 мл (суммарно) | не более 101 | отсутствие | отсутствие | отсутствие | отсутствие | |
Спирто-водное извлечение астрагала серпоплодного | 5 ٠101 | 3 ٠101 | не обнаружено | нет | нет | нет | не |
* КОЕ – колониеобразующих единиц в 1 г или 1 см3 продукции
Таблица 4
Результаты определения срока годности спирто-водного извлечения астрагала серпоплодного
Table 4
Results of determination of shelf life of alcohol-water extraction of astragalus falcatus
Наименование | Характеристика (СанПиН 1.2.681-97) | Сроки хранения | ||||
Извлечение | ||||||
6 мес | 12 мес | 18 мес | 24 мес | 30 мес | ||
Внешний вид | однородная масса | соответствует | ||||
Цвет | соответствовать |
желто-коричневого цвета | ||||
Запах | соответствовать | с характерным запахом айвы | ||||
Микробиологи- ческая чистота (на 1 г.) | не более 102 аэробных бактерий и грибов (суммарно), не более 101 бактерий семейства Enterobacteriaceae и других грамотрицательных бактерий, отсутствие Pseudomonas aeruginosa и Staphylococcus aureus (Категория 2 по ГФ-XII) | соответствует | соответствует | соответствует | соответствует | не соответствует |
Качественный анализ (флавоноиды) | реакции положительные | Реакций | ||||
Количественный анализ (флавоноиды) | 3.990 | 2.750 | 0.599 | 0.267 | - | |
Наиболее важными сторонами экстракции является изучение технологических параметров сырья и выбор экстрагента. Тщательное изучение этих показателей послужило экспериментальной основой настоящего фрагмента.
В жидком экстракте листьев гинкго двулопастного содержится около 5.0% суммы флавоноидов в пересчете на рутин (дифференциальная спектрофотометрия).
Оценку качества экстрактов проводили на основании анализа 5 лабораторных серий (таблица 2) согласно ГФ ХIII [6]. Эффективность экстракции составила 87-90%.
Заключение. Таким образом, установлено, что оптимальными методами экстракции из изучаемых объектов явлются динамические методы. Для гинкго двулопастного оптимальным является метод реперколяции (батарея из 5 перколяторов), при соотношении сырья и экстрагента на ступени экстракции 1:4.5. Оптимальным методом экстракции из астрагала серпоплодного является метод бисмацерации. Соотношение сырье: экстрагент – 1:8 (дробная мацерация с использованием 2/3 и 1/3 экстрагента). Оптимальная концентрация экстрагента спирта этилового в обоих случаях является 70%. Проведена экспериментально, оценка качества сырья и фитоэкстрактов по одному показателю, что позволяет подтвердить теоретические расчеты.
В отношении данной статьи не было зарегистрировано конфликта интересов.





















Список литературы