ЭКСПРЕССИЯ ТОЛЛ-ПОДОБНЫХ РЕЦЕПТОРОВ В ЖЕНСКОМ РЕПРОДУКТИВНОМ ТРАКТЕ И ЕЕ ГОРМОНАЛЬНАЯ РЕГУЛЯЦИЯ (ОБЗОР)
Aннотация
Актуальность: Толл-подобные рецепторы (TLR) являются основными рецепторами системы врожденного иммунитета, первыми распознающими лиганды бактерий, вирусов, грибов и простейших и инициирующими иммунный ответ.Однако комплексных обзоров, включающих новые данные об экспрессии и функции TLR во всех отделах женских половых путей (в том числе в яичниках и маточных трубах) и влиянии на них половых гормонов, до настоящего времени не проводилось. Цель исследования: Провести анализ данных литературы, посвященной экспрессии TLRво влагалище, экто- и эндоцервиксе, матке, маточных трубах и яичниках и ее гормональной регуляции. Материалы и методы: Проведен анализ публикаций по теме исследования в базах данных Pubmed, GoogleAcademy, Scopus, Elibrary, ResearchGate, EBSCO за последние 20 лет. Результаты: В обзоре представлены новые данные об экспрессии TLR во влагалище, экто- и эндоцервиксе, матке, маточных трубах и яичниках. Описана роль TLR не только в индукции иммунного ответа и обеспечении защиты от инфекций, но и в регуляции капацитации сперматозоидов и в оплодотворении. Дана оценка влияния половых гормонов (эстрадиола, прогестерона) на экспрессию и функцию TLR. Заключение: Все отделы женских половых путей экспрессируют TLR. Экспрессия TLR находится под влиянием половых гормонов и является максимальной в секреторную фазу цикла. TLR принимают участие не только в защите репродуктивного тракта от инфекций, но и в процессах репродукции (капацитации, оплодотворении, защите гамет и эмбрионов).
Ключевые слова: толл-подобные рецепторы, TLR, врожденный иммунитет, инфекции, капацитация, оплодотворение, эстрадиол, прогестерон
Введение. Особенностью репродуктивной системы женщины является ее способность осуществлять защиту от патогенных и условно-патогенных микроорганизмов, обеспечивать оплодотворение и развитие плода, а также поддерживать тканевой гомеостаз в ответ на физиологическую травму тканей (десквамацию эндометрия, овуляцию).
Основными звеньями антиинфекционной защиты репродуктивного тракта являются эпителий слизистой оболочки, клетки иммунной системы и продуцируемые ими биологически активные вещества, а также нормальная микрофлора влагалища. Все эти компоненты зависят от эндо- и экзогенных воздействий, главными из которых являются эндокринные.
Первой линией иммунной защиты является система врожденного (неспецифического) иммунитета, способная распознавать консервативные структуры бактерий, вирусов, грибов, простейших, а также вещества, образующиеся при повреждении клеток организма хозяина.
TLR и их сигнальные пути
Основными рецепторами системы врожденного иммунитета являются Толл-подобные рецепторы (TLR). TLR экспрессируются на эпителиальных клетках, моноцитах, макрофагах, дендритных клетках, нейтрофилах и натуральных киллерах [1, 2]. Есть также данные о том, что TLR есть и на клетках системы адаптивного (приобретенного) иммунитета – Т- и B- лимфоцитах [3]. TLR способны запускать и регулировать интенсивность иммунного ответа, стимулируя синтез провоспалительных цитокинов, хемокинов, антимикробных пептидов и активируя систему адаптивного иммунитета.
У человека существует 10 TLR, каждый из которых связывается со специфическими лигандами. В целом лиганды TLR можно разделить на две большие группы: патоген-ассоциированные молекулярные паттерны (pathogen-associated molecular patterns, PAMPs) и молекулярные паттерны, ассоциированные с повреждением (danger-associated molecular patterns, DAMPs) [2]. Спектр натуральных и синтетических лигандов, способных активировать TLR, широко описан в литературе [4, 5, 6]. Основные лиганды и сигнальные пути TLR представлены на рисунках 1 и 2.
TLR1, TLR2, TLR4, TLR5, TLR6 и TLR10 располагаются на клеточной мембране и распознают бактериальные лиганды. TLR3, TLR7, TLR8 и TLR9 экспрессируются в цитоплазматических органеллах, преимущественно в эндосомах, лизосомах, эндолизосомах и эндоплазматическом ретикулуме. TLR3 распознает двухцепочечную РНК вирусов, TLR7 и TLR8 распознают преимущественно собственную и вирусную одноцепочечную РНК. TLR9 распознает неметилированную ДНК, преимущественно бактериальной природы [6, 7]. Лиганд TLR10 неизвестен, но предполагают, что он имеет бактериальную природу [8].
Все TLR, за исключением TLR3, используют MyD88-зависимый путь передачи сигнала. TLR3 использует для передачи сигнала адаптерную молекулу TRIF (MyD88-независимый путь передачи сигнала). TLR4 является единственным рецептором, который может использовать для передачи сигнала как MyD88, так и TRIF. Для его активации также необходим белок TRAM. В конечном итоге все вышеуказанные сигнальные пути активируют нуклеарный фактор-kB (NF-kB) и активаторный белок-1 (AP-1). Эта особенность является общей для всех TLR и приводит к синтезу провоспалительных цитокинов, основными из которых являются интерлейкин-6 (IL-6) и интерлейкин-8 (IL-8). TLR3, TLR4, TLR7, TLR8 и TLR9 также активируют интерферон-регулирующий фактор (IRF) 3 и/или IRF7, что приводит к синтезу интерферонов a и b [6, 9].
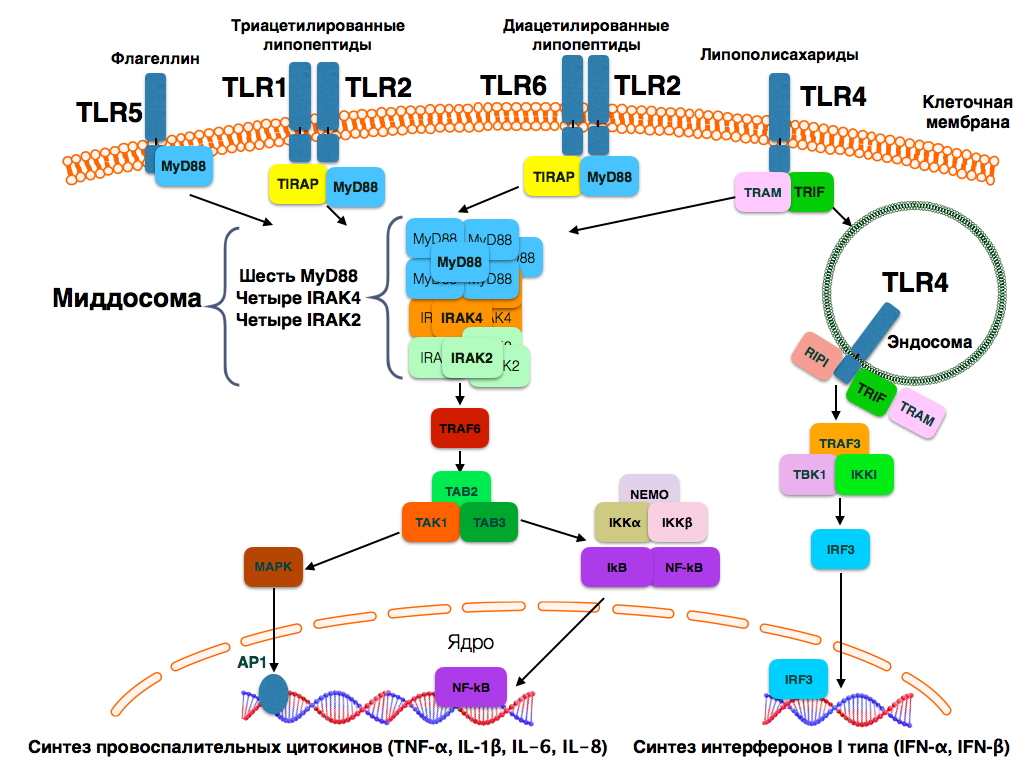
Рис. 1. TLR, распознающие преимущественно бактериальные лиганды, и их сигнальные пути
(по S. Pandey et al. (2015) [6], в модификации)
Fig. 1. TLR, recognizing predominantly bacterial ligands, and their signal pathways
(by S. Pandey et al. (2015) [6], in modification)
TLR обнаружены во всех отделах женской репродуктивной системы. В настоящее время доказано их участие не только в защите от неспецифических и специфических микроорганизмов, но и в регуляции овуляции, капацитации сперматозоидов, оплодотворении, имплантации, течении беременности и родов [10, 11, 12, 13, 14, 15, 16, 17].
Экспрессия TLR в женском репродуктивном тракте.
Влагалище и шейка матки. Эпителиоциты влагалища, влагалищной части шeйки матки и эндоцервикса экспрессируют все типы TLR. TLR2 также экспрессируются в гладкомышечных клетках влагалища, TLR5 – в гладкомышечных клетках влагалища и эндотелии его сосудов, а TLR3 и TLR6 – в стромальных фибробластах. В шейке матки экспрессия TLR1 , TLR2 и TLR4 обнаружена в гладкомышечных клетках, TLR5 – в гладкомышечных клетках и эндотелии сосудов, TLR3 – в стромальных фибробластах [15].

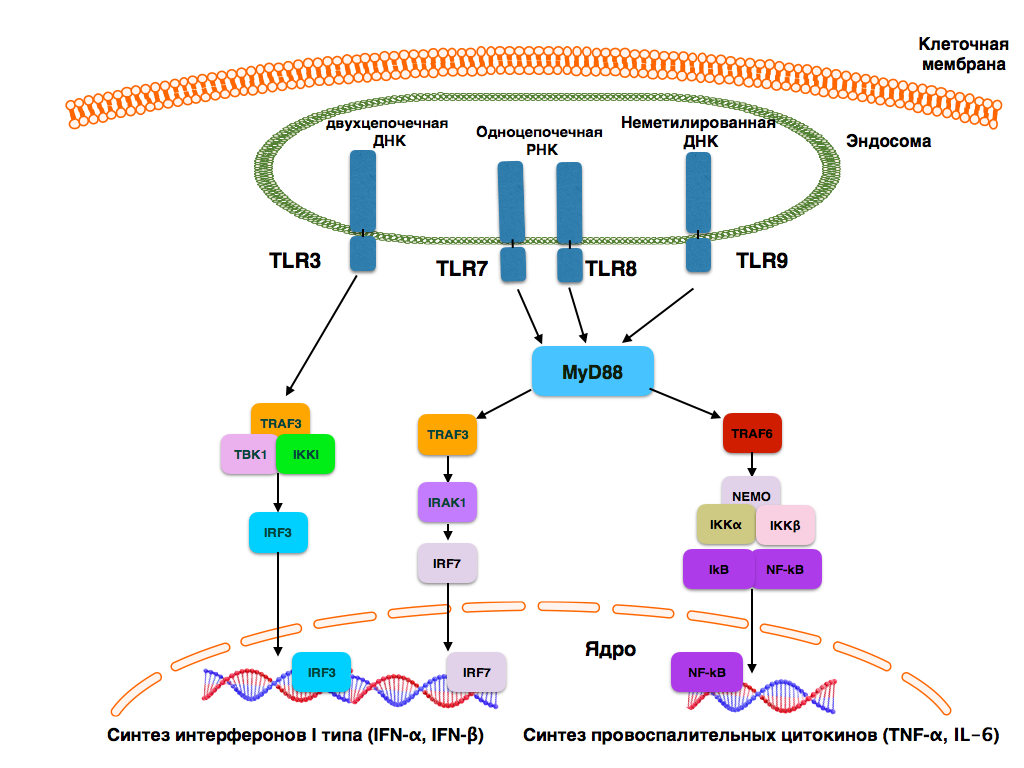
Рис. 2. TLR, распознающие преимущественно вирусные лиганды, и их сигнальные пути
(по S. Pandey et al. (2015) [6], в модификации)
Fig. 2. TLR, recognizing predominantly viral ligands, and their signal pathways
(by S. Pandey et al. (2015) [6], in modification)
Известно, что экспрессия TLR2 и TLR4 гораздо меньше в нижних отделах женский половых путей по сравнению с верхними отделами. Это свидетельствует о том, что индукция иммунного ответа в нижних отделах половых путей значительно снижена в связи с наличием собственной нормальной микрофлоры, в то время как верхние отделы способны индуцировать выраженный иммунный ответ при попадании микроорганизмов [18]. В то же время TLR7, TLR8 и TLR9 равномерно экспрессируются на протяжении всех отделов женских половых путей, что свидетельствует о том, что распознавание вирусов происходит в них практически одинаково [19, 20].
Эндометрий. В эпителиальных клетках и строме эндометрия экспрессируются все типы TLR [21, 22]. Экспрессия TLR на уровне матричной РНК (мРНК), белка, а также наличие функционального ответа на лиганды (выработка цитокинов) представлены в таблице 1 [23].
Таблица 1
Экспрессия мРНК и белка TLR, а также их функциональный ответ в клетках эпителия и стромы эндометрия (по SheldonI.M., BromfeldJ.J., 2011 [23], с дополнениями)
Table 1
mRNA and protein expression of TLR and their function in epithelial cells and stroma of endometrium (by Sheldon I.M., Bromfeld J.J., 2011 [23], with additions)
Рецептор | мРНК | Белок | Функция |
TLR1 | Эпителий [24] | Эпителий [29] | Эпителий [31] |
TLR2 | Эпителий [24, 25] Строма [25, 26] | Эпителий [18, 25, 29] Строма [25] | Эпителий [31] |
TLR3 | Эпителий [24, 25, 27] | Эпителий [29, 30] | Эпителий [27] |
TLR4 | Эпителий [24, 26] Строма [25, 26] | Эпителий [18, 26, 29, 30] Строма [25, 26] | Эпителий [26, 31] Строма [26] |
TLR5 | Эпителий [24] | Эпителий [29] | Эпителий [32] |
TLR6 | Эпителий [24, 27] | Эпителий [29] |
|
TLR7 | Эпителий [27] | Эпителий [28] Строма [28] | Эпителий [19] |
TLR8 | Эпителий [27] | Эпителий [28] Строма [28] | Эпителий [19] |
TLR9 | Эпителий [24] Строма [28] | Эпителий [28] Строма [28] | Эпителий [19] |
TLR10 | Не выделен/ Эпителий [24, 27] | Эпителий [28] Строма [28] | Лиганд неизвестен |
TLR1 также экспрессируется в натуральных киллерах, эндотелии и гладкомышечных клетках матки, TLR2 – в натуральных киллерах, TLR3 и TLR7 – клетках стромы и натуральных киллерах, TLR4 – в гладкомышечных клетках и натуральных киллерах, TLR8, TLR9 и TLR10 – в клетках стромы [15].
Маточные трубы. Маточные трубы представляют собой орган, выполняющий важную роль в трансфере гамет, завершении их созревания, оплодотворении, раннем развитии эмбриона и его транспорте в полость матки [33]. В маточной трубе выделяют 3 слоя: слизистая оболочка, мышечный и серозный слой. Слизистая оболочка представлена однослойным цилиндрическим реснитчатым эпителием, между клетками которого имеются низкие эпителиальные секреторные клетки [34]. Эпителий маточных труб подвергается циклическим изменениям под действием эстрогенов и прогестерона [33].
Эпителий маточных труб функционирует как часть системы врожденного иммунитета, осуществляя защиту от патогенов, попадающих в верхние отделы половых путей. В маточных трубах была выявлена экспрессия мРНК TLR 1-10, а также белка их сигнального пути MyD88 и рецептора CD14 (образующего комплекс с TLR4 на клетках миелоидного ряда для распознавания липополисахаридов) [17, 18, 19]. Экспрессия TLR 1-6 в маточных трубах на уровне белка была выявлена методом иммуногистохимического анализа [18, 29]. Экспрессия TLR4 на уровне мРНК и белка была также выявлена в стромальных фибробластах маточных труб [35]. Однако в одном исследовании не удалось выявить экспрессию мРНК TLR10 в эпителии маточных труб у пациенток с пременопаузе [36].
F. Amjadi et al. (2018) при раздельном культивировании клеток реснитчатого эпителия и секреторных клеток маточных труб, полученных интраоперационно, установили, что они имеют различную экспрессию TLR (табл. 2).
Таблица 2
Экспрессия мРНК и белка TLR реснитчатыми и секреторными эпителиальными клетками и клетками стромы маточных труб (по AmjadiF. etal., 2018) [11]
Table 2
mRNA and protein expression of TLR by ciliated and non-ciliated (secretory) cells of the fallopian tubes (by Amjadi F. et al., 2018) [11]
Рецептор | Реснитчатый эпителий | Секреторный эпителий | Строма | ||
РНК | Белок | РНК | Белок | Белок | |
TLR1 | + | + | + | + | - |
TLR2 | + | + | + | + | - |
TLR3 | + | + | + | + | - |
TLR4 | + | + | + | + | - |
TLR5 | + | + | + | + | - |
TLR6 | + | + | + | + | - |
TLR7 | + | + | + | + | ± |
TLR8 | + | + | + | + | - |
TLR9 | + | + | + | - | ± |
TLR10 | + | + | + | - | - |
Методом иммуногистохимического исследования на уровне белка в клетках реснитчатого эпителия была выявлена экспрессия TLR 1-10, в то время как в клетках секреторного – только TLR 1-8. В клетках стромы наблюдалась только слабая экспрессия TLR7 и TLR9, в то время как остальные TLR не экспрессировались совсем. На уровне мРНК TLR 1-10 экспрессировались как в клетках реснитчатого эпителия, так и в секреторных клетках маточных труб. Тем не менее, в клетках реснитчатого эпителия экспрессия мРНК TLR 1-10 была достоверно выше. Выработка IL-6 и IL-8 в ответ на пептидогликан, полицитидиловую кислоту (poly I:C), CpG, форбол миристат ацетат, флагеллин и локсорибин также была достоверно выше в клетках реснитчатого эпителия. В то же время в другом исследовании не было выявлено активации TLR2 в эпителии маточных труб в ответ на зимозан (лиганд дрожжеподобных грибов) [36].
Роль экспрессии TLR в маточных трубах пока изучена недостаточно. Известно, что, наряду с распознаванием и элиминацией патогенов, они участвуют в процессах репродукции. Так, может происходить физиологическая стимуляция TLR3 и TLR5 в маточных трубах компонентами спермы, что, вероятно, необходимо для создания среды, обеспечивающей сохранность гамет и зиготы [37].
Стимуляция TLR приводит к выработке провоспалительных цитокинов и простагландинов, повышающих проницаемость сосудистой стенки и стимулирующих мышечные сокращения. IL-6 и IL-8, выработка которых увеличивается при стимуляции TLR, являются основными медиаторами воспалительного процесса. Однако их функция также не исчерпывается участием в иммунном ответе. Известно, что они принимают участие в дифференцировке клеток и развитии эмбриона [38].
Маточные трубы также играют большую роль в транспорте сперматозоидов, гамет и зиготы. Известно, что движения реснитчатого эпителия меняются в зависимости от уровня гормонов. Неблагоприятными факторами, нарушающими подвижность реснитчатого эпителия, являются инфекции, курение, а также эндометриоз [39, 40]. TLR способны распознавать как экзогенные, так и эндогенные лиганды и реагировать н них. В ответ на присутствие липополисахаридов в маточной трубе наблюдается увеличение движения секрета и частоты мерцания ресничек [41]. Также известно, что сигаретный дым, так же как и липополисахариды бактерий, способен стимулировать продукцию IL-8 в макрофагах путем активации TLR4 [42]. Однако влияние компонентов сигаретного дыма на экспрессию и функцию TLR в маточных трубах пока еще не изучалось. Тем не менее, можно предположить, что TLR играют более важную роль в защите от инфекций и в процессах репродукции, чем предполагалось ранее.
Яичники. Доказано, что TLR 1-9 экспрессируются гранулезными клетками и поверхностным эпителием яичника. В клетках стромы яичника большинство TLR не экспрессируются или выявляются в очень незначительном количестве (табл. 3) [43]. Экспрессия TLR10 в данной работе не изучалась.
Также была выявлена экспрессия TLR2, TLR4, TLR5, TLR6, TLR7, TLR9 и TLR10 в клетках яйценосного бугорка (cumulus oophorus), полученных у пациенток, которым проводилось экстракорпоральное оплодотворение (ЭКО) [44].
Исследование роли TLR эпителия яйценосного бугорка в процессах репродукции проводилось в эксперименте на мышах, у которых была выявлена экспрессия TLR2, TLR4, TLR8 и TLR9 [16, 45]. Перед овуляцией в яйценосном бугорке синтезируется матрикс, содержащий большое количество длинных фрагментов гиалуроновой кислоты, которые не распознаются TLR [46]. Однако во время овуляции яйцеклетка, окруженная клетками яйценосного бугорка, попадает в маточную трубу. При половом контакте сперматозоиды в результате акросомальной реакции выделяют гиалуронидазу, которая расщепляет длинные цепи гиалуроновой кислоты до коротких фрагментов, стимулирующих TLR2 и TLR4. Это приводит к выработке цитокинов и хемокинов через активацию NF-kB. Они, в свою очередь, стимулируют капацитацию сперматозоидов, тем самым увеличивая вероятность оплодотворения [45]. Тем не менее, мыши, нокаутированные по TLR4, успешно размножаются при выращивании в стерильных условиях [47, 48].
Таблица 3
Экспрессия TLR 1-9 на уровне белка, выявленная иммуногистохимическим методом, в яичнике (по ZhouM. etal., 2009) [43]
Table 3
Protein expression of TLR 1-9 in the ovary, detected by immunohistochemistry (by Zhou M. et al., 2009) [43]
| Эпителий | Строма |
TLR1 | + | - |
TLR2 | +++ | ± |
TLR3 | +++ | - |
TLR4 | +++ | ± |
TLR5 | +++ | - |
TLR6 | ++ | + |
TLR7 | + | - |
TLR8 | ++ | ± |
TLR9 | + | ± |
TLR также способны распознавать лиганды микроорганизмов в фолликулярной жидкости. Так, на модели животных (крысы) было показано, что липополисахариды стимулируют атрезию фолликулов и апоптоз гранулезных клеток, уменьшают выработку прогестерона [49], а invitro снижают способность гранулезных клеток синтезировать эстрадиол [50]. Так как на гранулезных клетках находятся TLR, которые первыми распознают липополисахариды, можно предположить, что данные эффекты опосредуются через них. TLR4, как отмечалось выше, способен распознавать также и компоненты табачного дыма. Известно, что они присутствуют в том числе и в тканях яичника, в том числе в фолликулярной жидкости [39]. Однако влияние компонентов табачного дыма на экспрессию и функциюTLR в гранулезных клетках не изучалось.
Влияние липополисахаридов на процесс оплодотворения было установлено при проведении ЭКО еще в 80-е годы прошлого века. Так, частота возникновения беременности составляла только 8%, если концентрации липополисахаридов в культуральной среде была >1 нг/мл, по сравнению с 32% в тех случаях, когда липополисахариды в культуральной среде не обнаруживались [51].
У пациенток с бедным ответом яичников в клетках фолликулярной жидкости (гранулезные клетки, клетки яйценосного бугорка), полученной при пункции фолликулов в программах ЭКО, было выявлено увеличение экспрессии мРНК TLR1, TLR2, TLR4, TLR5 и TLR6 по сравнению с пациентками того же возраста (< 35 лет) с нормальным овариальным ответом. При этом в фолликулярной жидкости у пациенток с бедным ответом яичников наблюдалось увеличение провоспалительных цитокинов (IL-6, IL-8 и фактора ингибирования миграции макрофагов (MIF)), синтезируемых при стимуляции вышеуказанных рецепторов [52]. Авторы предполагают, что активация TLR приводит к Fas-зависимой индукции апоптоза фолликулов. Кроме того, IL-6 снижает активность ароматазы в фолликулах, а IL-8 является хемокином для лимфоцитов и макрофагов. Они, в свою очередь, способствуют высвобождению активных форм кислорода, активирующих TLR2 и TLR6. Это может приводить к формированию порочного круга. Таким образом, наличие бактериальной инфекции в придатках матки и/или избыточный иммунный ответ на нее может быть причиной нарушений процесса фолликулогенеза.
Гормональная регуляция экспрессии TLR
в женском репродуктивно тракте
Женский репродуктивный тракт в течение менструального цикла находится под влиянием половых гормонов [20].
Хотя TLR экспрессируются в женских половых путях в течение всего менструального цикла, экспрессия TLR 2-6, TLR9 и TLR10 достоверно выше в секреторную фазу цикла [21, 28, 53, 54].
В фолликулярную фазу цикла, когда уровень прогестерона является наименьшим, уровень эстрадиола является наиболее высоким. Это может свидетельствовать об ингибирующем эффекте эстрадиола и/или стимулирующем влиянии прогестерона на экспрессию TLR в женских половых путях, особенно в эндометрии [17].
Чтобы установить влияние половых гормонов на экспрессию и функцию TLR, были проведены исследования на культурах клеток и выявлено, что эстрадиол invitro снижает экспрессию мРНК TLR4 в фибробластах матки и мРНК TLR2 и TLR6 в клеточной линии эпителия влагалища VK2, но не влияет на экспрессию других TLR [55, 56].
Прогестерон увеличивает экспрессию TLR4 в фибробластах, что позволяет предположить, что эти клетки более чувствительны к бактериальным патогенам в секреторной фазе цикла [25].
Эстрадиол также влияет на функцию TLR. Он подавляет секрецию MIF, IL-6 и IL-8, вызванную липополисахаридами (лигандами TLR4) и poly I:C (лигандом TLR3) в клетках эпителия матки [27, 38]. Прогестерон не оказывает влияния на синтез цитокинов, индуцированный poly I:C [55].
Кроме того, эстрадиол способен непосредственно влиять на NF-kB - ключевой белок сигнального пути TLR, ограничивая его транслокацию из цитоплазмы в ядро (и тем самым препятствуя запуску транскрипции генов цитокинов) и предотвращая деградацию ингибиторов NF-kB [57, 58]. Эстрадиол также стимулирует синтез секреторного ингибитора лейкоцитарных протеаз (SLPI) – антимикробного пептида с выраженным противовоспалительным действием, который способен ингибировать экспрессию NF-kB [59].
Zandieh et al. (2016) исследовали влияние эстрадиола и прогестерона в концентрациях, соответствующих фазам цикла, в культуре эпителиальных клеток маточных труб OE-E6/E7, экспрессирующих мРНК TLR 1-6. Авторы не выявили различий в экспрессии TLR в ответ на различные концентрации эстрадиола и прогестерона при их раздельном применении. Однако при изучении влияния комбинации данных гормонов, соответствующих различным фазам цикла, было выявлено увеличение экспрессии мРНК TLR 1-6 в сочетании их концентраций, соответствующих окну имплантации. При использовании антагониста эстрогеновых рецепторов фульвестранта и антагониста прогестероновых рецепторов мифепристона происходило подавление экспрессии TLR, индуцированной комбинированным действием эстрадиола и прогестерона [17].
Таким образом, экспрессия TLR в маточных трубах зависит от комбинированного действия эстрогенов и прогестерона и, так же как и в эндометрии, является максимальной в секреторную фазу цикла. По-видимому, это связано с необходимостью обеспечения максимальной защиты оплодотворенной яйцеклетки во время ее движения по маточной трубе.
На экспериментальной модели (мыши) было показано, что экспрессия TLR4 в яичнике увеличивается под действием фолликулостимулирующего гормона (ФСГ) и амфирегулина, который является лигандом рецептора эпидермального фактора роста (EGF) [16].
Известно, что половые гормоны влияют на функцию TLR не только в органах женского репродуктивного тракта, но и в клетках периферической крови [60]. Было показано, что в фолликулярную фазу наблюдаются более низкие уровни IL-6 и фактора некроза опухоли-a (TNF-a) при стимуляции агонистами TLR2; IL-1b, IL-6 и TNF-a при стимуляции липополисахаридами (лигандами TLR4) и IL-1b и TNF-a при стимуляции флагеллином (лигандом TLR5) по сравнению с лютеиновой фазой менструального цикла.
Заключение. Таким образом, экспрессия TLR в женском репродуктивном тракте неравномерна. Она отличается в нижних и верхних отделах половых путей. Нижние отделы адаптированы к нестерильной и постоянно меняющейся среде, содержащей разнообразные микроорганизмы, в то время как в верхних отделах задачей иммунной системы является поддержание стерильности, необходимой для развития эмбриона. TLR экспрессируются в маточных трубах и яичниках, принимая участие в защите гамет и зиготы, а также капацитации сперматозоидов и оплодотворении.
Экспрессия TLR в женском репродуктивном тракте зависит от уровней половых гормонов и является максимальной в секреторную фазу цикла. По-видимому, это связано с необходимостью поддержания стерильной среды в момент продвижения яйцеклетки, а затем и зиготы в полость матки. Роль TLR в процессах репродукции еще только изучается, но полученные данные уже говорят о том, что она гораздо шире, чем защита органов репродуктивной системы от патогенов.
Работа выполнена при поддержке гранта Президента РФ МД-2326.2017.7.
В отношении данной статьи не было зарегистрировано конфликта интересов.





















Список литературы