Влияние пептида KED на экспрессию коннексина и сиртуина при атеросклерозе и рестенозе у людей пожилого возраста
Aннотация
Актуальность: Несмотря на широкий спектр применения пептида KED, молекулярные механизмы все еще находятся в стадии изучения. Цель исследования: Изучить влияние пептида KED на экспрессию коннексина и сиртуина при атеросклерозе и рестенозе у людей пожилого возраста. Материалы и методы: Для исследования использовали культуры клеток полученные из аорты без признаков патологии, а также из аорты с признаками атеросклеротического поражения, аорты человека при рестенозе. Первичное выделение культуры проводили на чашках Петри (Sarstedt), с фибриногеновым покрытием (Gibco), далее, культивировали клетки во флаконах объемом 50 мл (Sarstedt 25 см2). Выращивание клеток проводили в культуральной среде во флаконе (5 мл) и в чашке Петри, диаметром 3,5 см (3 мл), а также в 1 мл на лунку 24-луночного планшета. В работе использовали стерильный раствор пептида KED в концентрации 100 мкг на 1 мл. Иммуноцитохимическое исследование проводили и использованием первичных моноклональных антител Connexin 37 (Dako, USA) и Sirtuin (Sirt) – 1 (Abcam, UK). Для оценки результатов иммуноцитохимического окрашивания использовали морфеметрический метод – систему компьютерного анализа микроскопических изображений, включающую микроскоп Olympus BX40. Результаты: Экспресcия Connexin37 в культуре эндотелия, взятого у пациента пожилого возраста, при атеросклерозе была снижена в 3.6 раза, а при стенозе – в 6,2 раза по сравнению с нормой. Пептид KED способствовал повышению в 1,6 раза экспрессии Connexin 37 в культурах эндотелиоцитов, пораженных атеросклерозом и в 2,3 раза в культурах, пораженных рестенозом. Экспрессия Sirt1 в эндотелии при атеросклерозе и рестенозе была в 2 раза ниже по сравнению с нормой. Пептид KED способствовал повышению в 1,5 раза экспрессии Sirt1 в культурах эндотелиоцитов, пораженных атеросклерозом и рестенозом. Заключение: Высокие уровни Endothelin1 в плазме крови наблюдаются при атеросклерозе, ишемии и гипертензии, следовательно, пептид KED, способствующий снижению синтеза этой молекулы, будет способствовать профилактике развития этой сердечнососудистой патологии.
Введение. Сердечно-сосудистые заболевания (ССЗ) занимают в мире одну из лидирующих позиций в ряду болезней с большим риском летального исхода [1, 2]. В большинстве стран основной причиной смертности населения в пожилом и старческом возрасте является ишемическая болезнь сердца (ИБС) (38-42%). По данным Всемирной организации здравоохранения (ВОЗ) в 30 и более процентах случаев смерть людей старше 60 лет вызывает инфаркт миокарда, резвившийся на почве выраженного атеросклероза аорты и коронарных артерий [3, 4].
Исследование механизмов, лежащих в основе старения эндотелиальных клеток сосудов, и изучение возможных методов регуляции этого процесса с использованием коротких вазопротекторных белковых молекул открывает перспективы для разработки вазо- и геропротекторных лекарственных средств, характеризующихся высоким уровнем эффективности и уменьшением побочных эффектов, предназначенных для терапии заболеваний сердечно-сосудистой системы организма [5, 6, 7].
Пептид КЕD обладает вазопротекторными свойствами, характеризуется широким спектром действия. Это соединение в комплексе со стандартными терапевтическими схемами с большой долей успеха используют при такой патологии, как атеросклероз. КЕD позволяет улучшить кровообращение в тканях мозга, нормализовать память, усилить интеллектуальные способности [8, 9]. При назначении пептида установлено повышение резистентности микрососудов кожного покрова у пациентов, имеющих в анамнезе гиповитаминоз [10, 11]. Дополнительно выявлен процесс нормализации циркуляции крови по капиллярам у крыс, болеющих пародонтитом, при введении пептида KED в виде инъекций [8]. Несмотря на широкий спектр применения пептида KED, молекулярные механизмы, лежащие в основе действия этого соединения, не изучены до конца на современном этапе.
Цель исследования – изучить влияние пептида KED на экспрессию коннексина и сиртуина при атеросклерозе и рестенозе у людей пожилого возраста.
Материалы и методы исследования. Для получения и создания культур клеток, используемых в исследовании, нормальные ткани аорты, в которых не были обнаружены патологические изменения, были изъяты из тела эмбриона человека на 21 неделе гестации в НИИ акушерства и гинекологии им Д.О. Отта (Санкт-Петербург). Материал аорты человека с признаками атеросклеротических изменений (4 фрагмента диаметром по 0,2 см) получили во время операции по аортокоронарному шунтированию от больного пожилого возраста (68 лет). Для исследования клеток аорты человека с признаками рестеноза (4 фрагмента ткани диаметр по 0,2 см) материал получили в ходе операции аортокоронарного шунтирования на сердце пациента пожилого возраста (71 года), осуществляемой в отделении кардиохирургии 1-ой городской клинической больницы им. Е.Е. Волосевич.
К работе приступили спустя 4 часа после получения образцов, хранение осуществлялось в холодильнике при +6°С.
В стерильных условиях ламинарного шкафа образцы были извлечены из транспортировочной емкости и помещены в чашку Петри, имеющую диаметр 7 см. Далее образцы были трижды промыты сбалансированным солевым раствором Хенкса (HBSS), содержащим антибиотики (пенициллин, стрептомицин, в концентрации 5 мг/мл) для удаления следов крови и секрета.
Под лупой (х10) было проведено максимально возможное отделение слоя эндотелиальных клеток (в пределах tunica intima) из пограничной зоны атеросклеротического повреждения. Стерильными ножницами материал разрезали на небольшие кусочки (объемом 1-2 мм3). Полученные кусочки переместили в центрифужные пробирки объемом по 15 мл, добавили 10 мл HBSS с 0,2% раствором коллагеназы I (Gibco, активность 205 ед./мг). 30 секунд пробы откручивали на вотрексе. Затем ткани инкубировали в термостате при 370C в течение 20 минут. Агрегаты клеток, полученные после инкубации, диспергировали путем пропускания их через пипетку (пипетировали). В течение 5 минут осаждали содержащий клетки супернатант в объеме 8 мл. Пробы центрифугировали в течение 5 мин при 400 g. Затем надосадочную жидкость удаляли, растворяли осадок в 2 мл среды М199, содержащей 10% эмбриональную бычью сыворотку и антибиотик. Выделение повторяли циклически, в течение 3 раз, растворенный осадок собирали в отдельную пробирку.
Жизнеспособность клеток оценивали с использованием трипанового синего. Краситель прибавляли к 2 мл аликвоты, отобранной из 6 мл накопленных клеток, в соотношении 1:1. Подсчитывали число живых клеток с помощью камеры Горяева.
Культуральная среда включала в себя 87,5% среды M199, 10% эмбриональной бычьей сыворотки (FBS), 1% PES, 1,5% НЕРЕS, L-глутамин. Первичную культуру выделяли в чашках Петри (Sarstedt), покрытых предварительно раствором фибриногена (Gibco). Дальнейшее культивирование осуществлялось в обработанных флаконах объемом 50 мл (Sarstedt, 25 см2). Затем выращивали клетки при добавлении по 5 мл культуральной среды на один флакон и 3 мл культуральной среды на 1 чашку Петри (диаметр 3,5 см). При использовании 24-луночного планшета добавляли по 1 мл среды в каждую лунку.
По прошествии 5-7 дней первичная культура достигала стадии монослоя, проводили ее пересеивания. Еще через 3 дня, на 4-й осуществляли пассирование, в это время культура находилась в виде монослоя. При культивировании клеток проводили до 3 пассажей. Пептид KED добавляли к культуральной среде при каждом пересеивании в концентрации 20 нг/мл.
В работе был использован пептид KED, представляющий собой стерильный раствор, помещенный в ампулы, концентрация соединения составила 100 мкг в 1 мл. Для введения в культуры клеток ампульный раствор разводили до концентрации 20 нг/мл для диссоциированного культивирования, т.к. ранее было показано, что данная концентрация является физиологической для организма и максимально эффективной.
Для проведения иммуноцитохимического исследования были применены первичные моноклональные антитела Connexin 37 (Dako, USA) и Sirtuin (Sirt) – 1 (Abcam, UK). Инкубация с первичными антителами проходила 60 мин. Со вторичными антителами, конъюгированными с флуорохромом Alexa Fluor 567 (1:1000, Abcam), пробы инкубировали в течение 30 минут при комнатной температуре, в темноте (красное свечение). В случае использования флуорохрома Alexa Fluor 488 (1:1000, Abcam) инкубацию клеток осуществляли в течение 30 минут при комнатной температуре, в темноте (зеленое свечение). В конце готовые препараты помещали под покровные стекла в монтирующую среду Dako Fluorescent Mounting Medium (Dako, США).
Результаты иммуноцитохимического окрашивания оценивали с помощью морфометрического исследования. Компьютерный анализ микроскопических изображений осуществляли с применением системы, включающей в себя микроскоп Olympus BX40, цифровую камеру Olympus, персональный компьютер на основе Intel Pentium 5, программное обеспечение «Vidеotest Morphology 5.2». Из каждой пробы изучали по 5 полей зрения при увеличении х200.
Измеряли площадь экспрессии, как отношение площади, на которой находились иммунопозитивные клетки, к общей площади клеток в поле зрения. Данный показатель выражали в процентном отношении для маркеров с цитоплазматическим окрашиванием. Дополнительно рассчитывали отношение площади с иммунопозитивными ядрами к общей площади ядер в поле зрения для маркеров с ядерной экспрессией.
Полученные данные обрабатывали методами вариационной статистики. С помощью программы Statistica 11,0 рассчитывали среднее арифметическое, стандартное отклонения и доверительный интервал. Для определения вида распределения применяли критерий Шапиро-Уилка (Shapiro-Wilk’s W-test), использовали множественное сравнение с помощью критерия Манна-Уитни. Критерий Стьюдента применяли в отношении групп с незначительным разбросом значений. Критический уровень достоверности нулевой гипотезы (об отсутствии различий) принимали равным 0,01.
Результаты и их обсуждение. В ходе эксперимента было установлено, что в культуре клеток, полученных из нормального эндотелия, экспрессия молекул Connexin 37 составила 8,4±0,3%. В пробах с добавлением пептида KED площадь экспрессии достоверно не отличалась от контроля, и составила 8,9±0,4% (рис. 1).
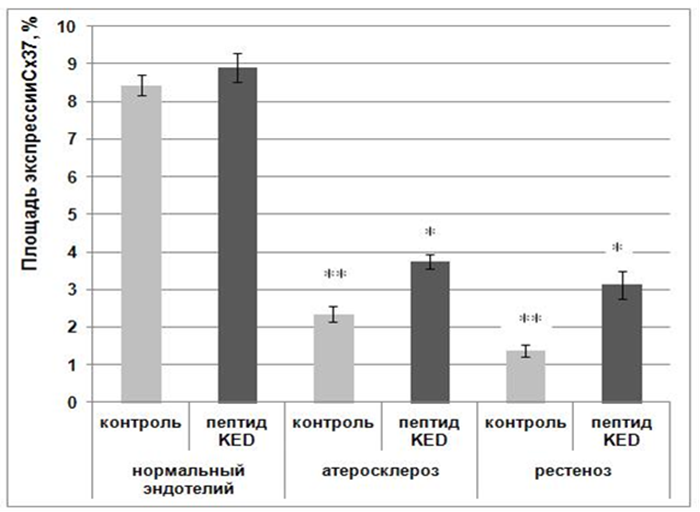

* - р<0,01 по сравнению с соответствующим контролем;
** - р<0,01 по сравнению с группой «контроль, нормальный эндотелий, без добавления пептида» (сравнение между группами проведено по критерию Стьюдента).
* - p <0.01 compared with the corresponding control;
** - p <0.01 compared with the “control, normal endothelium, without the addition of peptide” group (comparison between groups was carried out according to Student's criterion).
Рис. 1. Площадь экспрессии Connexin 37 в культуре эндотелия в норме, при атеросклерозе и рестенозе
Fig. 1. The area of expression of Connexin 37 in endothelial culture is normal, in atherosclerosis and restenosis
В контрольных пробах эндотелиальных клеток, собранных от пациента с признаками атеросклероза, установлено снижение площади экспрессии Connexin 37 в 3,6 раза по сравнению с нормальным эндотелием (2,3±0,2%). При добавлении пептида KED к данным клеткам экспрессии Connexin 37 в культуре достоверно снижалась в 1,6 раза (3,6±0,2%) относительно контроля. Площадь экспрессии Connexin 37В в культуре клеток эндотелия с признаками рестеноза составила 1,4±0,2%, снизилась в 6,2 раза по сравнению с нормальными клетками. Добавление пептида KED способствовало повышению данного показателя в 2,3 раза до значения 3,1±0,4%.
В культуре нормальных эндотелиоцитов значение площади экспрессии фактора транскрипции Sirt1 в контроле составило 12,0±0,7%. Под действием пептида KED данное значение достоверно не изменялось и было равно 11,7±0,6% (рис. 2).

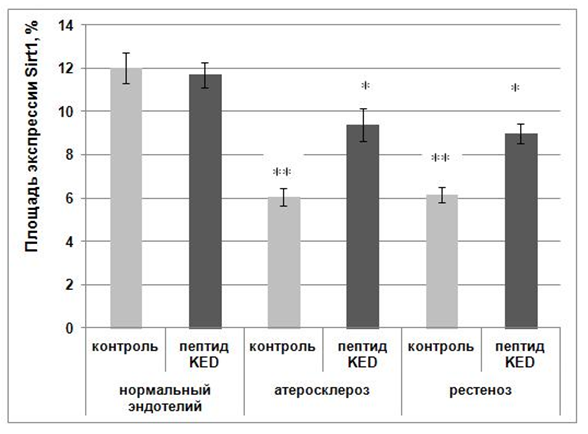
* - р<0,01 по сравнению с соответствующим контролем;
** - р<0,01 по сравнению с группой «контроль, нормальный эндотелий, без добавления пептида» (сравнение между группами проведено по критерию Манна-Уитни).
* - p <0.01 compared with the corresponding control;
** - p <0.01 as compared with the “control, normal endothelium, without peptide addition” group (comparison between groups was carried out according to the Mann-Whitney test).
Рис. 2. Площадь экспрессии Sirt1 в культуре эндотелия в норме, при атеросклерозе и рестенозе
Fig. 2. The area of expression of Sirt1 in culture of the endothelium is normal, in atherosclerosis and restenosis
В контрольной культуре клеток с атеросклеротическими изменениями площадь экспрессии молекул Sirt1 снизилась в 2 раза по сравнению с нормальным эндотелием и составила 6,0±0,4%. Под влиянием KED экспрессии Sirt1 в культуре пораженной атеросклерозом клеток возрастала в 1,5 раза по сравнению с нормой (9,4±0,8%) (рис. 2). В контрольной культуре эндотелия пациента с рестенозом площадь экспрессии Sirt1 составила 6,2±0,4%, в 2 раза ниже по отношению к нормальному эндотелию. Под влиянием пептида KED этот показатель возрастал в 1,5 раза относительно контроля и составил 9,0±0,5%.
Ранее было выдвинуто предположение, что возрастное снижение экспрессии сиртуинов Sirt1 и Sirt6 может служить маркером старения сердечно-сосудистой системы и предиктором развития атеросклероза [5, 12, 13, 14, 15, 16]. Полученные данные подтверждают эту гипотезу, т.к. выявлено снижение экспрессии Sirt1 в эндотелии, пораженном атеросклерозом. Кроме того, ускоренное восстановление синтеза этого белка, принимающего участие в процессах репарации ДНК, вызываемое приемом пептида KED, доказывает предполагаемую ранее действенность его использования в группе пожилых пациентов с заболеваниями сердца и сосудов.
В другой работе было показано снижение синтеза коннексина Cx37 при поражении аорты человека атеросклеротического характера и нарушении межклеточных взаимодействий, что подтверждено в следующих работах [2, 17]. Полученные результаты полностью согласуются с этими данными и указывают на роль пептида KED в восстановлении межклеточных контактов эндотелиоцитов.
Однако наибольший эффект пептид KED оказывал на экспрессию Endothelin1, снижая экспрессию этого белка до нормальных значений. Предполагается, что один из основных механизмов, лежащих в основе действия пептида KED, основан на регуляция экспрессии гена эндотелина-1. Запускаемый каскад реакций предотвращает развитие изменений, типичных для атеросклероза и рестеноза. Ранее показано, что низкие концентрации Endothelin-1 в норме обладают сосудорасширяющим эффектом, более высокие – активизируют рецепторы мембраны гладкомышечных клетках, вызывают вазоконстрикцию [6, 18, 19, 20].
Заключение. Один и тот же фактора участвует реализации двух противоположных сосудистых реакций, основанных на разных механизмах. Высокие уровни Endothelin1 в плазме крови наблюдаются при атеросклерозе, ишемии и гипертензии, следовательно, пептид KED, способствующий снижению синтеза этой молекулы, будет способствовать профилактике развития этой сердечно-сосудистой патологии.





















Список литературы