Прогнозирование несостоятельности рубца на матке путем оценки популяции тучных клеток
Aннотация
Актуальность: Основа формирования состоятельного рубца – адекватность репаративных процессов в стенке матки. Одним из резервов снижения частоты кесарева сечения – беременные с рубцом на матке. Данное обстоятельство является причиной дальнейшего совершенствования диагностики состояния послеоперационного рубца на матке у женщин, с кесаревым сечением в анамнезе, для расширения возможностей завершения беременности у них самостоятельными родами. Цель исследования: провести иммуногистохимическую оценку послеоперационных изменений миометрия для выявления женщин с высоким риском несостоятельности рубца стенки матки и развития гипотонического кровотечения в последующую беременность. Материалы и методы: В рамках исследования у 47 беременных проводилось морфологическое и иммуногистохимическое изучение миометрия нижне- маточного сегмента. 27 исследуемых образцов представляли собой рубцово- измененную ткань нижнего сегмента матки, после предыдущего кесарева сечения, а 20 образцов – были представлены «здоровым» миометрием из области разреза на матке во время первой операции кесарева сечения. Результаты: Образование рубца на матке сопровождается разобщением функциональной активности гладких миоцитов, что формирует структурную основу для ослабления эффективности их сократительной деятельности как единого пласта. Одновременно, происходит возрастание содержания и секреторной активности тучных клеток. В интактном миометрии, выявлено в 2 раза больше тучных клеток, не склонных к дегрануляции, тогда как в рубце на матке более чем в 2,4 раза увеличивается количество дегранулирующих тучных клеток. Кроме того, тучные клетки в рубце большего размера, с высоким содержанием триптазы, что позволяет нам думать об их активном участии в патогенезе формирующихся рубцовых изменений. Полученные данные позволяют рассматривать тучные клетки как таргентную мишень и управлять их деятельностью в раннем послеоперационном периоде. Заключение: Увеличение количества тучных клеток свидетельствует об их участии в патогенезе формирования рубцовой ткани, что способствует снижению полноценной сократительной активности миометрия.
Введение. В последние годы интерес ученых к проблеме кесарева сечения не потерян. В большей степени, это можно объяснить неуклонным ростом частоты абдоминального родоразрешения [1, 2]. Подобная ситуация поддерживается изменением акушерской стратегии в сторону расширения показаний к оперативному родоразрешению, преимущественно в связи с активной перинатальной позицией, а также возрастанием удельного веса беременных с рубцом на матке [2-5]. Рост частоты кесарева сечения дает акушерам новую проблему – ведения беременности и родоразрешение женщин группы высокого риска [6].
В настоящее время, по-прежнему отсутствуют достоверные методы оценки состоятельности рубца на матке после операции кесарева сечения обеспечивает целесообразность проведения исследований по изучению возможности использования морфологических и иммуногистохимических методов, в качестве диагностических критериев состоятельности рубца на матке [4, 7].
Цель исследования. Провести иммуногистохимическую оценку послеоперационных изменений миометрия для выявления женщин с высоким риском несостоятельности рубца стенки матки и развития гипотонического кровотечения в последующую беременность.
Материалы и методы исследования. В рамках исследования 47 беременным проводилось иммуногистохимическое изучение ткани миометрия нижне-маточного сегмента. 27 представленных препаратов являются тканью нижнего сегмента матки, измененную рубцом, после предыдущего кесарева сечения, а 20 изучаемых образцов представлены неизмененным миометрием из области разреза на матке во время первого кесарева сечения [8, 9]. Проводился сбор анамнестических данных, особенностей течения настоящей беременности, родов, предшествующих кесареву сечению. Подвергались анализу такие данные как, ультразвуковое исследование нижнего сегмента матки во время настоящей беременности, анализировались выписки из историй предыдущего кесарева сечения [10]. Беременность всех пациенток завершилась абдоминальным родоразрешением, с последующим иммуногистохимическим исследованием области нижне-маточного сегмента, полученного во время кесарева сечения [11]. У каждой пациентки было взято информированное согласие на проведение исследования. Ткань нижнего сегмента матки фиксировалась в 10% забуференном формалине и в течение 24 ч образцы доставлялись в лабораторию [12].
Результаты и их обсуждение. Одним из малоизученных и перспективных направлений является изучение поведения тучных клеток в рубцовой ткани, их воздействие на процессы фиброза и выбора в связи с этим наиболее эффективного способа профилактики гипотонического кровотечения у беременных женщин с рубцом на матке после предыдущего кесарева сечения [13].
Тучные клетки – постоянный компонент ткани миометрия и необходимы не только для регуляции местного гомеостаза, но и для выполнения сократительной функции. Биологические эффекты секреторной жидкости тучных клеток по отношению к внеклеточному матриксу и миоцитам дают возможность рассматривать их как важный диагностический критерий во время оценки функционального состояния нижне-маточного сегмента [12, 14, 15].
Очевидно, что в контрольной группе популяция тучных клеток миометрия нижне-маточного сегмента немногочисленна (табл. 1).
Таблица 1
Содержание тучных клеток в миометрии нижнего сегмента матки (на п/з)
Table 1
The number of mast cells in the myometrium of the lower uterine segment
Группа | Метод идентификации | |
Метахромазия | Триптаза | |
Норма | 2,75±0,25 | 3,08±0,42 |
Рубец | 4,4±0,41* | 5,38±0,47* |
Примечание: * – р<0,05 по сравнению с контрольной группой
Note: * – р<0.05 as compared with the control group
На фотографии представлены тучные клетки, расположенные в структурах эндомизия, они небольшие, располагаются в непосредственной близости от гладкомышечных элементов, концентрируются преимущественно в соединительной ткани, которая разделяет пласты миоцитов (рис. 1-А), а также локализуются периваскулярно (рис. 1-Б) [12, 16].
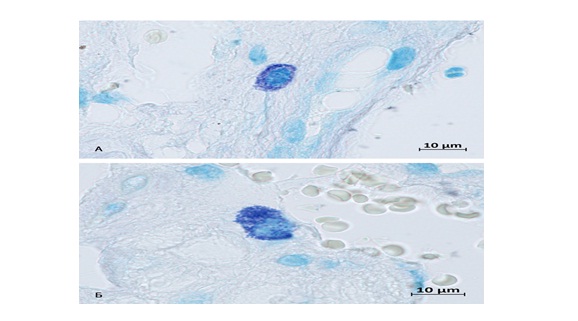
Рис.1. Тучные клетки нижнего сегмента матки. Группа контроля. Фиксация – 10% нейтральный формалин. Методика: окрашивание толуидиновым синим.
А – недегранулированная тучная клетка в контакте с гладким миоцитом;
Б – тучная клетка в периваскулярном пространстве.
Fig. 1. Mast cells of the lower uterine segment. The control group. Fixation – 10% of neutral formalin. The method used: staining with toluidine blue.
A – a non-degranulated mast cell in contact with a smooth myocyte;
Б – a mast cell in the perivascular space.
Здесь представлены дегранулирующие тучные клетки, становится очевидно, что интенсивность видимой дегрануляции крайне мала. Можно сделать вывод, что для того, чтобы регулировать сократительную деятельность гладких миоцитов, тучные клетки используют такие способы секреторных путей, как экзоцитоз (рис. 2-А), или трансгрануляцию (рис. 2-Б), которая происходит, во время контакта тучной клетки с гладким миоцитом [17, 18, 19].
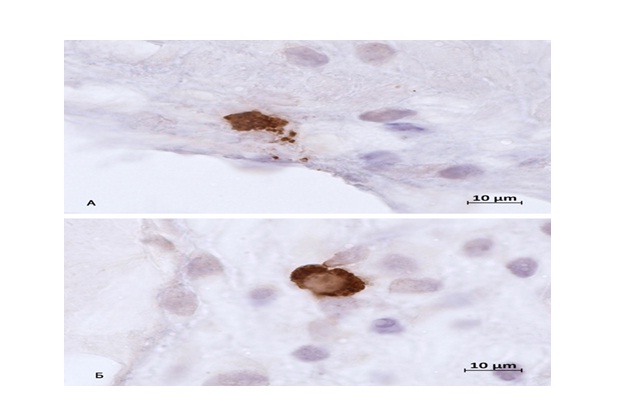
Рис. 2. Тучные клетки нижнего сегмента матки. Группа контроля. Фиксация – 10% нейтральный формалин. Методика: ИГХ-окрашивание триптазы тучных клеток
А – секреция триптаза-позитивных гранул в экстрацеллюлярный матрикс. Прилежание гранул к эндотелию;
Б – тучная клетка локализована среди гладких миоцитов.
Fig. 2. Mast cells of the lower uterine segment. The control group. Fixation – 10% of neutral formalin. The method used: IHC-staining of tryptase mast cells.
A – secretion of tryptase positive granules into extracellular matrix. The adjacent of the granules to the endothelium;
Б – a mast cell is located in smooth myocites.
После окрашивания толуидиновым синим, популяция тучных клеток оказалась меньшей, в сравнении с использованием в качестве идентификации иммуногистохимической детекции триптазы [12] (табл. 2). Очевидно, что это может быть связано с незначительным содержанием гепарина в тучных клетках миометрия, или же других гликозаминогликанов, которые необходимы для формирования эффекта метахромазии [9, 14, 16]. Поэтому для изучения тучных клеток миометрия эффективнее и показательнее использование иммуногистохимического окрашивания триптазы тучных клеток [19].
В образовании и эволюционировании рубца на матке необходимы тучные клетки, а также интенсивность их дегрануляции. Она оказалась несравненно более высокой в группе с рубцом на матке, нежели, чем в контрольной группе (табл. 2).
Таблица 2
Морфофункциональные типы тучных клеток в нижнем сегменте матки (после окрашивания толуидиновым синим) (%)
Table 2
Morphofunctional types of mast cells in the lower segment of the uterine scar (after staining it with toluidine blue) (%)
Тип тучной клетки | Норма | Рубец |
Недегранулированные | 68,3±3,2 | 34,7±3,6* |
Лизис гранул | 12,4±0,8 | 19,8±1,7* |
Экзоцитоз | 15,1±1,1 | 36,8±2,3* |
Формирование макровезикул | 4,2±0,3 | 8,7±0,4* |
Примечание: * – p<0,05 по сравнению с контрольной группой
Note: * – p<0.05 as compared with the control group
Однако, в группе с рубцом на матке интенсивность, а также способность тучных клеток к дегрануляции значительно возрастает (табл. 2), это дает основания полагать, что влияние биополимеров тучных клеток на внеклеточный матрикс является определяющим [9]. В ткани, измененной рубцом, возрастает численность тучных клеток, а также и их секреторная активность (рис. 3, 4).
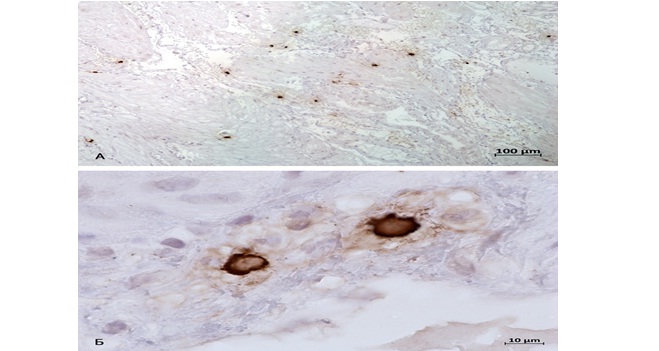
Рис. 3. Тучные клетки нижнего сегмента матки. Группа с рубцом. Фиксация – 10% нейтральный формалин. Методика: ИГХ-окрашивание триптазы тучных клеток
А – высокое количество ТК в стенке матки;
Б – активная секреция триптаза-позитивных гранул во внеклеточный матрикс.
Fig. 3. Mast cells of the lower uterine segment. The group of patients with a scar. Fixation – 10% of neutral formalin. The method used: IHC-staining of tryptase mast cells.
A – a high amount of mast cells in the uterine wall;
Б – active secretion of tryptase positive granules into extracellular matrix.
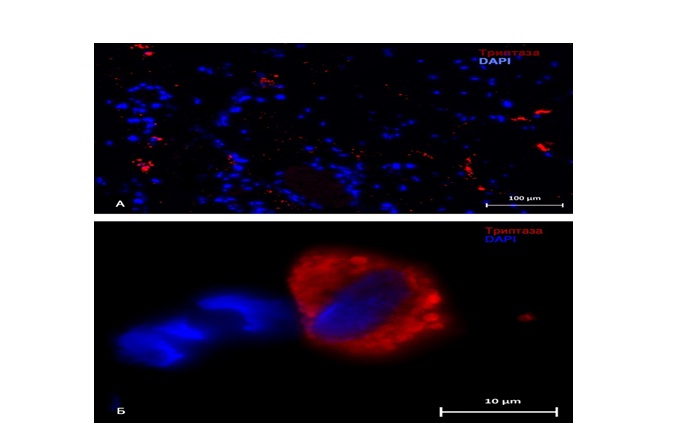
Рис. 4. Тучные клетки нижнего сегмента матки. Группа с рубцом. Фиксация – 10% нейтральный формалин. Методика: ИГХ-окрашивание триптазы тучных клеток, флуоресцентная детекция
А – высокое содержание триптаза-позитивных тучных клеток в строме стенки матки, активная дегрануляция триптаза-позитивных гранул;
Б – тучная клетка с высоким содержанием триптаза-позитивных гранул, триптаза-позитивная гранула в перицеллюлярном пространстве.
Fig. 4. Mast cells of the lower uterine segment. The group of patients with a scar. Fixation – 10% of neutral formalin. The method used: IHC-staining of tryptase mast cells.
A – a high amount of tryptase positive mast cells in the uterine wall, active degranulation of tryptase positive granules;
Б – a mast cell with a high amount of tryptase positive granules; a tryptase positive granule in the pericellular space
Это обстоятельство необходимо учесть как фактор риска для чрезмерного образования соединительной ткани в миометрии с дальнейшим прогрессированием процессов склерозирования в нижнем сегменте матки.
Чрезмерное увеличение численности тучных клеток в рубцовой ткани можно связать, во-первых, с излишним образованием соединительной ткани в области нижне- маточного сегмента [9]. Очевидно, что это является послеоперационной индукцией. Необходимо учитывать эту особенность тучных клеток участвовать в ремоделировании внеклеточного матрикса. В ситуации с рубцом на матке, это может быть расценено как причина формирования большого количества рубцовой ткани, а также компонентов внеклеточного матрикса, что является пусковым моментом в снижении функциональной активности миоцитов [15].
Кроме того, если говорить о способности тучных клеток к дегрануляции, прослеживается прямая зависимость высокой способности к дегрануляции в рубцовой ткани (рис. 3, 4-А). Тучные клетки обнаруживаются между веществом соединительной ткани и секретируют биологически активные вещества преимущественно в строму органа [9, 15].
Более того, тучные клетки в рубцовой ткани очевидно крупнее , с высоким содержанием триптазы, что говорит об их активном влиянии на в патогенез образования рубцовых изменений (рис. 4-Б).
Необходимо обратить внимание на сохранение контакта между триптаза-позитивными клетками и гладкими миоцитами ткани миометрия. Становится очевидно, что это может быть связано с провоцированием триптазы тучных клеток на митоз гладких миоцитов на данном участке матки при формировании рубцовой ткани, потенциальная возможность которой была показана целым рядом авторов в соответствующих экспериментах [5, 20].
Таким образом, корректировка регенерационной активности стенки матки после оперативного родоразрешения должна учитывать такую особенность как разрастание соединительной ткани, апоптоз гладких миоцитов и происходящие в них атрофические изменения. В этом случае, тучные клетки могут представлять собой одну из возможных таргетных мишеней в послеоперационном ведении пациенток, с целью профилактики формирования процессов склероза в рубце на матке [9].
Выводы:
- При изучении тканимиометрия с имеющимся рубцом выявляется следующее: возрастает численность тучных клеток и их секреторная активность. Во времяиммуногистохимического метода идентификации триптазы, при окрашивании препаратов толуидиновым синим, становитсяочевидно, что болееинтенсивная дегрануляция тучных клеток прослеживается в рубцово-измененной ткани. В интактном миометрии, обнаруживается в 2 раза больше недегранулированных тучных клеток, тогда как в препаратах с рубцом на матке более чем в 2,4 раза возрастает содержание тучных клеток, которые способны к дегрануляции.
- Полученные, в результате исследования, данные об увеличениичисленноститучных клеток вмиометрии, который измененрубцовой тканью, а также их влияние на процессы склерозирования, позволяют персонализировать алгоритмы для оказания медицинской помощи беременным женщинам, имеющим рубец на матке, после предыдущего кесарева сечения, прогнозировать возможности развития гипотонического кровотечения и выбрать наиболее эффективный в сложившихся условияхспособ его профилактики.
- Пациентки, перенесшие кесарево сечение, должны получать в стационаре подробную информацию об особенностях оперативного вмешательства, его технике, способе восстановления нижнего сегмента матки, качестве шовного материала, о течении раннего послеоперационного периода.
- Детальное изучение поведения тучных клеток, особенностей дегрануляции во время формирования рубца в интраоперационной зоне, позволит рационально воздействовать на регенерацию тканей, препятствовать избыточному склерозу и как следствие, получить «состоятельный» рубец на матке, который может стать резервом в снижении частоты абдоминального родоразрешения и улучшить репродуктивную функцию женщины в последующем.





















Список литературы