Возрастные изменения микроциркуляции: роль регулярной физической активности
Aннотация
Актуальность: Известна роль возрастных изменений в адаптивных ответах системы кровообращения. При этом наиболее важным звеном сердечно-сосудистой системы является микрососудистой русло, где осуществляется перфузия тканей и транскапиллярный обмен. Особые требования предъявляет к кровообращению мышечная нагрузка. Количественная оценка состояния микроциркуляторного русла до и после ее воздействия позволяет оценить резервные возможности системы микроциркуляции. Цель исследования: Исследование состояние микрососудистого русла и тканевой перфузии у тренированных и нетренированных лиц разного возраста. Материалы и методы: Микроциркуляцию исследовали с применением двух методов: биомикроскопии ногтевого ложа и лазерной доплеровской визуализации (EasyLDI, Швейцария). Результаты: В состоянии покоя в группе тренированных лиц 20-30 лет средний диаметр капилляров был на 20% больше, а средняя величина микрососудистой перфузии на 19% меньше, чем в группе нетренированных испытуемых. После физической нагрузки в обеих группах произошло достоверное повышение числа функционирующих капилляров на 5-7%. Средний диаметр капилляров в группе тренированных лиц не изменился, а в группе нетренированных увеличился на 14%. Микрососудистая перфузия в группе тренированных лиц увеличилась на 86%, а у нетренированных испытуемых на 49%. В состоянии покоя у тренированных лиц старшей возрастной группы 50-60 лет средний диаметр капилляров был на 13%, а средняя величина микрососудистой перфузии на 24% больше, чем в группе нетренированных испытуемых. После физической нагрузки у испытуемых обеих групп наблюдали достоверное и сопоставимое увеличение числа функционирующих капилляров на 11-15%. Средний диаметр капилляров в группе тренированных лиц не изменился, а в группе нетренированных увеличился на 6%. Микрососудистая перфузия в группе тренированных лиц увеличилась на 65%, а у нетренированных испытуемых на 39%. Заключение: Найдено, что физическая нагрузка вызывала сходные по направленности изменения параметров микроциркуляции у лиц разного возраста. При этом более высокий аэробный потенциал организма (величина максимального потребления кислорода) сочетался с большим резервом адаптации микроциркуляции, выявленным при выполнении интенсивной мышечной работы. Возрастные различия проявлялись меньшим приростом микрососудистой перфузии в ответ на физическую нагрузку у лиц старших возрастных групп.
Ключевые слова: микроциркуляция, возраст, тренированность, перфузия, капилляры, максимальное потребление кислорода
Введение. Кровообращение на уровне обменных капилляров или микроциркуляция является важнейшим звеном в системе кровообращения, поскольку именно на этом уровне реализуется ее транспортная и обменная функции. Было показано, что локальный кровоток, зарегистрированный в коже, изменяется с возрастом и в значительной мере отражает общие закономерности ответных реакций микроциркуляторного русла в целом на физиологические стимулы (стресс, мышечные нагрузки, температурные градиенты) и может служить доступным объектом для изучения сосудистых адаптивных реакций организма [1, 2, 3]. В качестве инструментов таких исследований могут быть использованы лабораторные модели дозированных мышечных нагрузок, дополненные регистрацией параметров микрососудистого русла кожи с помощью современных компьютизированных методик [4, 5, 6, 7]. Важность таких исследований заключается в том, что согласно мнению ряда авторов, с возрастом происходят негативные изменения микроциркуляции даже при отсутствии патологий [8, 9, 10, 11]. Вместе с тем данные о характере и величине изменений микроциркуляции у лиц разного возраста и разной физической подготовленности, в литературе представлены недостаточно и требуют дальнейшего изучения.
Цель – исследование состояние микрососудистого русла и тканевой перфузии у тренированных и нетренированных лиц разного возраста.
Материал и методы исследования. В качестве объекта исследования была оценка микроциркуляции у лиц двух возрастных групп. Все испытуемые дали информированное согласие на участие в исследовании и оно было одобрено этическим комитетом университета. С учетом возраста и уровня тренированности, на основе анализа величин максимального потребления кислорода (МПК) были сформированы четыре группы наблюдений: 1А – нетренированные лица 20-30 лет; 1Б – тренированные лица 20-30 лет; 2А – нетренированные лица 50-60 лет и 2Б – тренированные лица 50-60 лет (табл. 1).
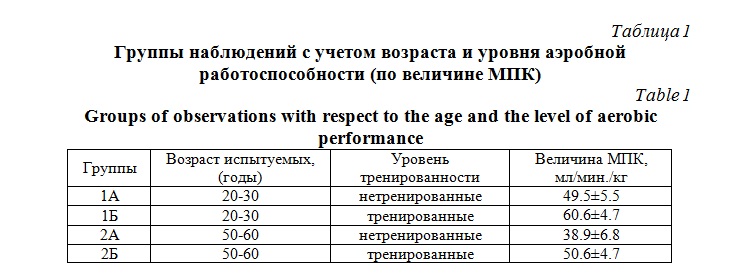
В группы тренированных лиц включали действующих спортсменов (спортсменов-ветеранов), специализирующихся в видах спорта с преимущественным проявлением выносливости. Все испытуемые, соответствующих подгрупп (1Б и 2Б) имели регулярные тренировочные и соревновательные нагрузки на момент обследования.
Испытуемые были обследованы по единой программе, включавшей определение показателей микроциркуляции (МЦ) в покое и после ступенчато возрастающей физической нагрузки на велоэргометре (Monark-928 E). Для определения ЧСС во время нагрузки использовали монитор сердечного ритма Polar RS100. Интенсивность нагрузки повышали с шагом 25 Вт в минуту до величины частоты сердечных сокращений (ЧСС) равной 87% от индивидуального возрастного максимума (ЧССм), который рассчитывали для каждого испытуемого по формуле: ЧССм = 217 - (0.85 х возраст). Данная величина нагрузки соответствует субмаксимальной зоне мощности [12]. МЦ исследовали с применением двух методов: биомикроскопия ногтевого ложа и лазерной доплеровской визуализации (ЛДВ, прибор EasyLDI, Швейцария). Установка для биомикроскопии представляет бинокулярный стереоскопический микроскоп МБС-9, в качестве осветителя использовали светодиод, что позволило исключить нагревание исследуемой области ногтевого ложа. Для визуализации фото и видео изображений на мониторе компьютера применяли цифровой окуляр DCM510. Фоторегистрацию проводили с разрешением 2560´1920 пикселей. При анализе изображений определяли число капилляров, приходящихся на площадь 1мм2, и измеряли диаметр переходной части капилляра.
Регистрирующим элементом установки EasyLDI является неинвазивная, бесконтактная камера, работающая в масштабе реального времени. Площадь обследуемой поверхности 7х7 см, фокусное расстояние 20 см, длина световой волны 808 нм. Лазерный пучок света проникает в кожу на глубину 2 мм, где отражается как находящимися в движении эритроцитами, так и неподвижными тканями. Пучок света лазера, взаимодействующий с эритроцитами, меняет частоту благодаря эффекту Доплера. Специальная высокоскоростная камера получает изображения со скоростью 20000 кадров в секунду, фиксируя спектр частот, после чего выполняет анализ данных путем расчета временных точек 0 и 1. В связи с этим изображения получаются сжатыми во времени, позволяя сделать до 40 кадров в секунду для оценки перфузии.
С помощью данного метода регистрировали перфузию кожи на середине предплечья. Измерения проводили до и после физической нагрузки. Метод LDI позволяет получить интегрированный индекс с большей поверхность кожи, чем LDF, тем самым, уменьшая влияние пространственной неоднородности микрососудов.
Статистическая обработка полученных результатов проводилась с использованием программы Statistica 6.0. Проверку выборочного распределения проводили с помощью теста Шапиро–Уилка. За уровень статистически значимых принимали изменения при p<0.05 и p<0.01.
Результаты и их обсуждение. Средние величины числа функционирующих капилляров (ЧФК) в состоянии покоя у лиц в группах 1А и 1Б достоверно не различалась (табл. 2). При этом средний диаметр капилляров в группе 1А был меньше на 20%, чем в 1Б (р<0.01). В состоянии покоя данные капилляроскопии согласуются с результатами, зарегистрированными методом ЛДВ. Средняя величина микрососудистой перфузии в покое была меньше на 19% (р<0.05) у тренированных лиц группы 1Б, чем в группе 1А (табл. 1). После физической нагрузки в обеих группах произошло достоверное повышение числа функционирующих капилляров. В группе 1А прирост составил 5% (р<0.05), а в группе 1Б 7% (р<0.05) (рис. 1). Средний диаметр капилляров в группе 1А увеличился на 14% (р<0.01), а в группе 1Б он существенно не изменился и оставался больше, чем у нетренированных (табл. 2).
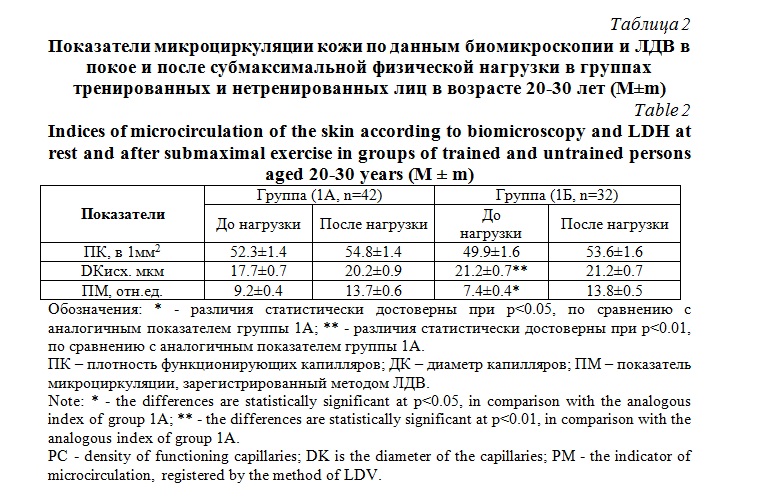
После физической нагрузки в обеих группах наблюдали прирост микрососудистой перфузии. Более выраженные изменения (на 86%) были зарегистрированы в группе 1Б. Тогда как, у лиц группы 1А микрососудистая перфузия возросла, под влиянием нагрузки только на 49% (рис. 2).
Средняя величина ЧФК у тренированных и нетренированных лиц в группе старшего возраста (50-60 лет) в состоянии покоя достоверно также не различалось (табл. 3.). Средний диаметр капилляров был на 13% больше в группе 2Б, чем в 2А (р<0.05). После физической нагрузки у испытуемых обеих групп наблюдали достоверное и сопоставимое увеличение ЧФК (рис. 1).
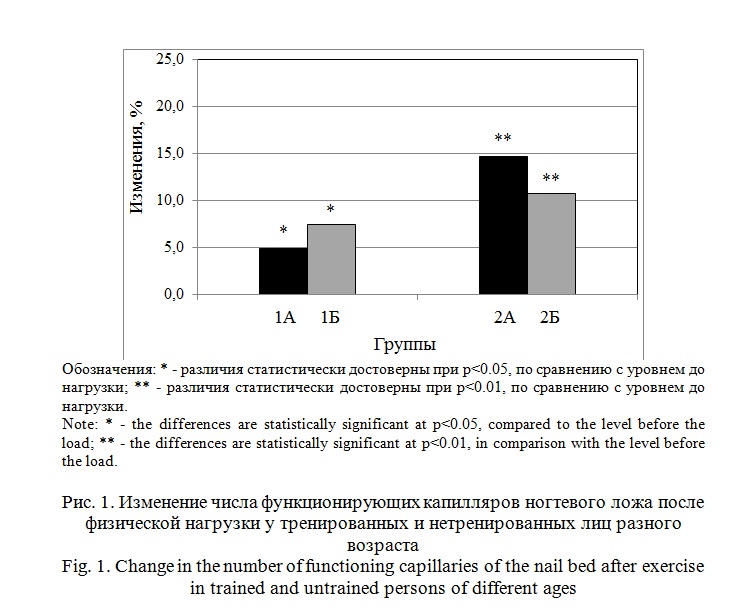
В группе 2А прирост составил 15% (р<0.01), а в группе 2Б 11% (р<0.01). У нетренированных лиц было зарегистрировано увеличение диаметра капилляров на 6% (р<0.05), у тренированных лиц он существенно не изменился (табл. 3). У тренированных лиц 50-60 лет микрососудистая перфузия на 24% превышала показатель группы 2А (р<0.05; табл. 3). Эта разница сохранилась и в условиях выполнения мышечной нагрузки (рис. 2). Под ее влиянием в обеих группах произошел достоверный прирост перфузии: у лиц группы 2Б на 65%, а в группе 2А только на 39% (табл. 3).
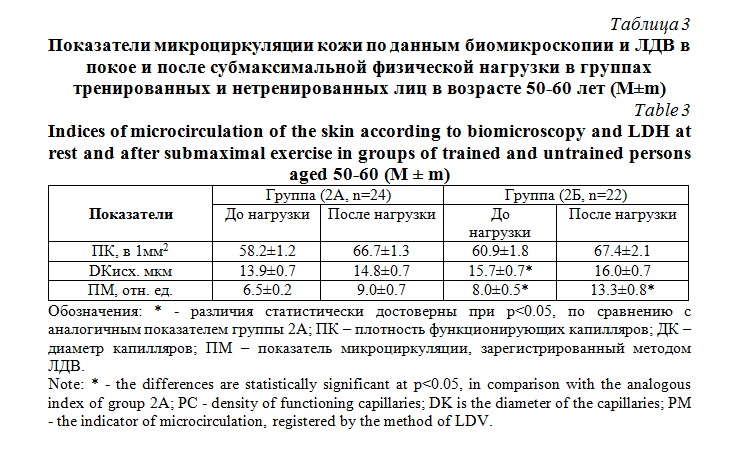
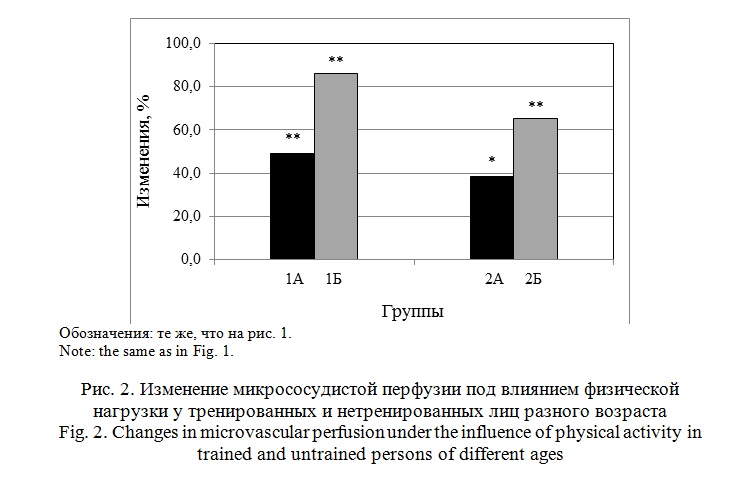
Субмаксимальная физическая нагрузка вызывала прирост микрососудистой перфузии во всех группах наблюдения. У лиц в группах 1А и 1Б он был значительно больше, чем в старших возрастных группах 2А и 2Б. Результаты наших исследований согласуются с литературными данными [13], где отмечено, что снижение кожного кровотока у здоровых лиц в возрасте 60 лет и старше может достигать 25-50% от величины, характерной для лиц 18-30 лет. Снижение резервных возможностей кожных сосудов с возрастом проявляется в ослаблении как констрикторных, так и дилататорных сосудистых ответов [8, 9, 10, 11]. В исследованиях О.В. Коркушко с соавторами [14] показано, что с возрастом в первую очередь снижается парасимпатическая сосудистая стимуляция и в меньшей степени – симпатическая. Подобные изменения регуляции сосудистых реакций регистрируются после 50 лет, и могут быть причиной ограничения адаптационных возможностей системы МЦ из-за снижения резервов дилатации микрососудов [11, 14].
Обратная корреляция между плотностью и диаметром капилляров (r=−0,61) может свидетельствовать о компенсации снижения числа функционирующих микрососудов приростом их диаметра. С другой стороны, возрастное уменьшение резерва дилатации капилляров может компенсироваться более значительным количеством капилляров, включенных в микроциркуляцию.
Данные полученные при нагрузочном тестировании указывают на то, что во всех возрастных группах позитивный прирост микрососудистой перфузии тканей, в ответ на субмаксимальную физическую нагрузку, был более выражен у лиц, имеющих регулярную физическую активность. Ряд авторов отмечает, что систематические физические нагрузки положительно сказываются на формировании резерва дилатации сосудов микроциркуляции [15, 16, 17]. Возможно одним из ведущих адаптивных сосудистых эффектов, при мышечной тренировке в любом возрасте является, повышение регуляторной роли газотрансмиттеров. Известно, что увеличение диаметра микрососудов при физической нагрузке, связано с рядом регуляторных механизмов и в первую очередь с действием такого газового медиатора как оксида азота (NO), который продуцируется эндотелиальными клетками в ответ на механический или гипоксический стимул и способствует релаксации гладкомышечных клеток артериол и их дилатации и приросту тканевой перфузии [18, 19]. Имеются данные, что систематические аэробные физические нагрузки заметно увеличивают эффективность NO- зависимой вазодилатации артериол и, следовательно, способствуют эффективной перфузии тканей [20, 21, 22].
Выводы
- Таким образом, физическая нагрузка вызывала сходные по направленности изменения параметров микроциркуляции у лиц разного возраста. При этом более высокий аэробный потенциал организма (величина максимального потребления кислорода) сочетался с большим резервом адаптации микроциркуляции, выявленным при выполнении интенсивной мышечной работы.
- собенности реакции системы микроциркуляции, зарегистрированные в группе молодых лиц с более высокой аэробной производительностью, сохранялись и в старшей группе тренированных испытуемых: резерв адаптации (прирост микроциркуляции) был почти в два раза больше, чем у физически неактивных лиц.
- озрастные различия проявлялись меньшим приростом микрососудистой перфузии в ответ на физическую нагрузку у лиц старших возрастных групп.
В отношении данной статьи не было зарегистрировано конфликта интересов.





















Список литературы