Вклад полиморфизма rs11927381 гена IGF2BP2 в патогенез сахарного диабета 2 типа
Aннотация
Актуальность: Дисфункция бета-клеток поджелудочной железы, наряду с инсулинорезистентностью периферических тканей, является ключевым звеном патогенеза сахарного диабета 2 типа. В этой связи значительный интерес представляет изучение роли полиморфизмов генов, непосредственно участвующих в работе бета-клеток островков Лангерганса, в формировании предрасположенности к заболеванию. Цель исследования: Изучить связь полиморфного варианта гена кодирующего белок 2 связывающий мРНК инсулиноподобного фактора роста 2, IGF2BP2, (Т>С, rs11927381) с риском развития СД2 у жителей Курской области. Материалы и методы: В исследование были включены 559 больных СД2 и 540 практически здоровых добровольцев. Генотипирование полиморфизма гена IGF2BP2 (Т>С, rs11927381) было выполнено с использованием технологии iPLEX на геномном времяпролетном масс-спектрометре MassArray Analyzer 4 (Agena Bioscience). Статистическую обработку полученных данных проводили с помощью онлайн программы SNPStats. Результаты: Частота встречаемостигенотипа С/С была значимо выше в группе больных СД2 по сравнению с группой контроля (OR 1,75; 95%CI 1,25-2,44; P=0,0026). Ассоциация сохранила значимость и после введения поправок на пол, возраст и индекс массы тела (OR 1,87; 95%CI 1,26-2,78; P=0,0054). Стратифицированный анализ по полу показал, что выявленная ассоциация была характерна только для мужчин (OR 2,27; 95%CI 1,17-4,40; P=0,041), в то время как у женщин ассоциация не наблюдалась (P>0,05). Генотипы С/Т и С/С были ассоциированы со снижением содержания общего холестерина и липопротеинов низкой плотности у больных СД2 (Р<0,05). Заключение: Установленная ассоциация указывает на вовлеченность гена IGF2BP2 в формирование предрасположенности к СД2. Изучаемый вариант rs11927381 также связан с более низким содержанием общего холестерина и липопротеинов низкой плотности у пациентов с СД2, что может быть следствием эффектов SNP на эпигенетическом уровне.
Ключевые слова: сахарный диабет 2 типа, однонуклеотидный полиморфизм, IGF2BP2, генетическая предрасположенность
Введение. Распространенность сахарного диабета стремительно растет во всем мире, и по данным Международной диабетической федерации, на сегодняшний день составляет более 425 млн человек [1]. На конец 2018 года в России насчитывалось 4,58 млн больных диабетом, 92,6% которых (4,24 млн человек) страдают сахарным диабетом 2 типа (СД2) [2]. За период с 2000 по 2018 гг число больных СД2 в нашей стране выросло более чем в 2 раза. Всероссийское эпидемиологическое исследование NATION выявило диабетическую гипергликемию у 5,4% участников исследования в возрасте 20-79 лет, что увеличивает общее число пациентов до 8 млн человек [3].
Заболевание представляет собой серьезную многофакторную патологию, в реализации фенотипа которой принимают участие генетические и средовые факторы. Полногеномные ассоциативные исследования, проведенные за последние 12 лет и включавшие более миллиона больных и трех миллионов здоровых лиц, выявили сотни однонуклеотидных вариантов, связанных с риском развития СД2 [4]. Значительная часть обнаруженных полиморфизмов локализована в некодирующих областях генома или межгенных пространствах, что осложняет интерпретацию полученных данных. Локусы, биологическую роль которых удалось установить, в большей степени влияют на бета-клетки поджелудочной железы, определяя их количество, массу, функциональную активность, чувствительность к уровню глюкозы в крови, а также выживаемость в условиях глюкозо- и липотоксичности. Гораздо меньшее количество вариантов ассоциировано с изменениями в сигнализации инсулина в периферических тканях, приводящих к инсулинорезистентности [5]. Помимо снижения чувствительности периферических тканей к инсулину и нарушения его продукции поджелудочной железой, существующая сегодня концепция патогенеза СД2 включает увеличение продукции глюкозы печенью, усиление секреции глюкагона островками Лангерганса, уменьшение синтеза гормонов желудочно-кишечного тракта инкретинов, повышение реабсорбции глюкозы почками, усиление всасывания глюкозы в кишечнике, а также повышение активности центров аппетита в гипоталамусе. Перечисленные восемь звеньев составляют так называемый «угрожающий октет» DeFronzo [6], любой компонент которого может способствовать развитию хронической гипергликемии и нарушению практически всех видов обмена.
Одним из генов, связь которого с СД2 была впервые установлена в полногеномных исследованиях, является ген IGF2BP2, кодирующий белок 2 связывающий мРНК инсулиноподобного фактора роста 2 [7]. Ассоциация полиморфного варианта rs11927381 с риском СД2 была выявлена на этнически гетерогенной популяции и ни разу не была реплицирована.
Цель исследования. Изучение связи полиморфизма гена IGF2BP2, (rs11927381, Т>С) с риском развития СД2 у жителей Курской области.
Материалы и методы исследования. Протокол исследования был одобрен Региональным этическим комитетом при КГМУ. В исследование вошли 559 больных СД2 (155 мужчин и 404 женщины) со средним возрастом 62,2±7,5 лет, находившихся на стационарном лечении в эндокринологическом отделении Курской городской клинической больницы скорой медицинской помощи с января по декабрь 2018 года. Диагноз СД2 устанавливали на основе критериев ВОЗ [8, 9]. Группу контроля составили 540 практически здоровых добровольцев (239 мужчин и 301 женщина) со средним возрастом 61,1±5,9 лет, доноров Областной станции переливания крови, как было описано нами ранее [10, 11]. У всех участников исследования на основе письменного информированного согласия проводили забор 5 мл венозной крови натощак в вакуумные пробирки Vacuette с ЭДТА в качестве антикоагулянта. Геномную ДНК выделяли с помощью биохимического набора QIAamp DNA BloodMiniKit (Qiagen) на автоматической станции для экстракции белков и нуклеиновых кислот QiaCube (Qiagen). Генотипирование полиморфизма гена IGF2BP2 (Т>С, rs11927381) было выполнено с использованием технологии iPLEX на геномном масс-спектрометре MassArrayAnalyzer 4 (AgenaBioscience). Для проведения биохимических исследований 5 мл крови натощак забирали в вакуумные пробирки с гепарином лития. Концентрации глюкозы, гликированного гемоглобина, триглицеридов, общего холестерина и его подфракций определяли наборами фирмы «Диакон-ДС» на полуавтоматическом биохимическом анализаторе Clima MC-15 (RAL).
Биоинформатический анализ проводили с применением инструментов STRING (https://string-db.org) для визуальной оценки белковых партнеров IGF2BP2; GeneOntology (http://geneontology.org) для поиска общих генных онтологий партнеров IGF2BP2; mQTLDatabase (http://www.mqtldb.org) иENCODE (https://www.encodeproject.org) для изучения влияния изучаемого SNPна статус метилирования гена и другие эпигенетические метки. Статистическую обработку полученных данных проводили с помощью онлайн программы SNPStats (https://www.snpstats.net/start.htm). Тестировали пять генетических моделей: кодоминантную, доминантную, рецессивную, сверхдоминантную и log-аддитивную. Ассоциация считалась значимой при Р<0,05. Для проверки нормальности распределения биохимических показателей использовали критерий Колмогорова-Смирнова. Переменные, имеющие нормальное распределение, были описаны с использованием среднего значения (Mean) и стандартного отклонения (St.Dv.) в виде Mean±St.Dv. В качестве теста статистической значимости использовали тест Стьюдента. Показатели с ненормальным распределением описывали с использованием медианы (Мedian), первого (Q1) и третьего (Q3) квартилей, в виде: Мedian [Q1; Q3]. В качестве теста статистической значимости в таких случаях применяли критерий Манна-Уитни. Обнаруженные отличия групп принимались за статистически значимые при p<0,05.
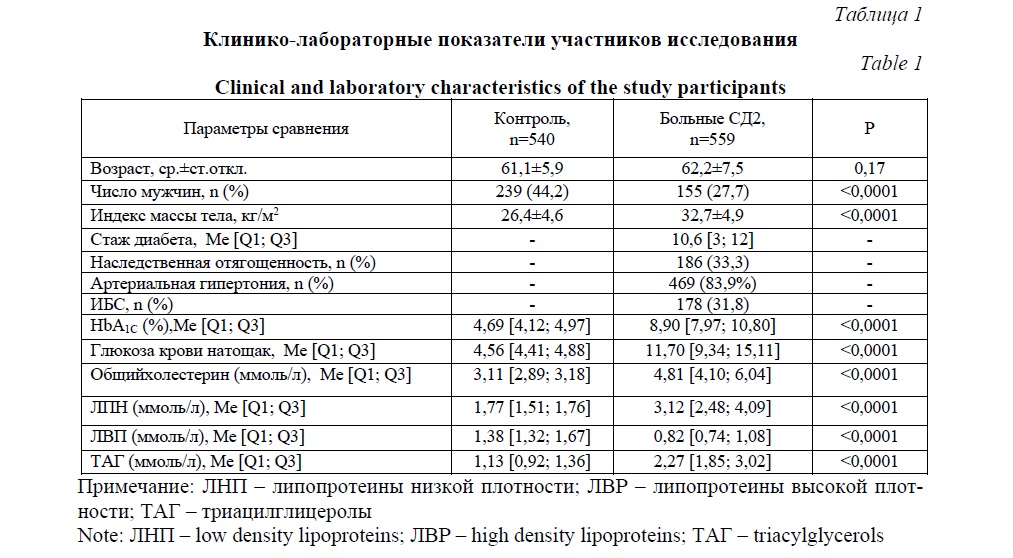
Результаты и их обсуждение. Демографические и лабораторные характеристики больных и здоровых приведены в таблице 1. Стаж диабета составил 10,6 лет. Наследственная отягощенность присутствовала у трети пациентов. Подавляющее большинство больных также страдали артериальной гипертонией, у 31,8% больных была установлена одна из форм ишемической болезни сердца. Анализ результатов биохимического исследования крови выявил классические для СД2 гипергликемию, повышение уровня гликированного гемоглобина, общего холестерина, липопротеинов низкой плотности, триацилглицеролов на фоне снижения содержания липопротеинов высокой плотности.
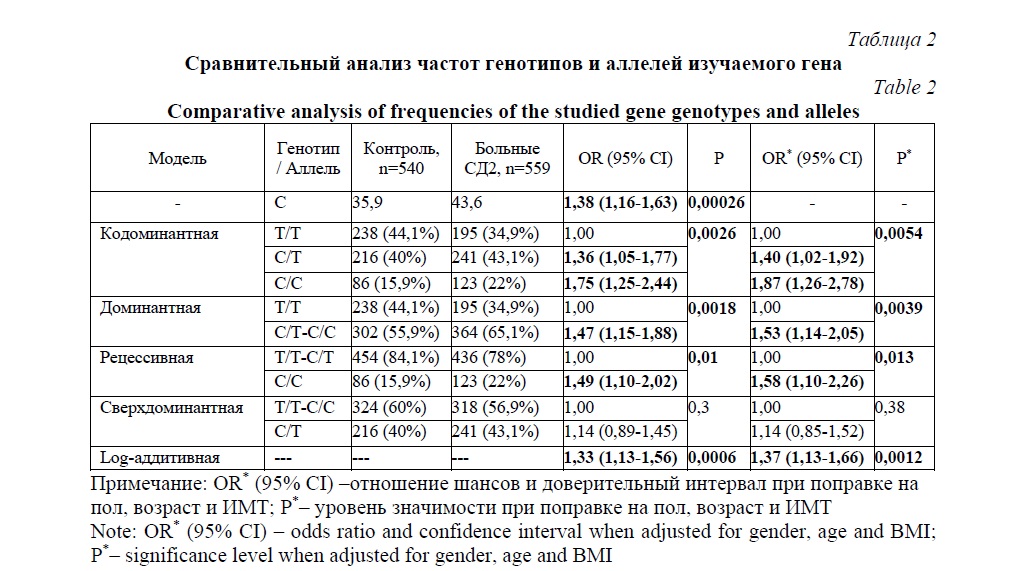
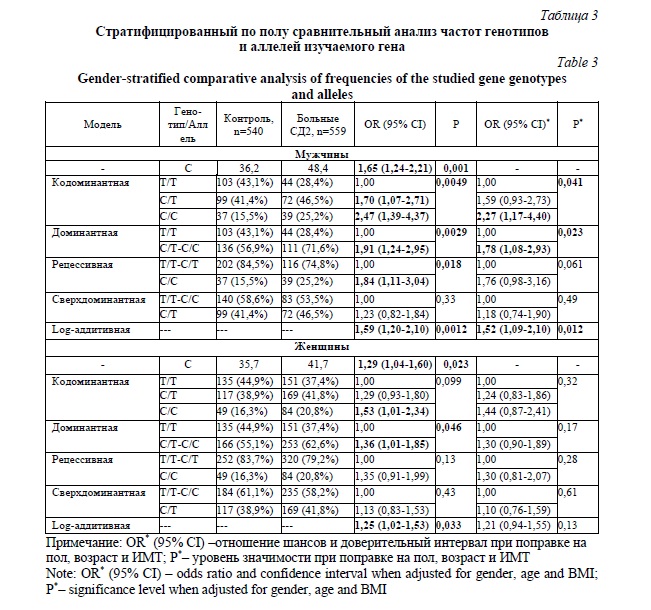
Частота встречаемости генотипа С/С была значимо выше в группе больных СД2 по сравнению с группой контроля (OR 1,75; 95%CI 1,25-2,44; P=0,0026, кодоминантная модель). Ассоциация сохранила значимость и после введения поправок на пол, возраст и индекс массы тела (OR 1,87; 95%CI 1,26-2,78; P=0,0054, кодоминантная модель). Стратифицированный анализ по полу (табл. 3) показал, что выявленная ассоциация была характерна только для мужчин (OR 2,27; 95%CI 1,17-4,40; P=0,041, кодоминантная модель), в то время как у женщин после введения поправок на возраст и индекс массы тела ассоциация не наблюдалась (P>0,05). Тем не менее, частота минорного аллеля С была значимо выше у пациентов с СД2 как в общей выборке, так и в подгруппах мужчин и женщин
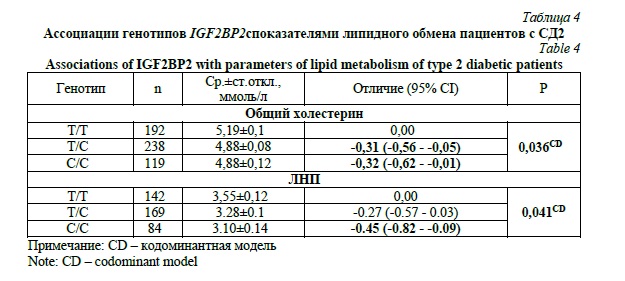
Мы также проанализировали связь всех количественных биохимических показателей, измеренных в плазме крови больных и здоровых, с генотипами IGF2BP2 (табл. 4). Как оказалось, генотипы С/Т и С/С ассоциированы со снижением содержания общего холестерина на 0,31 и 0,32 ммоль/л, соответственно (Р=0,036, кодоминантная модель). Кроме того, генотип С/С связан и со снижением уровня липопротеинов низкой плотности на 0,45 ммоль/л у больных СД2 (Р=0,041, кодоминантная модель). Значимых взаимосвязей IGF2BP2 с другими метаболическими показателями выявлено не было.
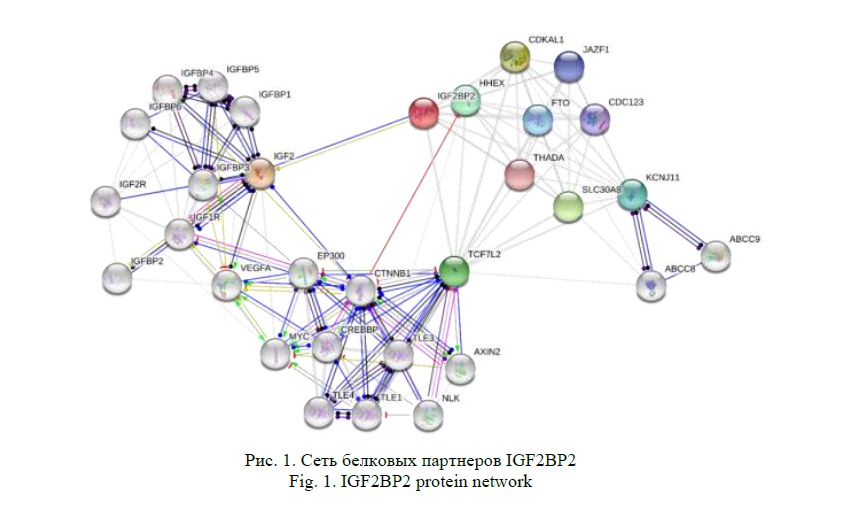
Инструмент STRING выявил функциональных партнеров IGF2BP2 (рис. 1): ими являются белки, принадлежащие к семейству инсулиноподобных факторов роста (IGF2, IGFBP1, IGFBP2, IGFBP3, IGFBP4, IGFBP5, IGFBP6, IGF1R, IGF2R), белки Wnt-сигнального пути (TCF7L2, EP300, CTNNB1, MYC, CREBBP, TLE1, TLE3, TLE4, NLK, AXIN2), а также белки, регулирующие глюкозостимулированную секрецию инсулина (HHEX, CDKAL1, JAZF1, FTO, THADA, CDC123, SLC30A8, KCNJ11, ABCC8, ABCC9). Таким образом, IGF2BP2, совместно с другими белками сети, участвует в процессинге проинсулина, регуляции синтеза рецепторов кинкретинам, активации пролиферации бета-клеток и подавлении их апоптоза [12-14].
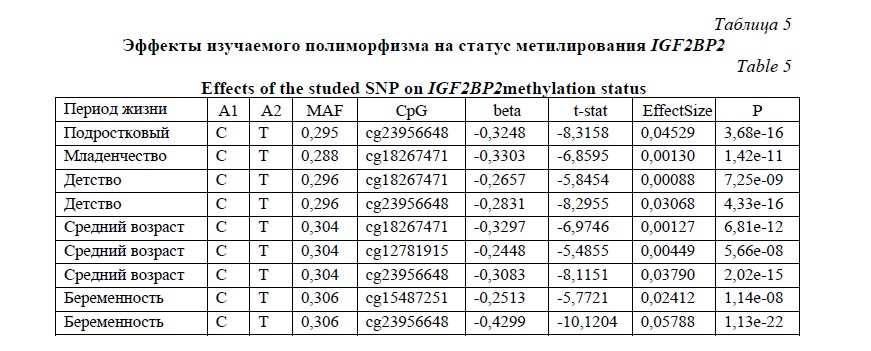
Согласно экспериментальным данным по оценке эффектов однонуклеотидных вариантов ДНК на статус метилирования генов mQTL, аллель Сrs11927381 связан с гипометилированием IGF2BP2 (табл. 5), а, следовательно, с увеличением экспрессии этого гена в различные периоды жизни. Действительно, Marselliи соавторы [15] показали повышенную концентрацию мРНК IGF2BP2 в бета-клетках островкового аппарата пациентов с СД2 по сравнению с группой контроля. Увеличение экспрессии IGF2BP2 может способствовать увеличению образования IGF2 и недостатку митохондриального белка-разобщителя UCP1, что влечет за собой развитие ожирения, инсулинорезистентности и нарушения секреции инсулина [16-18].
Биоинформатический инструмент ENCODE позволил определить, что вариантный аллель С входит в состав цис-регуляторного элемента с участком гиперчувствительности к ДНК-азе (Z>1,64). Изучаемый SNP также ассоциирован с модификацией гистона Н3, а именно, cацетилированием остатка лизина 27 (Zдля H3K27>1,64), что согласно экспериментальным данным, сопряжено с повышением экспрессии [19]. Открытый хроматин в данном регуляторном элементе создает участки связывания для пяти транскрипционных факторов: USF1, USF2, FCAG-NFYCи RAD51. Анализ обогащения генных онтологий Gene Ontology обнаружил, что перечисленные транскрипционные факторы обеспечивают глюкозо-индуцированную активацию транскрипции (P=2,72*10-7, FDR=4,3*10-3) гена IGF2BP2. Кроме того, в ряде работ было показано, что транскрипционный фактор USF1 обладает мощным регуляторным потенциалом в отношении генов липидного обмена и вовлечен в патогенез семейной комбинированной гиперлипидемии [20, 21]. Таким образом, обнаруженная в нашем исследовании взаимосвязь генотипов IGF2BP2 cуровнями общего холестерина и липопротеинов низкой плотности может отражать эффект не самого гена, а являться следствием транскрипционного контроля метаболизма глюкозы и липидов со стороны ассоциированных с изучаемым SNP белковых факторов, в частности, USF1.
Выводы. Проведенное нами исследование выявило ассоциацию варианта rs11927381 гена IGF2BP2c повышенным риском развития СД2. Мы также установили взаимосвязь изучаемого полиморфизма с уровнем общего холестерина и липопротеинов низкой плотности и предложили биоинформатическое обоснование этого факта с позиций эффектов SNP на эпигенетические модификации гистонов и открытость хроматина, регулирующие экспрессию IGF2BP2 и осуществляющие сложный транскрипционный контроль метаболизма.
В отношении данной статьи не было зарегистрировано конфликта интересов





















Список литературы