Изучение ассоциации полиморфных локусов генов фолатного цикла с развитием синдрома задержки роста плода 2-3 степени
Aннотация
Актуальность: Ферменты фолатного цикла регулируют ключевые реакции в фолат-опосредованном одноуглеродном метаболизме. Нарушения фолатного цикла могут быть связаны с возникновением плацентарной недостаточности с синдромом задержки роста плода (СЗРП) у беременных, однако на сегодняшний день связь полиморфизма генов фолатного цикла с развитием патологии течения беременности изучена недостаточно. Цель исследования: Изучение ассоциации полиморфных локусов генов фолатного цикла с развитием СЗРП 2-3 степени. Материалы и методы: Выборку для исследования составили 112 беременных с СЗРП 2-3 степени и 243 беременных с нормальным весом новорожденного. Изучались полиморфные локусы генов фолатного цикла rs1805087 гена MTR, rs1801394 гена MTRR, rs1979277 гена SHMT1, rs699517 гена TYMS, rs2790 гена TYMS. Исследование проводили методом ПЦР с использованием соответствующих олигонуклеотидных праймеров и зондов с последующим анализом полиморфизмов методом детекции TaqMan зондов (real-time ПЦР). Анализ ассоциаций проводился с использованием программного обеспечения gPLINK v2.050. Межгенные взаимодействия в двух- и трехлокусных моделях анализировали с помощью метода MDR и его модификации GMDR. Результаты: Показано, что аллель Т rs1979277 гена SHMT1 ассоциирован с развитием СЗРП 2-3 степени в рамках аддитивной (OR=1,56, 95%Сl 1,10-2,22, р=0,012, рperm=0,011) и рецессивной (OR=2,55, 95%Сl 1,24-5,22, р=0,011, рperm=0,007) моделей. Выявлена ассоциация аллеля G rs1805087 гена MTR с формированием СЗРП 2-3 степени в соответствии с рецессивной моделью (OR=3,28, 95%Сl 1,14-9,47, р=0,028, рperm=0,014). Выявлены две 2-х локусных и одна трехлокусная модели SNP х SNP взаимодействий, ассоциированных с развитием СЗРП 2-3 степени. В состав значимых моделей входят три полиморфных локуса - rs1979277 SHMT1, rs1805087 MTR и rs1801394 MTRR. Парное взаимодействие rs1801394 MTRR х rs1979277 SHMT1 является основой двух наиболее значимых моделей ген-генных взаимодействий, ассоциированных с развитием СЗРП 2-3 степени. Заключение: Полиморфные локусы rs1979277 SHMT1, rs1805087 MTR и rs1801394 MTRR ассоциированы с развитием СЗРП 2-3 степени.
Ключевые слова: полиморфизм, ассоциации, SNPхSNP взаимодействия, плацентарная недостаточность, синдром задержки роста плода, беременность, фолатный цикл
Введение. Задержка роста плода (ЗРП) – это не самостоятельное нозологическое заболевание, а синдром, возникающий вследствие развития различных патологических процессов, которые по тем или иным причинам развиваются в системе мать-плацента-плод. Одной из причин синдрома ЗРП (СЗРП) может быть плацентарная недостаточность (ПН). Следствием данного осложнения беременности, является рождение ребенка со сниженными массо-ростовыми показателями (менее 10-го перцентиля) [1, 2]. Абсолютное или относительное уменьшение плацентарной массы влияет на количество питательных веществ, которые получает плод, на характер газообмена, на эндокринную и метаболическую функцию плаценты, все это способствует формированию СЗРП [2-4]. Так как, эта патология имеет большой удельный вес в структуре перинатальных потерь и неонатальных заболеваний, а также ведет к неблагоприятным медико-биологическим и социальным прогнозам, изучение факторов, влияющих на развитие ПН и СЗРП имеет большое значение.
Известно, что частота перинатальной смертности при СЗРП выше в 7-10 раз по сравнению с нормально протекающей беременностью. За последние десятилетия частота плацентарной дисфункции (ПД), задержки развития плода и плацентарной недостаточности (ПН) не только не имеет тенденции к снижению, но и растет во всех странах мира [3, 4]. Кроме этого, практически у 50% детей, которые родились с признаками СЗРП, в дальнейшем выявляют острые и хронические заболевания [5, 6]. Приведенные негативные обстоятельства свидетельствуют о важности своевременного выявления СЗРП еще на этапе пренатального наблюдения, оптимизации условий развития плода, планирования и ведения родов, обеспечения рационального ухода в послеродовом периоде.
С акушерской точки зрения, ПД – это гестационное осложнение многофакторной этиологии, имеет тяжелые последствия для организма матери, плода и может быть, как причиной, так и реализацией осложненного течения беременности и соматической патологии [6]. Патогенез ПН заключается в нарушении децидуальной перфузии, ферментативной недостаточности децидуальной ткани [2, 4]. Происходят структурно-функциональные изменения плаценты, усиление вариабельности ядер симпластотрофобластов, уменьшение количества мелких ворсинок хориона, снижение интенсивности васкуляризации, инволютивных изменений, процессов имплантации, плацентации, плацентарной гемоциркуляции, циркуляторных поражений плаценты и т.д. Реакции сосудов терминальных ворсинок имеют компенсаторные резервы, при их истощении отсутствуют возможности развития дополнительной сосудистой сетки, все это является началом инволютивно-дистрофических изменений с формированием ПН и задержки роста плода, антенатальной потери плода, преждевременной отслойкой нормально и низко расположенной плаценты [2, 4, 6].
Одной из причин ПН и СЗРП являются изменения фолатного цикла, обусловленные разнообразными факторами риска. К внешне средовым факторам риска можно отнести: низкое употребление микроэлементов, витаминов, вредные привычки (курение, алкоголь) и др. [7, 8]. Большое значение имеют определенные особенности генома, полиморфизмы генов, участвующих в метаболизме фолиевой кислоты. Нарушение обмена фолиевой кислоты, может вызывать целую группу причин, осложняющих течение беременности, в том числе приводящих к СЗРП [7, 8, 9].
Известно, что фолиевая кислота участвует в формировании сосудистого русла. Нарушение ангиогенеза может вызывать плацентарную дисфункцию, что ассоциировано с патогенезом фетоплацентарной недостаточности и СЗРП и может приводить к антенатальной гибели плода [10, 11].
Метаболизм фолиевой кислоты осуществляется с помощью сложного каскадного процесса, сопровождающегося генетически детерминированными ферментативными реакциями. Понимание роли полиморфизма генов-кандидатов, вовлеченных в процесс формирования задержки внутриутробного развития плода, имеет важное значение для разработки эффективных методов диагностики и профилактики этого осложнения беременности.
Цель исследования. Изучение ассоциации полиморфных локусов генов фолатного цикла с развитием синдрома задержки роста плода 2-3 степени.
Материалы и методы исследования. Под наблюдением находилось 355 беременных женщин в третьем триместре беременности, у которых были собраны анамнестические данные, исследовались общеклинические и биохимические показатели. Выборку для исследования составили 112 беременных с СЗРП 2-3 степени и 243 беременных с нормальным весом новорожденного. Группы были репрезантивны по возрасту, росту и акушерскому анамнезу.
Материалом для исследования послужили образцы ДНК, выделенной из цельной венозной крови. Изучались следующие полиморфные локусы генов фолатного цикла rs1805087 гена MTR, rs1801394 гена MTRR, rs1979277 гена SHMT1, rs699517 гена TYMS, rs2790 гена TYMS. Исследование проводили методом ПЦР с использованием соответствующих олигонуклеотидных праймеров и зондов с последующим анализом полиморфизмов методом детекции TaqMan зондов (real-time ПЦР).
Статистические расчеты осуществлялись с использованием программного обеспечения gPLINK v2.050 (http://zzz.bwh.harvard.edu/plink/). Для коррекции множественных сравнений использовали пермутационный тест. Для исследования ген-генных взаимодействий использовался метод снижения размерности MDR (Multifactor Dimensionality Reduction) в модификации Model-Based-MDR (MB-MDR) (Calle M.L. et al., 2010).
Результаты и их обсуждение. По всем изученным SNPs как в группе беременных с СЗРП 2-3 степени, так и в группе контроля частоты минорных аллелей (MAF) были выше 5%. Анализ наблюдаемого распределения генотипов не выявил отклонения от ожидаемого распределения в соответствии с равновесием Харди-Вайнберга (HWE) по всем рассматриваемых локусам как среди беременных с СЗРП 2-3 степени (табл. 1), так и в контрольной группе (табл. 2).
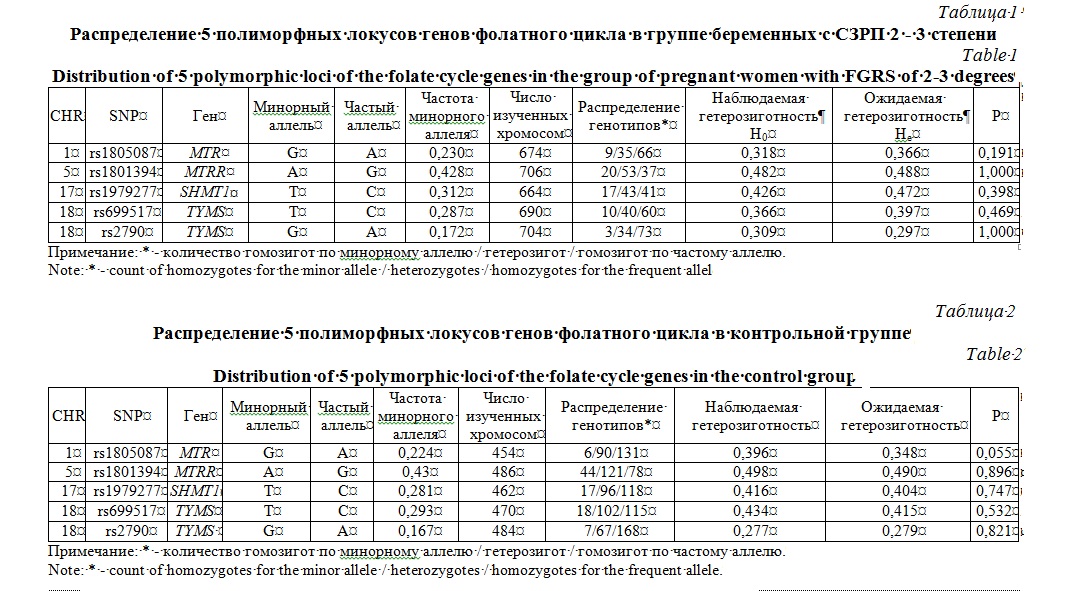
Анализ ассоциации аллелей полиморфных локусов генов фолатного цикла с развитием СЗРП 2-3 ст. (табл. 3) показал что аллель Т rs1979277 гена SHMT1 достоверно связан с развитием СЗРП 2-3 степени (OR=1,57, 95%Сl 1,11-2,23, р=0,011, рperm=0,012, Nperm=1596).
Установлено, что аллель Т rs1979277 гена SHMT1 ассоциирован с развитием СЗРП 2-3 степени в рамках аддитивной (OR=1,56, 95%Сl 1,10-2,22, р=0,012, рperm=0,011, Nperm=1792) и рецессивной (OR=2,55, 95%Сl 1,24-5,22, р=0,011, рperm=0,007, Nperm=2961) моделей (табл. 4). Также выявлена ассоциация аллеля G rs1805087 гена MTR с формированием СЗРП 2-3 степени в соответствии с рецессивной моделью (OR=3,28, 95%Сl 1,14-9,47, р=0,028, рperm=0,014, Nperm=1364).

При анализе ассоциаций гаплотипов полиморфных локусов rs699517 и rs2790 гена TYMS с развитием СЗРП 2-3 степени у беременных достоверных данных не выявлено (табл. 5).

С использованием метода MB-MDR выявлено 3 значимые модели SNP×SNP взаимодействий генов фолатного цикла, ассоциированных с развитием СЗРП 2-3 степени: 2 модели двухлокусного взаимодействия, 1 – трехлокусного (рperm≤0,05) (табл. 6).

Проведенный анализ показал, что в состав 3 наиболее значимых моделей межгенных взаимодействий, ассоциированных с развитием СЗРП 2-3 степени, входят 3 полиморфных локуса из 5 рассматриваемых SNPs: rs1805087 MTR, rs1801394 MTRR и rs1979277 SHMT1. Следует отметить, что каждый из этих трех «значимых» SNPs входит, как правило, в состав двух моделей. При этом, полиморфный локус rs1805087 MTR участвует в формировании наиболее значимых моделей ген-генных взаимодействий всех уровней (2-х и 3-х локусных). Также, парное SNP×SNP взаимодействие rs1805087 MTR х rs1979277 SHMT1 является основой двух наиболее значимых моделей межгенных взаимодействий – одной 2-х локусной и одной 3-х локусной моделей. Ассоциации отдельных комбинаций генотипов с развитием СЗРП 2-3 степени в рамках 3 наиболее значимых моделей SNP×SNP взаимодействий представлены в таблице 7.

Наиболее значимую ассоциацию с СЗРП 2-3 степени имеет двухлокусная комбинация генотипов AG rs1801394 MTRR х GG rs1805087 MTR (beta =0,47, p=0,002).
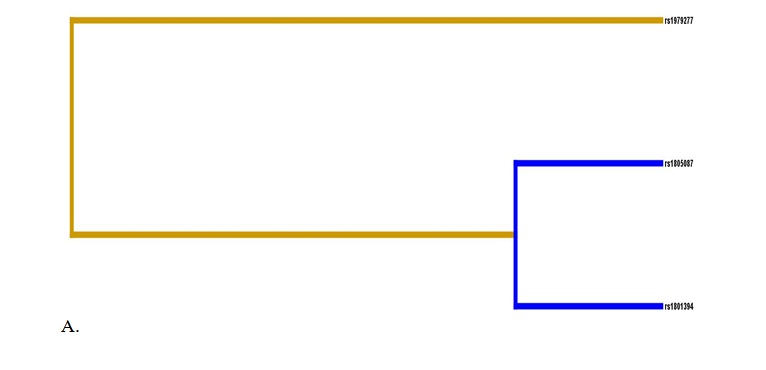
С помощью метода MDR выполнен анализ межгенных взаимодействий трех SNPs rs1801394 MTRR х rs1805087 MTR х rs1979277 SHMT1, связанных с развитием СЗРП 2-3 степени. Полученные результаты представлены на рисунке 1 ввиде дендрограммы (А) и графа (Б). Следует отметить, что наибольший вклад в формирование СЗРП 2-3 стадии вносят полиморфные локусы rs1979277 SHMT1 (1,19% энтропии), rs1805087 MTR (1,19% энтропии) и парное межгенное взаимодействие rs1801394 MTRR х rs1805087 MTR (-0,40% энтропии).

Таким образом, проведенное исследование установило ассоциации трех из пяти изученных полиморфных локусов генов фолатного цикла с развитием СЗРП 2-3 степени: rs1805087 гена MTR, rs1979277 гена SHMT1 и rs1801394 гена MTRR.
Полученные результаты согласуются с литературными данными о медико-биологических эффектах исследуемых генов в организме человека. Нормальное развитие плода требует адекватного уровня фолиевой кислоты во время беременности. Фолат способствует делению и росту клеток, а метаболизм фолата участвует в большом количестве физиологических и патофизиологических процессов в развитии человека [8, 10]. Поэтому полиморфизм генов, ответственных за обмен фолиевой кислоты, может негативно сказываться на росте и делении клеток плода и плаценты.
При сочетании неполноценных функционально ослабленных аллелей на фоне действия неблагоприятных (провоцирующих) факторов внешней среды такие полиморфизмы могут играть важную роль в патологии беременности и нарушении эмбрионального развития [9, 10, 12].
Метаболические ферменты фолатного цикла играют важную роль в поддержании нормального развития плода. Так, серин-гидроксиметилтрансфераза (SHMT1), пиридоксаль-фосфат-зависимый фермент, катализирующий взаимопревращение серина и глицина, обеспечивает фолат-зависимый одноуглеродный метаболизм, необходимый для синтеза пуринов и тимидилата, а также для превращения гомоцистеина в метионин. Метионин впоследствии аденилируется в S-аденозилметионин (SAM), кофактор, который метилирует ДНК, РНК, белки и многие метаболиты [9, 10]. Авторы указывают, что митохондриальные SHMT-производные одноуглеродные единицы необходимы для опосредованного фолатом одноуглеродного метаболизма в цитоплазме [11, 12]. Связь полиморфизма гена SHMT1 с нарушением течения беременности и развитием плода показана в работе Katalin Fekete с соавторами [13]. Также проводились работы по изучению ассоциаций серин-гидроксиметилтрансферазы (SHMT1) с развитием острого лимфобластного лейкоза, склероза, дефекта нервной трубки [14-17].
Метионинсинтаза (METH, то есть MTR) является ключевым ферментом в пути фолата, который играет критическую роль в синтезе, репарации и метилировании ДНК. Метионинсинтаза является В12-зависимым ферментом, и недостаток витамина В12 может нарушить метилирование гомоцистеина и привести к его накоплению. Деметилирование метионина в процессе метаболизма приводит к образованию гомоцистеина, а для его метилирования требуется фолат и кобаламин. Низкие концентрации фолиевой кислоты связаны с сосудистыми осложнениями беременности. Предыдущие экспериментальные и теоретические исследования показали, что кофакторы фолата ограничивают цитоплазматические фолатзависимые реакции [17, 18].
В ряде работ показана связь метионинсинтазаредуктазы (MTR) с внутриутробной задержкой роста плода [12, 13, 19]. Предыдущие in vitro исследования выявили, что этот фермент регулирует распределение метилентетрагидрофолата между путями метаболизма тимидилата и гомоцистеина. [12]. Sung Hwan Cho с соавторами выявили ассоциации генетических полиморфизмов метионинсинтазы (MTRR) и метионинсинтазаредуктазы (MTR) с рецидивирующим нарушением имплантации плода [21]. Имеются работы, демонстрирующие ассоциации полиморфизма генов MTRR и MTR с инициацией онкогенеза и опухолевой прогрессии, с риском развития сердечно-сосудистой патологии [22-27].
Заключение. В результате проведенного исследования установлена ассоциация полиморфных локусов генов фолатного цикла rs1979277 SHMT1, rs1805087 MTR и rs1801394 MTRR с развитием синдрома задержки роста плода 2-3 степени. Аллели Т rs1979277 гена SHMT1 и G rs1805087 гена MTR являются факторами риска развития данного осложнения беременности (OR=1,56 - 2,55 и OR=3,28 соответственно). Установлены три модели SNPхSNP взаимодействий генов фолатного цикла, ассоциированных с СЗРП 2-3 степени (р<0,05). В состав значимых моделей входят три полиморфных локуса rs1979277 SHMT1, rs1805087 MTR и rs1801394 MTRR. Парное взаимодействие rs1801394 MTRR х rs1979277 SHMT1 является основой двух наиболее значимых моделей ген-генных взаимодействий, ассоциированных с развитием СЗРП 2-3 степени.
В отношении данной статьи не было зарегистрировано конфликта интересов.





















Список литературы