Полиморфизм гена ZNF804A rs1344706 и клиническая гетерогенность шизофрении
Aннотация
Актуальность: Важным аспектом поиска генов риска шизофрении является подтверждение полученных ассоциаций, выявленных в результате полногеномного анализа (GWAS), в выборках из отдельных популяций, а также установление их специфичности для этого заболевания. Цель исследования: Изучить связь между вариантом риска ZNF804A rs1344706 и шизофренией с учетом типа ее течения и шизаффективным расстройством (ШАР), а также некоторыми клиническими особенностями этих заболеваний, прогностически важными для оценки их тяжести. Материалы и методы: Выборка больных состояла из 1458 человек, из них 1284 с диагнозом шизофрения и 174 с диагнозом ШАР Контрольная группа психически здоровых испытуемых включала в себя 1051человека. Для оценки тяжести заболевания использовали возраст начала болезни и общий балл по широко используемой при изучении шизофрении шкале PANSS. Генотипирование полиморфизма ZNF804A rs1344706 проводили с помощью метода полиморфизма длин рестрикционных фрагментов. Результаты: Обнаружено повышение частоты генотипа риска АА в группе больных шизофренией по сравнению с контрольной группой (р=0,03. ОШ 1,31, ДИ 95% 1,03-1,7). Анализ связи полиморфизма ZNF804A rs1344706 с клиническими характеристиками выявил значимый эффект генотипа (р=0,007) на суммарный балл PANSS в общей группе больных. Наибольшая выраженность симптомов отмечена в группе носителей генотипа риска АА, а наименьшая – у носителей генотипа СС. Влияния генотипа на возраст начала заболевания не обнаружено. Заключение: Полученные результаты подтверждают известные данные, о том, что полиморфизм ZNF804A rs1344706 ассоциирован с заболеванием и его тяжестью, а вариантом риска является генотип АА.
Введение. Шизофрения представляет собой заболевание, в этиологии которого важную роль играют генетические и средовые факторы. Патогенетические механизмы его до сих пор не выяснены. На современном этапе исследования биологических основ шизофрении большое внимание уделяется поиску генов, связанных с заболеванием, при этом в качестве основного инструмента поиска рассматривается широкомасштабное исследование генома (GWAS от англ. genome-wide association study), позволяющее с высокой достоверностью выявить варианты риска. Исследование проводят, используя биочипы, с помощью которых можно генотипировать сотни тысяч полиморфных участков, по типу случай-контроль на больших выборках, состоящих из десятков тысяч человек. Такие большие выборки, как правило, составлены из отдельных групп, сформированных на базе различных популяций. Анализ ассоциаций проводят в общей выборке, при этом в отдельных группах связи между полиморфным участком и заболеванием может быть и не обнаружено. Поэтому важной задачей является подтверждение выявленной на основе GWAS ассоциации в конкретной популяции. Очевидно, что такого рода исследования нужно проводить на достаточно больших выборках для обеспечения большой мощности исследования. Кроме того, важно исследовать связь выявленных с помощью GWAS вариантов с другими психотическими расстройствами, имеющими генетическую общность с шизофренией (шизоаффективное расстройство и биполярное аффективное расстройство (БАР)), а также клиническими особенностями заболевания. В настоящее время такие попытки предпринимаются в популяциях из разных стран [1, 2].
Одним из наиболее изучаемых в этом аспекте является ген цинк пальцевого белка (ZNF804A от англ. zinc finger protein 804A), который входит в число наиболее изучаемых генов, ассоциированных с шизофренией по данным GWAS [3]. Этот ген кодирует широко представленный в головном мозге человека транскрипционный фактор, принимающий участие в процессах нейронального развития, дифференциации и пролиферации глиальных клеток [4]. ZNF804A расположен на хромосомном участке 2q32.1 и содержит 4 экзона и 3 интрона. По данным GWAS с шизофренией ассоциирован полиморфизм rs1344706, обусловленный заменой аденина на цитозин (А\С) в интроне 2, при этом с риском шизофрении связан аллель А [5]. Следует отметить, что пока не существует единого мнения о функциональной значимости аллеля А [6]. Данные об его влиянии на экспрессию мРНК или соответствующего белка достаточно фрагментарны. Была обнаружена связь rs1344706 с экспрессией ZNF804A в лимфобластоидных клетках, но локусов, регулирующих уровни экспрессии мРНК или белка (eQTL) не выявлено. По мнению [7], аллель A представляет собой индексный аллель в составе гаплотипа ZNF804A, который влияет на уровень экспрессии белка, при этом регуляция экспрессии имеет место на ранних стадиях развития головного мозга и носит временной характер, что подтверждает исследование этих авторов, показавшее снижение уровня экспрессии ZNF804A в эмбриональном мозге во 2-ом триместре беременности. В исследовании [8] обнаружено, что локус rs1344706 влияет на экспрессию мРНК одного из транскриптов ZNF804A в мозге эмбриона, которая различалась в образцах аутопсийного мозга больных шизофренией и аффективными расстройствами.
К настоящему времени проведено около трех десятков исследований в европейских и азиатских популяциях для подтверждения ассоциации между полиморфизмом rs1344706 и шизофренией, результаты которых обобщены в мета-анализах [9-11]. Однако следует отметить, что только в нескольких из известных работ размеры выборок больных превышали 1000 человек [12, 13], т.е. могли считаться в достаточной степени репрезентативными. В ряде работ изучали связь полиморфизма ZNF804A rs1344706 с заболеваниями, которые имеют общую генетическую основу с шизофренией, в частности, аутизмом [14] и БАР [15-17], синдромом дефицита внимания с гиперактивностью [18]. Интерес представляет и изучение влияния этого полиморфизма на тяжесть течения (выраженность симптомов, когнитивный дефицит) и исходы психических заболеваний [19-21]. Однако, следует отметить, что в указанных выше работах не учитывался такой фактор, как значительная клиническая гетерогенность болезни. Как правило, при характеристике больных не отмечены ее форма и тип течения. Кроме того, во многих случаях имеет место объединение шизофрении и шизоаффективного расстройства, хотя они относятся к разным нозологическим рубрикам в международной классификации болезней.
Цель исследования. В настоящей работе мы впервые провели сравнительное исследование полиморфизма ZNF804A rs1344706 в группах с различными типами течения шизофрении, а также в группе ШАР. В качестве нулевой гипотезы мы предположили, что частота генотипа риска АА должна быть выше в группах больных шизофренией, независимо от типа течения и нозологической принадлежности (шизофрения или ШАР). Также было оценено влияние полиморфизма ZNF804A rs1344706 на некоторые клинические характеристики в выделенных подгруппах, важные для прогностической оценки тяжести болезни. Соответственно мы предположили, что тяжесть заболевания будет выше у носителей генотипа АА по сравнению с носителями генотипа СС.
Материалы и методы исследования. В исследовании приняли участие больные шизофренией и ШАР и контрольная группа психически здоровых испытуемых. Выборка больных состояла из 1458 человек (820 женщин и 638 мужчин, средний возраст 34,1±13,0 лет, возраст к началу заболевания 25,8±10,0 лет), из них 1284 с диагнозом шизофрения (рубрика F20 по МКБ-10) и 174 с диагнозом ШАР (F25, МКБ-10). Больные шизофренией были разделены на подгруппы по типу течения болезни: непрерывный или приступообразный. В подгруппы включали только тех больных, для которых тип течения был четко установлен, соответственно, в них не вошли пациенты с первым психотическим эпизодом F20.09), с неуточненной формой шизофрении (F20.8), а также больные, для которых лечащий врач определял тип течения как «приступообразный, ближе к непрерывному». В результате было отобрано 246 больных с непрерывным типом течения и 766 с приступообразным течением. Группа психически здоровых людей включала в себя 1051 человека (494 женщин и 557 мужчин, средний возраст 30,9±12,5 лет) без наследственной отягощенности по психическим заболеваниям. Все участвующие в исследовании были этнически русскими. Исследование было одобрено Этическим комитетом ФГБНУ НЦПЗ. Все его участники дали информированное согласие на сдачу биологического материала. Для оценки тяжести заболевания были выбраны два показателя – возраст начала болезни и общий (суммарный) балл по широко используемой при изучении шизофрении шкале PANSS (The Positive and Negative Syndrome Scale), с помощью которой можно оценить выраженность 30 симптомов, условно подразделенных на три подгруппы (позитивные, негативные и общие психопатологические). Каждый симптом оценивается в баллах от 1 до 7. В настоящей работе использовали общий балл, включающий в себя сумму баллов по всем подшкалам PANSS. Этот показатель адекватно отражает тяжесть болезни [22]. Легкая степень соответствует 58 баллам, умеренная – 75, выраженная – 95, резко выраженная – 116. Информация о возрасте к началу заболевания была доступна для 1322 человек (768 женщин и 554 мужчин), оценка симптомов с помощью PANSS была выполнена для 1100 человек (723 женщин и 377 мужчин).
ДНК из венозной крови или слюны выделяли фенол-хлороформным методом. Генотипирование полиморфизма ZNF804A rs1344706 проводили по методике, описанной ранее [23]. Использовали олигонуклеотидные праймеры следующей структуры: прямой – 5’-AGTGACCTTGGTGGAAATGG-3’и обратный – 5’-TTTTCCAGGTAGGGGATTGG-3’. Полимеразную цепную реакцию (ПЦР) проводили в реакционной смеси (объем 15 мкл), содержащей 2,5 мМ хлорида магния, 0,2 мМ каждого dNTP, 0,5 ед. полимеразы Taq, 100 нг геномной ДНК, 10 пкмол каждого из праймеров, 10х буфер для Taq-полимеразы. Сначала проводили денатурацию в течение 5 мин при 94 oС, процесс амплификации включал в себя 35 циклов (94 oC – 1 мин; 56 oC – 30 с; 72 oC – 1 мин). На заключительной стадии образцы прогревали при 72 oC 7 мин. Разделение полученных фрагментов осуществляли в полиакриламидном геле (8%) в течение одного часа при напряжении на электродах 220V. Длина фрагмента, полученного в результате амплификации, составляла 220 пар оснований (п.о.). Рестрикцию проводили с помощью эндонуклеазы Bse8I (производитель ООО Сибэнзим, Россия) при 60 oC в течение ночи. После проведения рестрикции на электрофореграмме визуализированы с помощью красителя бромистый этидий фрагменты длиной 114 и 106 п.о., что соответствовало генотипу АА; 114, 87, и 19 п.о. – генотип СС; 114, 106, 87, и 19 п.о. (гетерозиготный генотип АC).
Анализ данных. Различия между частотой генотипов оценивали с помощью точного критерия Фишера. В случае отвержения нулевой гипотезы об отсутствии различий между группами, измеряли силу ассоциации по величине отношение шансов (ОШ) и ее статистическую значимость, исходя из значений 95%-ного доверительного интервала (ДИ 95%). Уровень статистической значимости составлял 0,05. Различия между значениями клинических характеристик оценивали с помощью критерия Стьюдента. Для оценки ассоциации полиморфизма ZNF804A rs1344706 с клиническими характеристиками применяли обобщенную линейную модель, поскольку распределение значений всех используемых зависимых переменных соответствовало нормальному (D’Agostino’s K2 тест). В модель в качестве зависимых переменных включали возраст начала болезни или общий балл по шкале PANSS, в качестве фактора использовали генотип, а возраст и пол вводили в качестве ковариат. Post hoc анализ проводили с учетом поправки Бонферрони.
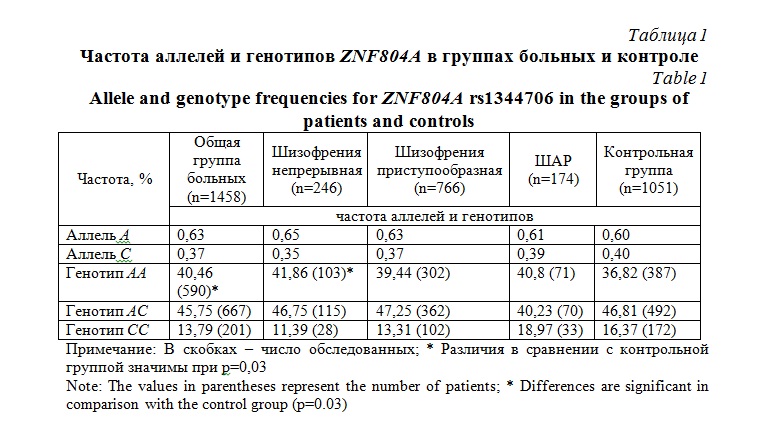
Результаты и их обсуждение. Распределение генотипов по полиморфизму ZNF804A rs1344706 не отклонялось от равновесия Харди-Вайнберга в группах больных (X2 = 0,32; р>0,05) и психически здоровых людей (X2 = 0,55; р>0,05). Частота минорного аллеля (40%) была близка к таковой для европейских популяций (38,4%) по данным проекта 1000 геномов http://www.internationalgenome.org. Данные по частоте аллелей и генотипов в контрольной группе, в общей группе больных, в подгруппах с различным типом течения шизофрении, а также в группе ШАР представлены в таблице 1. Обнаружено повышение частоты генотипа риска АА в общей группе больных по сравнению с контрольной группой (р=0,03, ОШ 1,31, ДИ 95% 1,03-1,7). При разделении на подгруппы по диагнозу значимое различие сохранялось только в подгруппе больных шизофренией с непрерывным течением (р=0,03, ОШ 1,63, ДИ 95% 1,04-2,6), в подгруппе с приступообразным течением различия были обнаружены на уровне тенденции (р=0,07, ОШ 1,3, ДИ 95% 1,0-1,7). Также отмечены на уровне тенденции (р=0,07) различия между непрерывной шизофренией и ШАР. Между ШАР и контролем различий в частоте генотипа АА не выявлено. Сравнение подгрупп показало, что в подгруппе больных ШАР частота генотипа АС снижена, по сравнению как с больными непрерывной шизофренией (р=0,03, ОШ 1,7, ДИ 95% 1,1-2,6), так и с больными приступообразной шизофренией (р=0,04, ОШ 1,7, ДИ 95% 1,1-2,6).
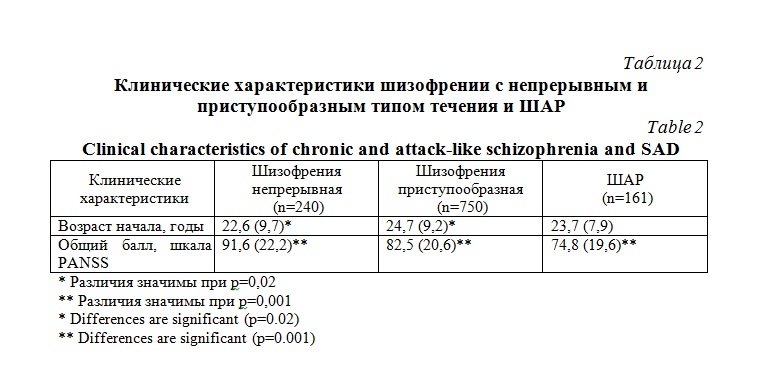
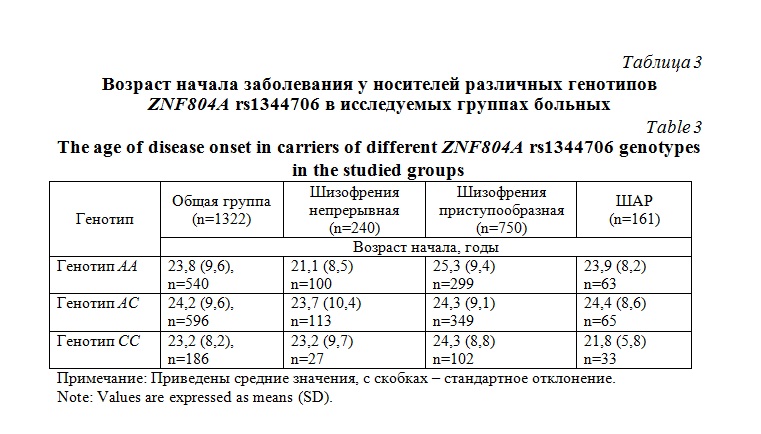
Анализ клинических характеристик выделенных подгрупп выявил некоторые значимые различия (табл. 2). Группа больных с непрерывным типом течения шизофрении отличалась более ранним возрастом начала по сравнению с группой с приступообразным течением (р=0,02) и большей выраженностью симптомов по суммарному баллу PANSS по сравнению с другими группами (р<0,001). Выраженность симптомов в группе с приступообразным течением была больше, чем в группе ШАР (р<0,001). При включении в обобщенную линейную модель возраста начала болезни в качестве зависимой переменной, выявлен значимый эффект пола (р=0,01). У мужчин начало болезни наблюдалось в среднем на 6 лет раньше, чем у женщин. Напротив, в подгруппе больных ШАР пол не оказывал влияния на возраст манифестации заболевания. Во всех группах отмечен значимый эффект такой ковариаты как возраст больного (р=0,0001). Генотип по полиморфизму ZNF804A rs1344706 не был ассоциирован с возрастом манифестации ни в одной из групп (табл. 3).
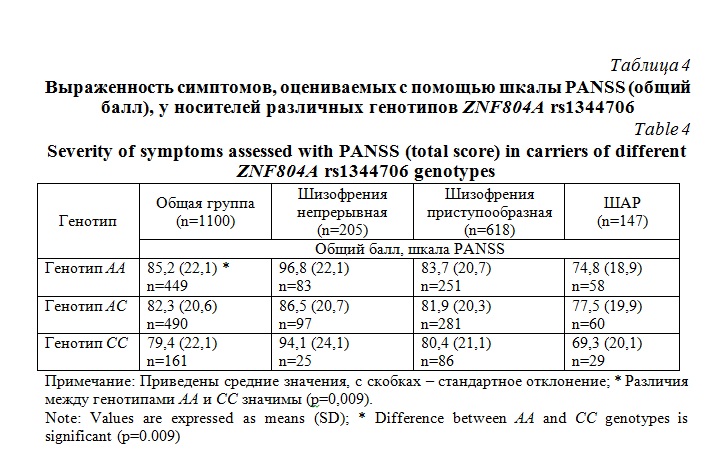
При введении в модель в качестве зависимой переменной общего балла по шкале PANSS не было выявлено эффектов пола и генотипа в группах с разными типами течения шизофрении и ШАР. Однако при объединении всех групп обнаружена ассоциация генотипа с общим баллом PANSS (р=0,007). Post hoc анализ показал наибольшую выраженность синдромов в группе носителей генотипа риска АА, а наименьшую – у носителей генотипа СС, различия были значимы (р=0,009) (табл. 4).
Таким образом, выдвинутое нами предположение о том, что ассоциация полиморфизма ZNF804A rs1344706 с шизофренией не зависит от клинической гетерогенности этого заболевания, подтвердилось лишь отчасти. Можно с определенной долей уверенности говорить, что генотип АА связан с риском шизофрении в группах с разными типами ее течения. Относительно ассоциации ZNF804A rs1344706 с ШАР сделать однозначное заключение на данном этапе исследований не представляется возможным. С одной стороны частота генотипа АА в группе ШАР не отличалась от контрольной группы, т.е. ассоциация отсутствовала. С другой стороны, при объединении групп с шизофренией и ШАР, как это имело место в некоторых публикациях [20, 24, 25], отмечено значимое повышение частоты генотипа АА по сравнению с контролем. К сожалению, поиск ассоциации этого полиморфизма с ШАР ранее не проводился, поэтому невозможно сравнить полученные нами результаты с известными данными. В то же время следует отметить, что в психиатрической литературе до сих пор нет единого мнения о том, является ли ШАР нозологически самостоятельным заболеванием, или входит в спектр шизофрения – БАР [26, 27]. Поскольку ранее сообщалось об ассоциации между ZNF804A rs1344706 и БАР, возможно априори считать, что этот полиморфизм связан и с ШАР.
Обнаруженная в настоящей работе ассоциация между генотипом риска АА и выраженностью симптомов шизофрении находится в соответствии с литературными данными. Так, в работе [28] в группе носителей генотипа АА тяжесть позитивных симптомов, которые оценивались по шкале позитивных симптомов (SAPS), была значимо выше, чем у больных шизофренией с генотипом СС. Сходные результаты были получены и при использовании шкалы PANSS, однако различия между генотипами наблюдались на уровне тенденции [29]. Размер выборок больных в указанных публикациях не превышал 300 человек. В исследовании, которое было близким по составу групп к нашей работе, связь между rs1344706 и симптомами психотического расстройства определяли в группах больных шизофренией (n=568), ШАР (n=127) и БАР (n=125), при этом использовали факторный анализ, в результате которого выявлены такие факторы как мания, депрессия, позитивные, негативные, дезорганизационные симптомы [20]. У носителей генотипа АА отмечена большая выраженность симптомов мании в общей группе, однако авторы не указывают, сохранялась ли эта связь в изучаемых группах.
Заключение. Таким образом, наши результаты подтверждают данные GWAS шизофрении, о том, что полиморфизм ZNF804A rs1344706 ассоциирован с заболеванием и его тяжестью, a вариантом риска является генотип АА. Полученные данные об отсутствии ассоциации между rs1344706 и ШАР, можно рассматривать как предварительные, тем не менее, они указывают на необходимость дальнейших исследований в этом направлении на больших группах больных, включающих в себя не только ШАР, но и близкий к нему по синдромальной структуре БАР с психотическими симптомами.
В отношении данной статьи не было зарегистрировано конфликта интересов.
Благодарности
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 19-07-01119.





















Список литературы