Комплексная оценка коррекции очищенной микронизированной флавоноидной фракцией нарушений при ADMA-подобной преэклампсии в эксперименте
Aннотация
Актуальность: Около 10% беременностей в мире сопровождается гипертензивными расстройствами, при этом от 2 до 8% приходится на преэклампсию. Одним из компонентов патогенеза преэклампсии является плацентарная ишемия. Выделяющиеся при ней гуморальные факторы обладают провоспалительным эффектом и могут способствовать развитию эндотелиальной дисфункции. Одним из возможных вариантов сниженя эффектов этих цитокинов может явиться использование препаратов содержащих природные флавоноиды, одним из положительных моментов которых является снижение веноспецифического воспаления. Цель исследования:Исследовать эффективность использования очищенной микронизированной флавоноидной фракции при коррекции функциональных нарушений, возникающих при преэклампсии в эксперименте. Материалы и методы:Эксперимент выполнен на 100 белых крысах-самках линии Wistar массой 250-300 г. ADMA-подобный агент – (L-NAME) вводили внутрибрюшинно в дозе 25 мг/кг/сут в c 14 по 20 сут. беременности. Очищенную микронизированную флавоноидную фракцию (диосмин+флавоноиды в пересчете на гесперидин) в дозировках 86 мг/кг и 260 мг/кг вводили перорально однократно в сутки с 14 по 20 сутки беременности. На 21 сутки беременности проводили функциональные пробы и лабораторные исследования. Результаты:Введение лабораторным животным очищенной микронизированной флавоноидной фракции приводит к выраженной коррекции патологических изменений при экспериментальной ADMA-подобной преэклампсии с наибольшим эффектом в большей дозе используемого препарата. Отмечалось достоверное снижение систолического и диастолического давления соответственно, улучшение микроциркуляции в плаценте, восстановление NO-синтезирующей функции эндотелия, уменьшении протеинурии. Заключение:Результаты проведенного исследования свидетельствуют о перспективности применения очищенной микронизированной флавоноидной фракции для коррекции морфофункциональных изменений при преэклампсии и обосновывают целесообразность дальнейших исследований в этом направлении.
Ключевые слова: очищенная микронизированная флавоноидная фракция, преэклампсия, эндотелиальная дисфункция, крысы, протеинурия, микроциркуляция
Введение. Преэклампсия является одной из актуальных проблем современной медицины [1]. Основными моментами в патогенезе этого заболевания являются дисфункция эндотелия [2] и плацентарная ишемия. Выделяющиеся при ней гуморальные факторы обладают провоспалительным эффектом и могут способствовать развитию эндотелиальной дисфункции [3, 4]. В связи с этим, снижение выделения провоспалительных факторов ишемического генеза может явиться перспективным направление для создания новых лекарственных препаратов для лечения и профилактики преэклампсии. Одним из возможных вариантов снижение эффектов этих цитокинов может явиться использование препаратов содержащих природные флавоноиды, одним из положительных моментов которых является снижение веноспецифического воспаления [5, 6].
К таким лекарственным препаратам относится очищенная микронизированная флавоноидная фракция. 90 % ее составляет диосмин и 10 % приходиться на другие флавоноиды (гесперидин, диосметин, линарин, изорхоифолин) [7].
Наиболее изученным среди них является диосмин. Он представляет собой биофлавоноидный гликозид (диосметин 7-рутинозид или 3', 5,7-тригидрокси-4'-метоксифлавон-7-рамноглюкозида) [8, 9]. В природе он содержится во многих растениях [10, 11], в том числе в цитрусовых [12, 13], из которых был впервые выделен в 1925 году. В большинстве случаев он выделяется и используется вместе с гесперидином [9]. В кишечнике под действием ферментов микрофлоры диасмин гидролизуется в свою агликоновую форму – диасметин, который потом и всасывается [8, 14]. В тканях он быстро метаболизируется, а его метаболиты в основном выводятся с мочой [15]. Вторым по содержанию в составе очищенной микронизированной флавоноидной фракции является гесперидин. Он так же представляет собой флавоноидный гликозид и содержится в цитрусовых [16, 17].
Традиционно очищенная микронизированная флавоноидная фракция в первую очередь ассоциируется с терапией патологии венозной стенки и его венотонизирующими войствами [7]. Как лекарственный препарат для лечения венозной недостаточности и геморроя стал применяться с 60х годов 20 столетия [9]. Несмотря на большой стаж, применение этих флавоноидов при варикозной болезни не утратило свою актуальность [18, 19]. Можно сказать обратное. В настоящее время появляется все больше публикаций о положительных эффектах очищенной микронизированной флавоноидной фракции при исследованиях посвященных более узкой клинической ситуации при венозной недостаточности. У женщин с варикозным расширением вен таза введение исследуемого препарата дает положительный клинический результат [20]. Описанные фловоноиды оказывают положительный эффект при варикозной экземе [21], снижают уровень маркеров оксидативного стресса при хронической венозной недостаточности [22], опубликованы данные о положительных эффектах при консервативном лечении геморроя на различных стадиях [23, 24] и при его комбинированной терапии [25].
Не маловажное значение в клинических эффектах флавоноидов играет их способность улучшать дренажную функцию тканей. При их применении уменьшается постравматический отек верхних конечностей [26,], наблюдается положительная динамика при лимфидеме у онкологических больных [27], при синдроме Рейно [28], при варикозной болезни [29].
В последнее время в литературе стали появляться данные о положительных эффектах описываемых флавоноидов при сахарном диабете. Диасмин проявляет защитное действие на развитие кардиомиопатии у крыс с стрептозотоцин-индуцированным сахарным диабетом [9] и предотвращает патологические изменения хрусталика у этих животных [30]. Он способен ускорять заживление диабетической язвы [31] и проявлять нейропротективный эффект при экспериментальном сахарном диабете [32]. Диасмин повышает устойчивость клеток сетчатки глаза при повышенной концентрации глюкозы [33]. Способность диасмина оказывать нефропротективные эффекты при экспериментальном сахарном диабете, так же свидетельствуют о его перспективности при лечении этого заболевания [34]. Снижение гипергликемии диасмином при стрептозотоцин-индуцированном сахарном диабете объясняется его активирующим действием на имидазолиновые рецепторы и выделение β-эндорфина [35, 36].
Другим нарушением метаболизма, но часто ассоциируемым с сахарным диабетом и заболеваниями сердечно-сосудистой системы является метаболический синдром. Было показано, что введение диасмина животным с экспериментальным метаболическим синдромом происходило улучшение ряда функциональных и биохимических показателей [37]. У животных с подобным нарушением метаболических процессов диосмин предотвращал развитие нефропатии посредством снижения оксидативного стресса [38].
Диосмин обладает, кроме перечисленных эффектов, еще большим спектром протективных свойств. Он способен оказывать благоприятное действие на слизистую желудка и кишечника, проявляя антиульцирогенное действие [39, 40], оказывать положительный эффект при синдроме гиперстимуляции яичников [41], ускорять рана заживление [42], проявлять нейропротективные [43, 44] и болеутоляющие эффекты при различной патологии [45, 46], уменьшать поражение печени [17, 47] в различных условиях т.д. Однако, с учетом проводимого исследования, целесообразным видится более подробное освещение эндотелиопротективной активности и ангиопротективных свойств, не касаясь в основном аспекте патологии венозной стенки.
Первое упоминание о применении детралекса относиться к 1972-1973 годам. Он позиционируется как препарат для лечения варикоза у беременных [48], так и перспективный препарат при различных акушерско-геникологических патологиях [49]. Несмотря на это, в последующие годы имеются единичные исследования посвященные применению детралекса у беременных, но и они в подавляющем большинстве при патологии венозной стенки. Вместе с тем, опираясь на не многочисленные пуликации, можно сказать, что имеются данные о безопасности детралекса у беременных [50] и положительном эффекте при применении диасмина при преждевременных родах [51], положительном влиянии его на агрегационную способность тромбоцитов и нейропротективном эффекте у плода при преэклампсии [52]. Первая публикация с включением широкомасштабных данных о применении диасмина у беременных посвященная безопасности появилась только 2016 году [53]. В нем говориться о его относительной безопасности для матери и плода с анализом данных за несколько лет. Еще одной публикацией, свидетельствующей о безопасности флавоноидов, являются рекомендации экспертной группы Польского гинекологического общества по применению Детрамакса при беременности [54]. По данным EMA за 2015 год периодические отчеты об обновлениях безопасности подтверждает безопасность для диосмина (PSUSA/00001106/202501). В доступной литературе нет данных о токсическом действии гесперидина. По данным EMA за 2015 подтверждают безопасность для диосмина с гесперидином (PSUSA/00001107/202501). Так же нет сообщений о побочных эффектах препаратов, в которые входит гесперидин.
Таким образом, с учетом современного представления о патогенезе преэклампсии (ишемия плаценты, эндотелиальная дисфункция, оксидативный стресс), биологических свойств очищенной микронизированной флавоноидной фракции (эндотелиопротективная активность, антиоксидантная активность, положительные эффекты при ишемии-реперфузии, противовоспалительная активность), отсутствии данных о токсичесих эффектах при беременности, изучение данного препарата является перспективным в аспекте поиска новых лекарственных средств для профилактики и терапии преэклампсии. Эти обстоятельства и послужили предпосылкой для нашего исследования.
Цель исследования. Исследовать эффективность использования препарата, содержащего природные флавоноиды, при нарушениях, возникающих при ADMA-подобной преэклампсии.
Материалы и методы исследования. Исследование проводилось в НИИ фармакологии живых систем ФГАОУ ВО НИУ БеЛГУ. Проведение эксперимента выполнялось в соответствие с Приказом Минздрава России от 01.04.2016 N199н «Об утверждении Правил надлежащей лабораторной практики» и European Convention for the Protection of Vertebral Animals Used for Experimental and Other Scientific Purposes. CETS N170.
Эксперимент выполнен на 100 белых крысах-самках линии Wistar массой 250–300 г. Моделирование экспериментальной преэклампсии и оценка эффективности коррекции возникающих патологических изменений проводилось по ранее опубликованной методике [55, 56].
Детралекс в дозировке 86 мг/кг и 260 мг/кг вводили перорально через зонд 1р/день с 14 по 20 сутки беременности животными 3 и 4 групп.
Для всех данных была применена описательная статистика: данные проверены на нормальность распределения. Тип распределения определялся критерием Шапиро-Уилка. В случае нормального распределения были подсчитаны среднее значение (M) и стандартная ошибка среднего (m). Межгрупповые различия анализировались с использованием t-критерия Стьюдента или U-критерия Манна-Уитни, в зависимости от типа распределения. Расчеты выполнены с помощью статистических программ Microsoft Excel 7.0.
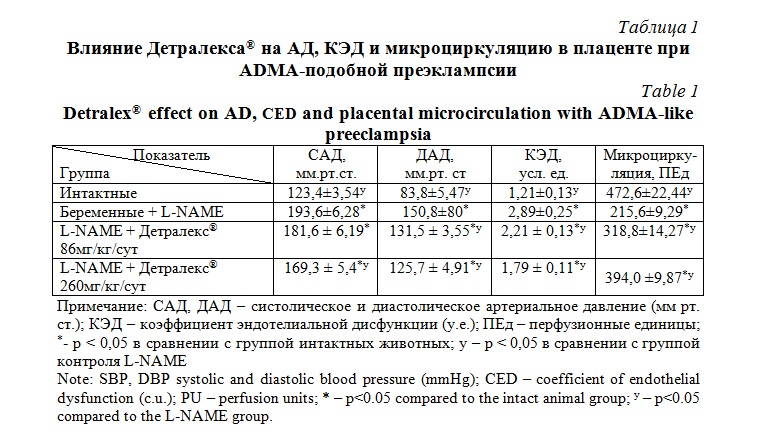
Результаты исследования. Моделирование преэклампсии у животных сопровождалось повышение артериального давление, нарушением функции эндотелия, снижением микроциркуляции в плаценте (табл.1).
Кроме этого, наблюдалось повышение протеинурии и подавление NO-синтезирующей функции эндотелия (табл. 2).
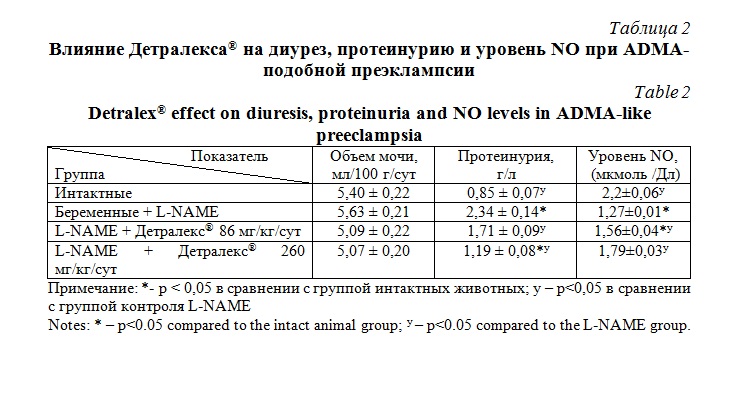
Введение Детралекса® в дозировках 86 мг/кг и 260 мг/кг с 14 до 20 сутки приводило к снижению артериального давления в большей дозе, улучшению функции эндотелия, повышению микроциркуляции в плаценте (табл. 1). Кроме этого, происходило повышение активности NO-синтезирующей функции эндотелия и снижение протеинурии (табл. 2).
При микроскопическом изучении гистологических препаратов у контрольных животных с моделированием преэклампсии были выявлены деструктивно-дистрофические изменения в плаценте.
В плодной части плаценты в ворсинках наблюдался интерстициальный отек, результатом которого являлось сдавление кровеносных сосудов и кровоизлияние в строму ворсин, а так же приводящее к увеличению размеров ворсин. Отечные и увеличенные в размерах якорные и терминальные ворсинки приводят к уменьшению площади межворсинчатых пространств, заполненных материнской кровью. В большом количестве в соединительной ткани ворсин визуализируются увеличенные в диаметре кровеносные сосуды (ангиоматоз), с явлениями тромбоза и отложением фибриновых нитей в полости кровеносных сосудов. В толще плодной части плаценты визуализируются очаги ишемии и некроза. В строме большинства ворсинок определяется круглоклеточная инфильтрация лимфоцитами. В некоторых срезах плаценты выявлены локальные очаги скопления нейтрофилов и лимфоцитов. Клетки Кащенко-Гофбауэра крупных размеров, локализуются по всей площади плодной части плаценты. Следует отметить, что между терминальных ворсин встречаются, так же, крупные децидуальные клетки с темно базофильной цитоплазмой. При этом, количество синцитиальных узелков и синцитиальных точек, свидетельствующих о зрелости плаценты очень низкое.
Относительно материнской части плаценты, а именно визуализируемой на стеклах децидуальной оболочки, следует отметить, что в гигантоклеточном трофобласте ярко выражены дистрофические изменения. Наблюдаются кистозно расширенные полости, заполненные фибрином. Определяются оптически пустые децидуальные клетки на фоне клеток с абсолютно сохранными структурами. Следует также отметить, что в толще материнской части плаценты визуализируется большое количество расширенных, с явлениями ангиоматоза и гиалиноза, кровенаполненых кровеносных сосудов. Непосредственно в месте прилегания децидуальной оболочки к тканям матки наблюдаются очаги некроза, инфильтрации. Следует также отметить, что в толще материнской части плаценты визуализируется большое количество расширенных, с явлениями ангиоматоза и гиалиноза, кровенаполненых кровеносных сосудов.
При проведении морфометрических исследований отмечается уменьшение концентрации клеточного пула в метеринской и плодной частях плаценты и уменьшение диаметра ворсин (табл. 3).

При введении детралекса наблюдалась выраженная положительная динамика у животных с экспериментальной преэклампсией по сравнению с группой «нелеченный» животных. Наибольший эффект наблюдался в группе с ввведением исследуемого препарата в дозе 260 мг/кг. В области стволовых ворсин располагается большое количество кровенаполненных сосудов. Явления отека стромы ворсинок не выражены. Хорошо определяются промежуточные и терминальные ворсины. Все ворсины окружены слоем симпластотрофобласта. В местах его отсутствия визуализируются отложения фибриноида. В поле зрения большое количество синцитиальных почек и узелков.
Структуры фетоплацентарного барьера представлены в полном объеме. В строме ворсин определяются клетки Кащенко-Гофбауэра. Лакуны с материнской кровью не сужены, кровенаполнены. В материнской части плаценты в гигантоклеточном трофобласте продолжают сохранять дистрофические изменения. Черепицеобразные пласты децидуальных клеток со стороны якорных ворсин покрыты фибриноидом. В толще этих пластов визуализируются локальные участки, образованные оптически пустыми децидуальными клетками с темно базофильными ядрами. В непосредственной близости к таким зонам определяются слившиеся симпластические структуры – клетки Кащенко-Гофбауэра с крупными базофильными ядрами.
Проведенная морфометрия свидетельствует о повышении плотности клеточного пула в материнской и плодной частях плаценты, а так же об увеличении диаметра ворсин.
Обсуждение результатов. Положительные эндотелиопротективные эффекты исследуемого препарата можно объяснить снижением эффектов провоспалительных цитокинов [5]. При этом происходит уменьшение их ингибирующего действия на eNOS, снижение содержания продуктов перекисного окисления и повышение биодоступности NO. Это приводит к восстановлению регуляторных механизмов сосудистого тонуса как системного, так и местного.
Согласно литературным данным, диосмин и гиспиридин обладают выраженными противовоспалительными и антиоксидантными свойствами [8, 57]. Противовоспалительный эффект связываю со способностью диасмина снижать выработку провоспалительных цитокинов: IL-6, IL-1β, TNF-α и др. [9, 42, 58]. Кроме этого диасмин способен снижать индуцированную выработку NO путем ингибирования iNOS [8, 42]. Отчасти эти эффекты могут быть опосредованы за счет снижения оксидативного стресса. Так при повреждении различных органов акриламидом диасмин и гисперидин снижали активность глутатионпероксидазы, супероксиддисмутазы и каталазы [42, 17]. Кроме этого происходило предотвращение перекисного окисления липидов и повышение активности антиоксидантной системы [17, 59].
Первое упоминание о способности оказывать эндотелиопротективное действие относиться к 1991 году [60]. У спонтанно гипертензивных крыс введение флавоноидов приводило к улучшению сосудодилатирующих возможностей, соотношение интима/медиа и снижению протеинурии, но эффекты были умеренными по выраженности [61]. Подобный эффект наблюдался у крыс при моделировании L-NAME индуцированной гипертензии [62]. При тромбозе глубоких вен травматического происхождения диасмин угнетает апоптоз эндотелиальных клеток [63]. Эндотелиопротективные эффекты проявляются как при лечении варикозной болезни [64, 65] так и при коррекции артериальной патологии [23]. Особое внимание заслуживают данные о протективных эффектах диасмина при ишемически-реперфузионных повреждениях [66, 67], особенно мелких сосудов [68]. К молекулярным механизмам посредствам которых реализуются эндотелиопротективные эффекты можно отнести: подавление синтеза провоспалительных гуморальных факторов, снижение выработки молекул клеточной адгезии, модулирующее действие на проницаемость сосудистой стенки, благоприятное воздействии на соотношение прооксидантных и антиаксидантных факторов [7].
Заключение. Введение животным Детралекса® в дозировках 86 мг/кг и 260 мг/кг в сутки приводит к выраженной коррекции патологических изменений при экспериментальной ADMA-подобной преэклампсии с наибольшим эффектом в большей дозе используемого препарата. Отмечалось достоверное снижение систолического и диастолического артериального давления, улучшение микроциркуляции в плаценте, восстановление NO-синтезирующей функции эндотелия, уменьшении протеинурии. Полученные данные экспериментально обосновывают перспективность использования Детралекса® как эндотелиопротекора при преэклампсии и актуальность дальнейших исследований в этом направлении.
В отношении данной статьи не было зарегистрировано конфликта интересов.





















Список литературы