Особенности видового состава и функциональной активности тучных клеток в децидуальной ткани пациенток с неразвивающейся беременностью и синдромом поликистозных яичников
Aннотация
Актуальность: Среди проблем акушерства и гинекологии главенствующие позиции занимают вопросы бесплодия, невынашивания беременности, рождения доношенных здоровых детей. Синдром поликистозных яичников – заболевание, одним из клинических проявлений которого является бесплодие, влекущее за собой при наступлении спонтанной беременности у метаболически нескомпенсированных пациенток тяжелые осложнения гестации, что вносит значительный вклад в структуру перинатальной заболеваемости, а порой, и смертности. Цель исследования: Целью исследования являлось изучение видового состава и функциональной активности тучных клеток в децидуальной ткани пациенток c синдромом поликистозных яичников и неразвивающейся беременностью, сравнение полученных данных с таковыми от пациенток с неразвивающейся беременностью без сопутствующих метаболических нарушений и при физиологическом течении беременности. Материалы и методы: Всего обследовано 60 пациенток. Иммуногистохимическая идентификация триптазы и химазы тучных клеток в образцах децидуальной ткани пациенток была проведена при помощи мышиных моноклональных антител к триптазе и химазе. Для визуализации протеаз при множественном иммуномаркировании были применены вторичные антитела для триптазы (Goat Anti-Rabbit Ig H&L, конъюгированные с Alexa Fluor-488) и химазы (Goat-Anti-Mouse Ig H&L, конъюгированные с Cy3). Результаты: Количество тучных клеток в децидуальной ткани пациенток с неразвивающейся беременностью и синдромом поликистозных яичников в 4,4 раза выше, чем при физиологической беременности и в 1,38 раз – при неразвивающейся беременности и отсутствии метаболических нарушений. Протеазный профиль тучных клеток сдвинут в сторону экспрессии химазы. Сравнимая функциональная активность изучаемых клеток при неразвивающейся беременности в обеих группах свидетельствует об отсутствии влияния синдрома поликистозных яичников на степень дегрануляции тучных клеток. Заключение: Изменение количественного и качественного состава тучных клеток подтверждает их участие в патогенетических механизмах формирования неразвивающейся беременности на фоне неблагоприятных метаболических нарушений, характерных для синдрома поликистозных яичников.
Ключевые слова: синдром поликистозных яичников, тучные клетки, децидуальная ткань, неразвивающаяся беременность
Введение. Согласно современным представлениям, СПЯ (синдром поликистозных яичников) является полигенным эндокринным заболеванием, реализация которого происходит при участии внешних факторов. Основными проявлениями СПЯ являются гиперандрогения, менструальная и/или овуляторная дисфункция и поликистозная морфология яичников [1, 2]. В связи с демографической ситуацией, сложившейся в последние годы не только в нашей стране, но и в мире, особый интерес представляет влияние столь широко представленного патологического состояния (общепопуляционная частота встречаемости СПЯ составляет, по данным разных авторов, от 6-9% до 19,9%) на репродуктивную функцию женщин детородного возраста [2, 3]. Патогенетические механизмы бесплодия и невынашивания беременности, несмотря на большое количество публикаций по данной проблеме и высокий индекс цитирований, что свидетельствует об остром интересе к изучаемой теме, остаются до конца не установленными. Основной акцент современных исследований сводится к факту ановуляции, тогда как очень незначительное количество работ посвящено специфическим изменениям эндометрия, происходящим при СПЯ. Несмотря на имеющиеся данные о том, что частота невынашивания беременности, возникшей на фоне метаболических нарушений при СПЯ как спонтанно, так и при индукции, не отличается от общепопуляционной, многие исследователи пришли к противоположным выводам [4-7].
Несомненно влияние СПЯ на течение беременности. Установлена прямая связь с гипертензивными расстройствами во время беременности, гестационным сахарным диабетом, преэклампсией, риском преждевременных родов, повышением частоты оперативного родоразрешения и неблагоприятными перинатальными исходами, такими как низкие баллы по шкале Апгар, высокая заболеваемость и перинатальная смертность, ЗВУР или, наоборот, макросомия плода, аутизм, гиперреактивность и формирование фенотипа СПЯ у потомства [8, 9, 10]. Ввиду того, что морфологическим субстратом для формирования вышеуказанных осложнений является плацента, а на ранних этапах развития беременности – взаимоотношения между хориальной и децидуальной тканью, научный интерес представляет изучение морфофункциональных изменений, происходящих именно в децидуальной ткани пациенток, страдающих СПЯ. К сожалению, исследования подобного рода немногочисленны. Имеются единичные работы, посвященные изменениям в эндометрии при СПЯ. Взаимосвязь метаболических изменений, происходящих при СПЯ, и невынашивания беременности подтверждена в экспериментальной модели на животных [11]. Публикаций, оценивающих популяцию тучных клеток в децидуальной ткани при СПЯ, не найдено.
Согласно данным ряда исследователей, особенностями морфофункциональных изменений эндометрия при СПЯ являются нарушения циклических изменений, провоспалительный цитокиновый профиль, изменение экспрессии рецепторов к половым гормонам, ведущее к прогестеронорезистентности и задержке децидуальной перестройки, что не может не отразиться на процессах имплантации и цитотрофобластической инвазии, а в последствии – и на функциональном состоянии плаценты [12, 13]. Увеличение провоспалительных цитокинов на фоне снижения числа NK-клеток в эндометрии при СПЯ также показано в исследовании Piltonen T.T. et al. [14].
Тучные клетки – гранулоциты, играющие ключевую роль в воспалительных и иммунологических реакциях. Установлен факт участия тучных клеток в физиологических циклических изменениях в эндометрии (изменение цитоархитектоники, ремоделирование спиральных артерий), а также в формировании и поддержании беременности, в связи с чем интересна их оценка в децидуальной ткани на ранних сроках беременности как при физиологическом, так и при осложненном ее течении [15, 16].
Триптаза и химаза тучных клеток – полифункциональные иммунологически активные протеазы, способные вызывать и поддерживать воспалительный процесс, а также обладать противовоспалительным эффектом в зависимости от ситуации, стимулировать пролиферацию и дифференцировку клеток, обеспечивая заживление, регенерацию тканей после повреждения, регулировать ангиогенез и структурную перестройку тканей. Роль тучных клеток и их протеаз в генезе патологических состояний, возникающих во время беременности, до сих пор недостаточно ясна.
Материалы и методы исследования. В исследовании приняли участие 60 беременных женщин, сопоставимых по возрасту, срок гестации которых варьировал от 7 до 11 недель. Длительность пребывания погибшего плодного яйца в полости матки не превышала 7 дней, что было подтверждено результатами ультразвуковых исследований. Пациенты были разделены нами на три группы по 20 человек: группа I – пациентки с СПЯ и неразвивающейся беременностью, II группа – здоровые пациентки с неразвивающейся беременностью и группа контроля – здоровые женщины, обратившиеся для прерывания беременности.
Гистологический материал был собран после эвакуации продуктов зачатия, фиксирован в 10% формалине, доставлен в НИИ ЭБМ в течение суток. Объект исследования – децидуальная ткань.
Детекция тучных клеток была осуществлена путем иммуногистохимической идентификации характерных протеаз. Для определения триптазы использовали кроличьи моноклональные антитела (Anti-Mast Cell Tryptase antibody, AbCam, #ab151757, разведение 1:1000), химазы - мышиные (Anti-Mast Cell Chymase antibody, AbCam, #ab2377, разведение 1:500). Козьи антимышиные и антикроличьи антитела, коньюгированные с пероксидазой хрена (AmpliStain ™ anti-Mouse 1-Step Horseradish Peroxidase, SDT, и AmpliStain ™ anti- -Rabbit 1-Step Horseradish Peroxidase, SDT GmbH, Baesweiler, Germany) были применены как вторичные антитела согласно инструкции [17, 18]. Ядра клеток были окрашены гематоксилином Майера.
Аналогичные первичные антитела были использованы и для множественного иммуномаркирования. Для детекции химазы и трипатзы использовали вторичные антитела: Goat Anti-Rabbit Ig H&L, конъюгированные с Alexa Fluor-488 (#ab150077) (разведение 1:500) и Goat-Anti-Mouse Ig H&L, конъюгированные с Cy3 (#ab97035) (разведение 1:500) соответственно. Визуализацию проводили, используя фильтры. Ядра клеток были окрашены неинтеркалирующим красителем DAPI (5 мкг/мл PBS, 15 сек). В качестве монтажной среды применяли Vectashield (Vector Laboratories, Burlingame, США).
Полученные срезы были оценены на аппаратно-программном комплексе для биологических исследований ZEISS Axio Imager.А2 (Carl Zeiss Microscopy, Германия). Документация изображений производилась камерой Camera Axiocam 506 color. Тучные клетки в децидуальной ткани определяли на полях зрения 700х500 мкм при 20-кратном увеличении. Для объективизации данных для каждого измерения проводили оценку 20 полей зрения в каждом образце. Обработку полученных данных проводили с использованием программного обеспечения ZEN 2.3 (blue edition, Carl Zeiss, Germany). Достоверность различий в случае нормального распределения данных определялась с помощью t-критерия Стьюдента.
Результаты и их обсуждение. Был произведен подсчет тучных клеток с экспрессией различных протеаз в децидуальной ткани пациенток изучаемых групп. Результаты отражены в таблице 1

Согласно полученным данным, содержание тучных клеток и количество их контактов друг с другом в децидуальной ткани пациенток первой и второй групп было выше в разы в сравнении с биоматериалом, собранным после прерывания нормально развивавшейся беременности, установлено большее число химаза-позитивных клеток и клеток с одновременной экспрессией химазы и триптазы. При этом при неразвивающейся беременности, возникшей на фоне СПЯ, общее число тучных клеток возросло в 4,4 раза, тогда как при неразвивающейся беременности без СПЯ – только в 3,2 (рис. 1).
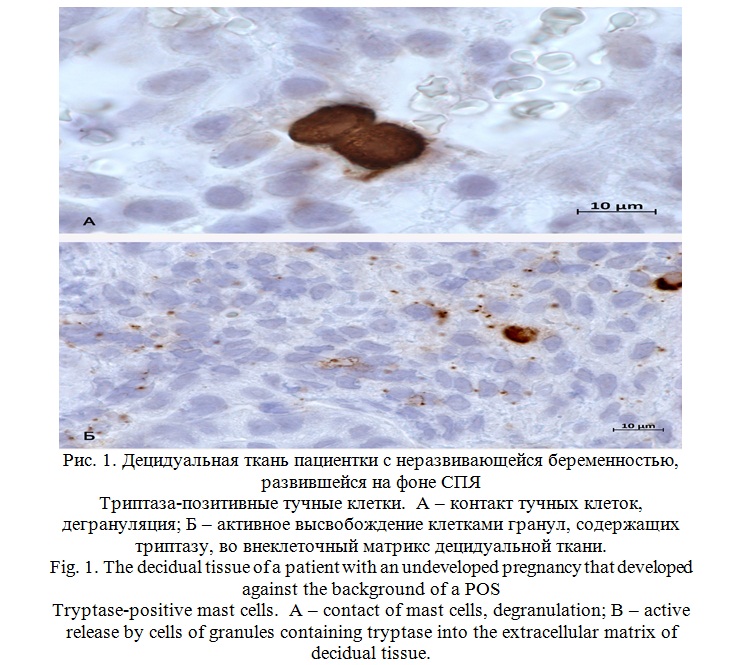
В группе контроля количество тучных клеток, экспрессирующих химазу составило 9,47%, тогда как в первой группе – 22,78%, во второй – 19,47%, а клеток с одновременной экспрессией обеих протеаз – 7,52% в группе контроля, 17,06% – в первой группе и 13,22% – во второй (рис. 2).

Количество тучных клеток, экспрессирующих химазу у пациенток I группы в сравнении со II было на 3,3% выше, а клеток с двойной экспрессией – на 3,8%. Сдвиг протеазного профиля в сторону экспрессии химазы у пациенток с неразвивающейся беременностью и СПЯ, возможно, отражает влияние метаболических особенностей, присущих СПЯ, на качественный состав тучных клеток.
Наряду с изменением количественного и качественного соотношения исследуемых клеток также выявлено изменение их функциональной активности при неразвивающейся беременности (табл. 2).

Достоверных различий в степени дегрануляции при наличии и отсутствии СПЯ не установлено, что позволяет сделать заключение об отсутствии влияния метаболических расстройств, присутствующих при СПЯ на функциональную активность тучных клеток. В то же время, возросшее количество тучных клеток при одинаково высокой функциональной активности, как и при неразвивающейся беременности без сопутствующего СПЯ, в итоге приводит к большему высвобождению секреторных гранул, часто расположенных на большом расстоянии от дегранулировавших клеток, у пациенток первой группы. Количество секреторных гранул в цитоплазме было значительно выше у пациенток с неразвивающейся беременностью вне зависимости от наличия СПЯ, что в сочетании с активной дегрануляцией указывает на усиленный биогенез протеаз при неразвивающейся беременности.
В исследованиях, посвященным изучению тучных клеток при неразвивающейся беременности, проведенных ранее, мы связывали повышенную способность к дегрануляции с аномальной ангиогенной активностью, вызванной недостаточной перфузией. На фоне метаболических нарушений, присущих СПЯ мы ожидали возрастание числа дегранулировавших клеток, но вопреки нашим ожиданиям, активность дегрануляции в I и II группах была сопоставима и максимальна (по данным ранее проведенных исследований) [19, 20]. Возможно, способность тучных клеток к дегрануляции имеет пределы и ограничена, что требует подтверждения.
Избыточная экспрессия химазы, наряду с увеличением функциональной активности клеток, была показана нами при неразвивающейся беременности и явлениях децидуита, что позволило предположить участие химазы в процессах воспаления и фиброобразования [20]. Уточнение патогенетических механизмов взаимосвязи СПЯ и повышенной экспрессии химазы тучными клетками требует дальнейшего изучения.
Заключение. Установлено участие тучных клеток в патогенетических механизмах формирования неразвивающейся беременности на фоне СПЯ: их число в 4,4 раза выше, чем в децидуальной ткани пациенток с физиологической беременностью и в 1,38 раз – при неразвивающейся беременности и отсутствии метаболических нарушений. Протеазный профиль тучных клеток при изучаемом заболевании сдвинут в сторону экспрессии химазы, количество клеток с одновременной экспрессией обеих протеаз выше на 3,8% в сравнении с группой II. Функциональная активность тучных клеток при неразвивающейся беременности как при наличии, так и при отсутствии СПЯ сопоставима и максимальна, что при учете численного превосходства клеток при неразвивающейся беременности и СПКЯ, свидетельствует о большем высвобождении биологически активных веществ в децидуальной ткани пациенток I группы.





















Список литературы