Связь полиморфизма RS12328675 COBLL1 с коронарной болезнью сердца и промежуточными фенотипами атеросклероза: валидационное исследование у жителей Центральной России
Aннотация
Актуальность: Известно, что развитие ишемической болезни сердца (ИБС), как полигенной мультифакториальной патологии, детерминировано сложным взаимодействием между генетическими и средовыми факторами. Результаты генетических исследований позволяют говорить о широком спектре полиморфных вариантов генов – т.н. однонуклеотидных полиморфизмов (SNP), вносящих вклад в патогенез ИБС в различных популяциях мира. Цель исследования: Анализ ассоциации полиморфного варианта rs12328675 гена COBLL1 с показателями липидного обмена и толщиной комплекса интима-медиа сонных артерий, и риском развития ишемической болезни сердца (ИБС) у жителей Центральной России. Материалы и методы: Материалом для исследования послужили образцы геномной ДНК биобанка Научно-исследовательского института генетической и молекулярной эпидемиологии Курского государственного медицинского университета (N=1340), полученные от 719 больных ИБС и 621 относительно здоровых добровольцев. Результаты: Установлено, что генотип rs12328675-C/C гена COBLL1 ассоциирован с повышенным риском развития ИБС, в то время как генотип rs12328675-T/C, наоборот, был связан с пониженным риском развития болезни (P=0,004). SNP rs12328675 гена COBLL1 был статистически значимо ассоциирован с уровнем общего холестерина крови (P=0,028, эффект сверхдоминирования). Данный полиморфизм также был связан с толщиной комплекса интима-медиа сонных артерий (P=0,009, аддитивный эффект). Биоинформатический анализ позволил охарактеризовать функциональную значимость SNP rs12328675 гена COBLL1. В частности, посредством связывания различных транскрипционных факторов может модулироваться экспрессия гена COBLL1 в сердечной мышце и коронарных артериях, что может иметь патогенетическое значение для развития ишемической болезни сердца. Заключение: В результате установлено, что у жителей Центральной России полиморфный вариант rs12328675 гена COBLL1 ассоциирован с развитием ишемической болезни сердца, а также с толщиной комплекса интима-медиа сонных артерий ТИМ и общим холестерином крови.
Ключевые слова: ишемическая болезнь сердца, общий холестерин крови, толщина комплекса интима-медиа сонных артерий, ген COBLL1, однонуклеотидый полиморфизм
Введение. Ишемическая болезнь сердца (ИБС) – распространенное сердечно-сосудистое заболевание, являющееся ведущей причиной смертности, инвалидизации, потери трудоспособности населения, как во всем мире, так и в Российской Федерации [1]. Атеросклеротическое поражение коронарных артерий является ведущей причиной развития ИБС, которое возникает вследствие нарушений липидного обмена, характеризующихся отложением холестерина (ХС) в интиме сосудов. Установлено, что развитие ИБС, как и любого полигенного мультифакториального заболевания, детерминировано сложным взаимодействием средовых и генетических факторов [2]. За последние годы генетические исследования представили данные о широком спектре полиморфных вариантов генов – т.н. однонуклеотидных полиморфизмов (SNP), вносящих вклад в патогенез ИБС в различных популяциях мира. В частности, общее число обнаруженных ассоциаций уже в 2015 году превышало 15000, из них более сотни локусов, контролирующих уровни липидов и липопротеидов сыворотки крови, многие из которых показали ассоциации с ишемической болезнью сердца [3, 4, 5]. В то же время масштабных генетических исследований по валидации результатов GWAS генов-регуляторов липидного обмена и ИБС в российских популяциях до настоящего времени не проводилось. Исследование связи генетических маркеров с патогенезом и клиническими проявлениями ИБС становится все более актуальным в аспекте трансляции результатов GWAS в клиническую практику с целью улучшения качества ранней диагностики болезни и разработки подходов к персонализированной терапии и профилактике заболевания [6]. Однако вопрос о прямой экстраполяции результатов крупных международных исследований в клиническую практику в отдельно взятых регионах мира, в частности в российской популяции на данный момент остается открытым в связи с потенциальной генетической гетерогенностью болезни в различных популяциях мира [7, 8].
Цель исследования. Анализ ассоциации полиморфного варианта rs12328675 гена COBLL1 – генетического маркера, в отношении которого установлена связь с метаболизмом холестерина в ходе GWAS, с показателями липидного обмена и толщиной комплекса интима-медиа сонных артерий, и риском развития ишемической болезни сердца у жителей Центральной России.
Материалы и методы исследования. Материалом для исследования послужили образцы геномной ДНК биобанка Научно-исследовательского института генетической и молекулярной эпидемиологии Курского государственного медицинского университета (N=1340), собранные ранее в рамках проведенных генетико-эпидемиологических исследований мультифакториальных заболеваний [9, 10, 11]. Полученные от неродственных индивидов славянского происхождения уроженцев Центральной России (преимущественно г. Курска и Курской области). Основная выборка включала 719 больного ишемической болезнью сердца, которые находились на стационарном лечении в кардиологическом отделении, отделении сосудистой хирургии и рентгенохирургических методов диагностики областной клинической больницы (БМУ КОКБ), кардиологическом отделении больницы скорой медицинской помощи (ОБУЗ КГКБ СМП) г. Курска. Диагноз ИБС устанавливался квалифицированными врачами-кардиологами на основании результатов клинического и лабораторно-инструментального обследования (данные суточного мониторирования ЭКГ, коронарографии). Контрольная группа (N=621) формировалась во время проведения профессиональных медицинских осмотров, из числа медперсонала и пациентов лечебно-профилактических учреждений, не страдающих хроническими заболеваниями, сотрудников образовательных и других учреждений г. Курска за аналогичный период времени. Группы больных ИБС и контроля не отличались друг от друга, как по полу, так и по возрасту (P>0,05).
Толщина комплекса интима-медиа (ТИМ) сонных артерий была измерена ультразвуковым диагностическим сканером MyLab™40 («Esaote», Голландия) на расстоянии 1–1,5 см проксимальнее бифуркации по задней стенке. Для оценки показателей липидного обмена использовалась венозная кровь, взятая натощак. Оценивались следующие показатели липидного обмена в сыворотке крови: общий холестерин (ОХС), холестерин липопротеидов низкой плотности (Х-ЛПНП), холестерин липопротеидов высокой плотности (Х-ЛПВП) и триглицериды (ТГ). Для определения уровня липидов крови использовали наборы реагентов «Analitycon» и «Roche Diagnostics» (Германия). Выделение геномной ДНК проводилось стандартным двухэтапным методом фенольно-хлороформной экстракции и преципитации этанолом. Генотипирование rs12328675 гена COBLL1 проводилось путем мультиплексного генотипирования SNPs на генетическом анализаторе MALDI-TOF MassARRAY-4 производства Agena Bioscience (США).
Сопоставление частоты минорного аллеля rs12328675 гена COBLL1 между европейской популяцией и популяцией жителей Центральной России проводилось с помощью критерия χ2 (хи-квадрат) с использованием референсных данных проекта «1000 геномов» (https://www.ensembl.org). Тест Колмогорова-Смирнова использовался для оценки соответствия липидных показателей и ТИМ нормальному распределению. Ассоциации аллелей и генотипов с риском развития ИБС оценивались по показателю отношения шансов (OR) и 95% доверительных интервалов (95% CI) методом множественной логистической регрессии с коррекцией по полу, возрасту и индексу массы тела (ИМТ). Фенотипические эффекты rs12328675 гена COBLL1 на показатели липидного обмена и ТИМ оценивались методом линейного регрессионного анализа. Статистический анализ проводился с помощью программы SNPStats. (http://bioinfo.iconcologia.net/snpstats/start.htm). Для функционального аннотирования rs12328675 гена COBLL1 и оценки его регуляторного потенциала использовались различные биоинформатических инструменты и интернет-ресурсы: rSNPbase 3.0 (http://rsnp.psych.ac.cn), представляющая информацию по регуляторным SNPs, портал GTEx (GTEx portal, https://gtexportal.org) по тканеспецифической экспрессии и регуляции генов, atSNP (http://atsnp.biostat.wisc.edu) для оценки аффинности влияния аллельных вариантов SNPs на связывающую способность транскрипционных факторов (ТФ). Эффекты ТФ на генную экспрессию оценивали посредством анализа генных онтологий по категории «молекулярная функция» с использованием интернет-ресурса Gene Ontology (http://geneontology.org) и базы данных Uniprot (https://www.uniprot.org).
Результаты и их обсуждение. Тестирование частот генотипов на соответствие равновесию Харди-Вайнберга (РХВ) позволило установить их статистически значимое отклонение от РХВ (P <0,0001), которое связано со снижением уровня наблюдаемой гетерозиготности (Hobs=0,162) относительно ее ожидаемого значения (Hexp=0,275). Частоты минорного аллеля rs12328675-С гена COBLL1 в популяциях жителей Центральной России составило 0.165, тогда как в популяциях Европы это значение составило 0,157 (P=0,68), что указывает на отсутствие различий в частоте минорного аллеля между популяциями. Проведен анализ ассоциации аллелей и генотипов rs12328675 гена COBLL1 с риском развития ишемической болезни сердца, результаты которого представлены в таблице 1. Установлено, что генотип rs12328675-C/C гена COBLL1 ассоциирован с повышенным риском развития ИБС, в то время как генотип rs12328675-T/C. наоборот, был связан с пониженным риском развития болезни.
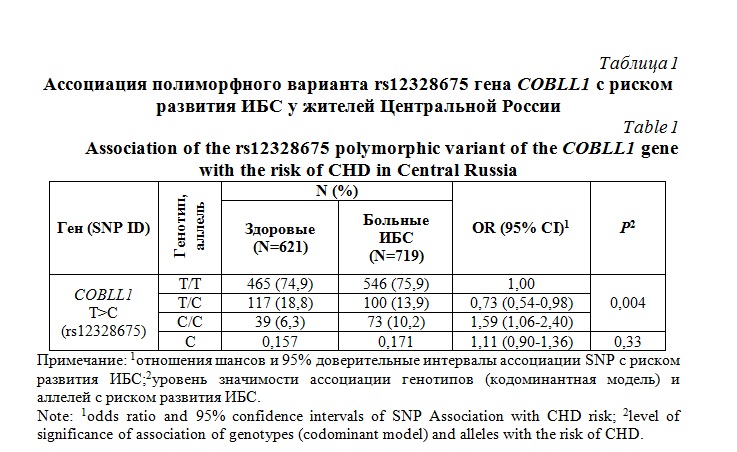
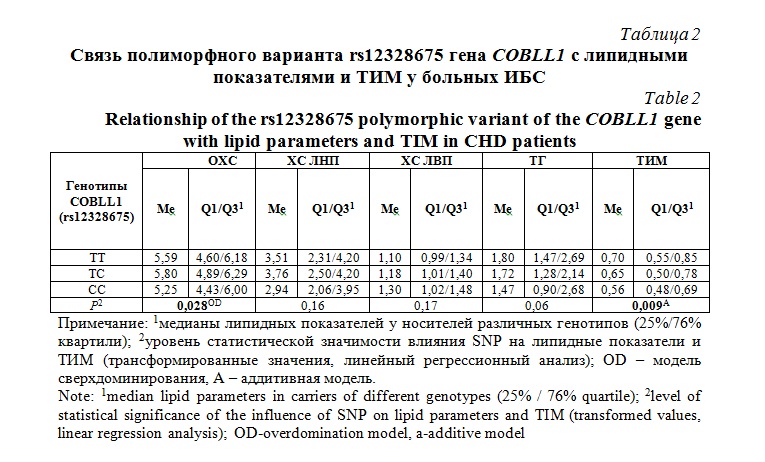
Было оценено влияние SNP rs12328675 гена COBLL1 на уровни липидов плазмы крови и ТИМ у больных ИБС. Предварительно каждый липидный показатель и ТИМ был оценен на предмет нормальности распределения с помощью теста Колмогорова-Смирнова. Оказалось, что все исследуемые количественные показатели являются ненормальными признаками (P<0,05), в связи с чем данные переменные в таблице 2 были представлены в виде медиан (Me) и интерквартильных размахов (Q1/Q3). Для оценки влияния SNP rs12328675 гена COBLL1, данные показатели подверглись нормализации для последующего применения линейного регрессионного анализа. Как видно из таблицы 2, rs12328675 гена COBLL1 был статистически значимо ассоциирован с уровнем общего холестерина крови (P=0,028, эффект сверхдоминирования). Причем у курильщиков носителей генотипа rs12328675-T/C наблюдалось более выраженное увеличение уровня холестерина крови. Кроме того, наблюдалась тенденция в ассоциации SNP rs12328675 с уровнем триглицеридов крови (P=0,08). Также было установлено, что данный полиморфизм связан с толщиной комплекса интима-медиа сонных артерий (P=0,009, аддитивный эффект).
Биоинформатический анализ позволил охарактеризовать функциональную значимость SNP rs12328675 гена COBLL1. В частности, использование геномно-транскрптомных данных портала GTEx позволило обнаружить статистически значимый eQTL (expression Quantitative Trait Locus). Так один cis-eQTL для SNP rs12328675 (P=0,008) был обнаружен в коронарных артериях, указывая на то, что продукт гена COBLL1 может быть причастным к формированию атеросклеротических поражений коронарных артерий аорты. Другой eQTL (trans-eQTL) в миокарде предсердия сердца ассоциирован с изменением экспрессии гена GRB14 (P=0,0001). Этот ген кодирует белок, связывающий рецептор фактора роста, который взаимодействует с рецепторами инсулина и рецепторами инсулиноподобного фактора роста [12]. Наличие trans-eQTL для SNP rs12328675 может свидетельствовать о потенциальной ко-экспрессии генов COBLL1 и GRB14 посредством каких-то общих регуляторных механизмов, в частности под влиянием общих транскрипционных факторов. Согласно данным портала rSNPBase SNP rs12328675 имеет регуляторный потенциал и находится в неравновесии по сцеплению еще с тремя регуляторными SNPs (http://rsnp.psych.ac.cn). Кроме того, регион rs12328675 попадает в область связывания с циркуляторной РНК (circRNA).
С целью выявления участков связывания для ТФ в области SNP rs12328675 нами был применен онлайн инструмент atSNP (http://atsnp.biostat.wisc.edu), позволяющий оценивать аффинность влияния ДНК-последовательностей, охватывающей SNP, на связывание регуляторного ТФ. В результате нами были установлены ТФ (8 ТФ loss-off-function, 10 ТФ gain off-function), способные связываться с участком SNP rs12328675 гена COBLL1 (P<0,01). В отношении следующих ТФ-активаторов выявлены участки связывания в области SNP rs12328675: AP1, JUN, POU2F1, RARB, RBPJ и комплекс SMAD2::SMAD3::SMAD4 (при наличии аллеля C) и POU1F1, RUNX1, SOX8, TBP (при наличии аллеля T). В отношении ТФ двойного действия (активаторов-репрессоров) выявлены участки связывания в области изучаемого SNP: FOXA2 и GATA3 (при наличии аллеля T) и E2F8, TFAP2C, BACH2 (при наличии аллеля C). В отношении ТФ-репрессора выявлены участки связывания в области SNP rs12328675 для MYEF2 и NFIL3 (при наличии аллеля T). Кроме того, выявлен участок связывания для SOAT1 (при наличии аллеля C), эффект которого на транскрипцию гена не известен.
COBLL1 (cordon-bleu protein-like) – ген, кодирующий белок, который обнаружен в клетках всех типов тканей. Функции гена не изучены до конца, но ему отводится роль в реорганизации актинового цитоскелета и регуляции морфогенеза нейронов. Полиморфизм T>C (rs12328675) расположен в 3 нетранслируемой части гена COBLL1. Из литературы известно, что rs12328675 связан с повышением уровня холестерина ЛПВП и триглицеридов крови в европейской популяции [5]. Кроме того, полиморфные варианты гена COBLL1 ассоциированы с различными фенотипами, включая индекс массы тела [12], отношение талии-бедра, уровень ХС-ЛВП [5], уровень ТГ, каждый из которых представляет собой фактор риска ИБС.
В результате нашего исследования показано, что аллель rs12328675-C гена COBLL1, ассоциированный с повышенным риском развития ИБС, создает участки связывания для ТФ-активаторов транскрипции, среди которых наибольший интерес представляют: AP-1 (или JUN), RARB (UniProtKB - P10826), RBPJ (UniProtKB - P10826), а также комплекс белков SMAD2 (UniProtKB - Q15796), SMAD3 (UniProtKB - P84022) и SMAD4 (UniProtKB - Q13485). Так, транскрипционный фактор AP-1 (UniProtKB - P05412) вовлечен в модуляцию воспаления, в том числе артериальных сосудов, и играет роль в развитии атеросклероза (Meijer et al, 2012). Подавление ретиноидных рецепторов, одним из которых является RARB, может угнетать абсорбцию холестерина в кишечнике и воспалительные процессы. RBPJ известен как активатор воспаления посредством привлечения лейкоцитов в очаг воспаления [13, 14]. Белки SMAD являются внутриклеточными сигнальными молекулами, опосредующими эффекты трансформирующего фактора роста, который играет важную роль в развитии атеросклероза [15, 16]. E2F8 (UniProtKB - A0AVK6) является ТФ двойного действия (чаще репрессор), но способен действовать в качестве активатора экспрессии генов, вовлеченных в ангиогенез: он связывается с HIF1A, распознает и связывается с промотор гена VEGFA и активирует его экспрессию [17]. SOAT1 (UniProtKB - P35610), или стерол O-ацилтрансфераза 1 с неизвестной молекулярной функцией в отношении влияния на транскрипцию генов, также обладала потенциалом связывания с «проатерогенным аллелем» С SNP rs12328675. SOAT1 катализирует образование сложных эфиров жирных кислот и холестерина, которые менее растворимы в мембранах, чем холестерин, а также играет роль в сборке липопротеинов и абсорбции холестерина [18]. Установлено, что дефицит SOAT1 связан с развитием атеросклероза посредством вовлеченности в транспорт холестерина и воспаление [19, 20].
Заключение. Таким образом, в результате исследования установлено, что у жителей Центральной России полиморфный вариант rs12328675 гена COBLL1 ассоциирован с развитием ишемической болезни сердца, а также с толщиной комплекса интима-медиа сонных артерий ТИМ и общим холестерином крови. Также установлено, что курение является фактором риска, потенцирующим проатерогенный эффект данного SNP генов на уровень общего холестерина крови. Согласно данным проведенного нами in silico анализа данный полиморфизм характеризуется регуляторным потенциалом. В частности, посредством связывания различных транскрипционных факторов может модулироваться экспрессия гена COBLL1 в сердечной мышце и коронарных артериях, что может иметь патогенетическое значение для развития ишемической болезни сердца. Однако для более глубокого понимания вклада данного гена в развитие коронарного атеросклероза и последующего клинического использования его полиморфных локусов необходимо проведение экспериментальных исследований по функциональной оценке SNPs на транскрипционном и биохимическом уровнях.





















Список литературы