Изучение нейротективных свойств агониста MGLUR4 рецепторов – ZC64-0001 в сравнении с Мексидолом
Aннотация
Актуальность: Одним из самых распространённых нейродегенеративных заболеваний является болезнь Паркинсона, которая основывается на дегенерации дофаминергических нейронов черной субстанции. Современное лечение болезни Паркинсона заключается в дофаминзаместительной терапии леводопой, применение которой не приводит к остановке, прогрессирующей нейродегенерации и вызывает появление побочных эффектов. Метаботропные рецепторы глутамата (mGluRs) являются перспективной точкой приложения для поиска новых антипаркинсонических препаратов. Метаботропные рецепторы III группы способны снижать активность NMDA-рецепторов, участвующих в регуляции уровня кальция в клетках. Поэтому предположено, что активация этих рецепторов может иметь нейропротективное влияние. В ЦВТ «ХимРар» синтезирован агонист mGluR4 рецепторов. Дальнейшие исследования субстанции проводились в НИИ «Фармакология живых систем» НИУ БелГУ (г. Белгород). Цель исследования: Изучить нейропротективную эффективность фармацевтической субстанции – ZC64-0001 в сравнении с Мексидолом на мышах с ишемией головного мозга. Материалы и методы: Исследование проводилось на крысах, разделенных на 9 групп по 10 особей. Исследуемую субстанцию ZC64-0001 и препарат сравнения Мексидол вводили внутрижелудочно один раз в день в профилактических и лечебных целях в различных дозировках. Затем оценивали поведенческие реакции животных до моделирования ИГМ и на 2, 7 и 14 сутки после; уровень S100b и NSE после ИГМ. Результаты: В ходе исследования получено, что использование ZC64-0001 и Мексидола в мсследуемых дозах, оказывало выраженное нейропротекторное действие, выражающееся в уменьшении выраженности неврологического дефицита; и ускорении исчезновения симптомов паралича, птоза и т. д. Одновременно обнаруженно улучшение показателей двигательной активности в ПЛК и тесте актиметрии, а так же значительное предотвращение повышения значений NSE и белка S100b. Заключение: Нейропротективный эффекта агониста mGluR4 рецепторов объясняется их способностью снижать активность NMDA-рецептора и, следовательно, риск эксайтотоксичности.
Введение. Одним из самых распространённых нейродегенеративных заболеваний во всем мире является болезнь Паркинсона, которая характеризуется мышечной ригидностью, тремором, гипокинезией и постуральной неустойчивостью [1]. В основе развития болезни Паркинсона лежит дегенерация дофаминергических нейронов черной субстанции, в следствии чего больные теряют способность координировать свои движения [2]. Лечение болезни Паркинсона заключается в дофаминзаместительной терапии леводопой (L-допа), применение которой не приводит к остановке, прогрессирующей нейродегенерации, а также вызывает появление нежелательных побочных эффектов [3]. Поэтому поиск новых антипаркинсонических средств, позволяющих отсрочить применение Леводопы, является весьма актуальной проблемой фармакологии. Одной из перспективных точек приложения для поиска новых противопаркинсонических препаратов являются метаботропные рецепторы глутамата (mGluRs). По литературным данным известно, что воздействие на эту группу рецепторов позволяет модулировать нейротрансмиссию в базальных ганглиях [4]. Метаботропные рецепторы III группы – mGluR4 способны снижать активность NMDA – рецепторов, чрезмерная активность которых приводит к смерти нервных клеток (феномен эксайтотоксичности) [5]. МGluR III рецепторы расположены на пресинаптических мембранах глутаматергических и ГАМК-эргических нейронов, а значит способны контролировать выделение глутамата и снижать глутаматергическую передачу [6]. Поэтому предположено, что активация этих рецепторов может иметь нейропротективное влияние.
В ЦВТ «ХимРар» синтезировано вещество, являющееся агонистом mGluR4 рецепторов под кодовым шифром – ZC64-0001. Доклинические исследования фармакологической субстанции ZC64-0001 проводились в НИИ «Фармакология живых систем» НИУ БелГУ (г. Белгород).
Цель исследования. Изучить нейропротективную эффективность фармацевтической субстанции – ZC64-0001 в сравнении с Мексидолом на мышах с 4-х минутной, 4-сосудистой ишемией головного мозга.
Материалы и методы исследования. Животные: в исследование было включено 90 крыс линии Wistar, 12-14 недельного возраста, массой 180-220 г., полученных из питомника лабораторных животных «Филиала Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова» г. Пущино. Животные были разделены на 9 групп по 10 особей. Животных содержали в стандартных условиях, в соответствии с правилами лабораторной практики при проведении доклинических исследований на территории России и санитарными правилами СП 2.2.1.3218-14 «Санитарно-эпидемиологическими требованиями к устройству, оборудованию и содержанию эксперементально-биологических клиник (вивариев)» от 29.08.2014г. № 51. и ГОСТ 33215-2014.
Дизайн исследования: фармацевтическую субстанцию ZC64-0001 и препарат сравнения Мексидол вводили в исследуемых дозировках внутрижелудочно один раз в день в профилактических и лечебных целях. В профилактических целях исследуемое вещество и препарат сравнения вводили за 30 минут до моделирования ишемии головного мозга (ИГМ) в следующих дозировках: Мексидол – 100 мг/кг, Мексидол – 200 мг/кг, ZC64-0001 – 3 мг/кг, ZC64-0001 – 10 мг/кг, Мексидол – 100 мг/кг + ZC64-0001 3 мг/кг. При лечебном введении препараты вводили за 30 минут до моделирования ИГМ и далее ежедневно в течение 14 дней в следующих дозировках: ZC64-0001 – 10 мг/кг, Мексидол – 200 мг/кг, ZC64-0001 – 3 мг/кг + Мексидол – 100 мг/кг. Животным контрольной группы исследуемые вещества не вводились. До моделирования ИГМ и на 2, 7 и 14 сутки после, оценивали поведенческие реакции и степень неврологического дефицита у исследуемых животных. На 3 сутки после моделирования ишемии головного мозга (ИГМ) определяли уровень S100b и NSE.
Исследование выполнялось в соответствии с методическими рекомендациями по доклиническому изучению лекарственных средств для лечения нарушений мозгового кровообращения и мигрени [7]. Нейропротективный эффект ZC64-0001 изучали на модели экспериментальной четырехсосудистой, четырехминутной ишемии головного мозга.
Для оценки нейропротективной эффективности изучаемых веществ использовали следующие методики:
Балльная шкала оценки инсульта McGraw в модификации И.В. Ганнушкиной [8].
«Приподнятый крестообразный лабиринт» (Panlab Harvard Apparaturs LE 846): в течение трех минут регистрировали и оценивали суммарное время нахождения в открытых и закрытых рукавах, количество стоек и свисаний.
«Инфракрасный монитор активности» (IR Actimeter – Panlab Harvard Apparaturs LE 8825): регистрировали общую активность животных, стереотипность движений, максимальную скорость, общую пройденную дистанцию и время отдыха.
Определяли маркеры повреждения головного мозга S100b и NSE в сыворотке крови животных, повышение которых позволяет выявить и оценить степень повреждения головного мозга. В связи с тем, что оптимальная концентрация S100b и NSE наблюдается во временном промежутке с 24 часов до 72 часов, кровь брали на 3-и сутки от моделирования патологии.
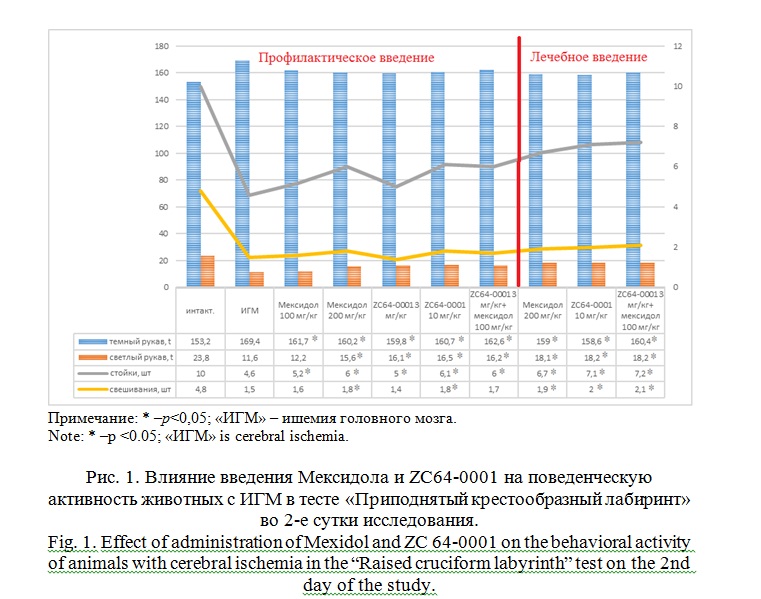
Результаты и их обсуждение. В контрольную группу включались животные с ИГМ, у которых в первые сутки наблюдался неврологический дефицит средней степени тяжести (2-3 балла) по шкале McGraw в модификации И.В. Ганнушкиной. У крыс с профилактическим и лечебным введением исследуемых препаратов, в первые сутки после моделирования ИГМ регистрировались достоверно более низкие значения неврологического дефицита. Как видно из рисунка 1, в группе животных, получающих ZC64-0001 в дозе 10 мг/кг в профилактических целях, неврологический дефицит составлял от 1,1 до 2. Через 72 часа после моделирования ИГМ показатели неврологического дефицита в группах c профилактическим введением исследуемых соединений были близки и достоверно отличались от контрольной группы, за исключением группы, которой вводили Мексидол в дозе 100 мг/кг. В группах с лечебным введением исследуемых соединений к 3 суткам показатели были несколько ниже, чем в группах с профилактическим введением и также достоверно отличались от контрольной группы. На 14 сутки в группе с лечебным введением ZC64-0001 3 мг/кг + Мексидола 100 мг/кг наблюдается достоверное снижение неврологического дефицита, тогда как в других группах достоверных различий не было.
В тесте «приподнятый крестообразный лабиринт» (ПЛК) обращает на себя внимание, что на 2 сутки эксперимента во всех исследуемых группах наблюдается статистически значимое снижение времени пребывания в тёмном рукаве ПЛК, увеличение времени пребывания животных в светлом рукаве ПЛК, увеличение количества стоек. Как видно из рисунка 1 количество свешиваний в ПЛК достоверно увеличивалось на 2 сутки эксперимента в группах с профилактическим введением ZC64-0001 в дозе 10 мг/кг, Мексидола в дозе 200 мг/кг и во всех группах с лечебным введением препаратов в исследуемых дозах по сравнению с данными контрольной группы. К 7-ым и 14-ым суткам также наблюдается статистически значимое улучшение всех изучаемых параметров во всех группах профилактического и лечебного введения препаратов по сравнению с контрольной группой.
Также в ходе эксперимента регистрируется статистически значимое увеличение активности крыс всех групп в тесте актиметрии на инфракрасном мониторе активности, по сравнению с животными из контрольной группы. Например, в группе с профилактическим введением ZC64-0001 в дозе 10 мг/кг показатель общей активности составил на 7-ые сутки исследования – 443±23,32 (p<0,05), а в контрольной группе – 414,56±25,87. Исключение составляет лишь максимальная скорость движения, которая статистически значимо увеличивается только в группах с лечебным введением исследуемых препаратов.
При оценке уровня маркеров повреждения головного мозга в экспериментальных группах с введением ZC64-0001 и Мексидола в профилактических и лечебных целях наблюдали повышение концентрации NSE и S100b в сыворотке крови.
Как видно из рисунка 2 уровень S100b и NSE у животных всех групп выше уровня интактных крыс (p>0,05). Значения S100b достоверно ниже у животных всех экспериментальных групп по сравнению с данными контрольной группы (ИГМ) (р<0,05), тогда как уровень NSE достоверно ниже только в группах с лечебным введением исследуемых соединений.

Таким образом, профилактическое внутрибрюшинное использование ZC64-0001 (3 и 10 мг/кг) и нейропротектора Мексидол (100 и 200 мг/кг) оказывало выраженное нейропротекторное действие, выражающееся в уменьшении выраженности неврологического дефицита; и ускорении исчезновения симптомов паралича, птоза и т. д. Одновременно обнаруженно улучшение показателей двигательной активности в ПЛК и тесте актиметрии, а так же значительное предотвращение повышения значений NSE и белка S100b в сыворотке крови. Лечебное применение ZC64-0001 (10 мг/кг) и нейропротектора Мексидол (200 мг/кг) в виде ежедневного внутрибрюшинного введения оказывало более выраженный нейропротективное действие в отношении неврологического дефицита, двигательной активности и маркеров повреждения.
Обращает на себя внимание, что оба препарата оказывали дозозависимое действие, а эффективность сочетанного использования малых доз (ZC64-0001 – 3 мг/кг + Мексидол 100 мг/кг) оказалось сопоставимо с эффектами максимальных изучаемых доз в виде монотерапии.
Для обоснования нейропротективного эффекта агониста mGluR4 рецепторов – ZC64-0001 необходимо понять патогенез нейродегенеративных процессов. При появлении очага некроза в ишемизированном мозге запускается глутамат-кальциевый каскад (эксайтотоксичность), который проявляется нарастанием концентрации глутамата в межклеточном пространстве и накоплением ионов кальция внутри клетки [9, 10]. Эти процессы после определенных биохимических реакций приводят к некротической смерти нейронов. Ионы кальция поступают внутрь клетки через кальциевые каналы, которые находятся под контролем NMDA-рецепторов [11, 12]. Метаботропные рецепторы III группы, в частности mGluR4 рецепторы снижают активность NMDA-рецептора и, следовательно, риск эксайтотоксичности [13]. Таким образом активация этого подвида рецепторов приводит снижению процессов нейродегенерации.
Выводы:
- ZC64-0001 (3 и 10 мг/кг), как и Мексидол (100 и 200 мг/кг) оказывают нейропротективную дозазависимую активность, улучшении показателей двигательной активности в ПЛК и тесте актиметрии, а также предотвращение повышения значений нейронспецифической енолазы и белка S100b в сыворотке крови.
- Сочетанное применение малых доз (ZC64-0001 – 3 мг/кг + Мексидол 100 мг/кг) оказалось сопоставимо с эффектами максимальных изучаемых доз в виде монотерапии, а лечебное применение ZC64-0001 (10 мг/кг) и Мексидола (200 мг/кг) оказывало более выраженное нейропротективное действие.




















Список литературы