Исследование церебропротективных свойств препарата «Мексидол» на модели пневмококкового бактериального менингита в экспериментальных условиях
Aннотация
Актуальность: Пневмококковый менингит является тяжелым инфекционным заболеванием, которое отличается высокой летальностью и частым развитием резидуальных неврологических повреждений. Эффективная церебропротекция может улучшить исход при бактериальном гнойном менингите. Цель исследования: Оценить церебропротективные свойства препарата «Мексидол» при бактериальном гнойном менингите на модели пневмоккового менингита в условиях эксперимента. Материалы и методы: Оценку церебропротективных свойств препарата «Мексидол» проводили на модели бактериального пневмоккового менингита у крыс линии Wistar. Менингит моделировали путем введения в субарахноидальное пространство суспензии, содержащей S. pneumoniae в концентрации 5*109 КОЕ/мл. Церебропротективный эффект оценивали по показателям летальности, степени неврологического дефицита, ориентировочно-поведенческой активности, результатам тестирования на кратковременную и долговременную память. Результаты: В группах, получавших препарат «Мексидол» в дозах 15 мг/кг и 7,5 мг/кг, летальность была меньше по сравнению с контрольной группой на 15 %. Крысы, получавшие «Мексидол» в дозе 15 мг/кг, имели более высокую клиническую оценку состояния здоровья в первые и на пятые сутки наблюдения по сравнению с животными из группы контроля (p<0,05). Животные, получавшие «Мексидол» в дозе 15 мг/кг, имели меньшую степень неврологического дефицита на 1-е, 5-е и 8-е сутки после моделирования патологии по сравнению с контрольной группой (p<0,05). Удельная сила крыс, получавших «Мексидол» в дозе 15 мг/кг, была выше по сравнению с контрольной группой (p<0,05). При сравнении двигательной активности животных контрольной группы с группой, получавшей «Мексидол» в дозе 15 мг/кг, на 1-е и 10-е сутки после моделирования пневмококкового менингита в тесте актиметрии на инфракрасном мониторе активности IR Actimeter, установлено, что активность крыс в данной группе была выше относительно контрольной группы (p<0,05). Индекс распознавания приоценки кратковременной и долговременной памяти у крыс, получавших «Мексидол» в дозе 15 мг/кг, был достоверно выше по сравнению с группой контроля (p<0,05). Заключение: В ходе эксперимента было выявлено, что препарат «Мексидол» в дозе 15 мг/кг обладает церебропротективным действием на модели бактериального пневмококкового менингита
Введение. Пневмококковый менингит относится к тяжелым инфекционным заболеваниям, развивающимся в результате преодоления S. pneumoniaeгематоэнцефалического барьера. Патологический процесс развивается в мягких мозговых оболочках основания головного мозга и верхней части спинного мозга, сосудистых сплетениях в области желудочков с формированием очагов гнойного воспаления. Клинически заболевание проявляется интокcикационым, общемозговым и менингеальным синдромами. При вовлечении в инфекционный процесс вещества головного мозга присоединяется очаговая симптоматика.
Несмотря на введение программ вакцинации от пневмококковых инфекций, заболеваемость пневмококковым менингитом остается на достаточно высоком уровне. S. pneumoniae является одним из ведущих возбудителей бактериальных менингитов в РФ и составляет в среднем 22,1% (2010-2014 гг.), уступая только менингококкам (52,2%) [1, 2].Следует учесть, что в РФпневмококковый менингит не входит в число заболеваний, подлежащих официальной регистрации. А частота бактериологического подтверждения данного диагноза в РФ варьирует от 16 до 38% [3-8]. Поэтому истинные показатели заболеваемости и смертности, а также многие важные аспекты патогенеза, клиники и лечения недостаточно изучены [9, 10].
Самый высокий показатель заболеваемости пневмококковыми менингитами характерен для детей от 0 до 4 лет и составляет 10 на 100 тыс. детей. Взрослые болеют пневмокковыми менингитами реже, показатель заболеваемости 1-2,5 на 100 тыс. населения в год. Максимальная заболеваемость среди взрослого населения приходится на возраст от 45 до 64 лет. Летальность при пневмококковом менингите доходит до 30%. Мужчины болеют чаще, чем женщины [2, 3, 11].
Летальность при пневмококковом менингите в РФ в 2015 году составила 0,04 на 100 тыс. населения [1]. В возрастной структуре летальных исходов основная доля приходится на возрастную группу старше 45 лет, из них 29% – лица 45-64 лет; 30%– старше 65 лет [1, 3].
Пневмококковый менингит обычно не имеет широкого эпидемического распространения и, как правило, развивается у лиц с ослабленной иммунной защитой на фоне уже имеющейся пневмококковой инфекции (синуситы, средние отиты, пневмонии и т.п.) [4].
Выжившие пациенты после пневмококкового менингита чаще, чем после принесённых других типов бактериального менингита, имеют неврологические и другие серьезные осложнения [12-15]. Метаанализ показал, что 32% пациентов с перенесенным пневмококковым менингитом имели осложнения [16]. Патофизиологические механизмы, приводящие к неврологическим повреждениям у больных бактериальным менингитом, сложны и многогранны, обусловлены секрецией мощных бактериальных токсинов и избыточными иммунными реакциями хозяина против инвазирующих пневмококков в спинномозговой жидкости[17-19].
Комплексное лечение бактериального пневмококкового менингита включает этиотропную антибактериальную терапию, адьювантную гормональную терапию, симптоматическую терапию и нейропротективную терапию.
Этилметилгидроксипиридинсукцинат является антиоксидантом, обладает антигипоксическим, мембранопротекторным, ноотропным, противосудорожным и анксиолитическим эффектами. Является основным компонентом таких препаратов, как Мексидол, Мексикор, Мексиприм, Медомексин, Нейрокс. Механизм действия этилметилгидроксипиридинсукцината обусловлен его анигипоксическим, антиоксидантным и мембраностабилизирующим действием. Препарат модулирует активность мембраносвязанных ферментов (кальций-независимой фосфодиэстеразы, аденилатциклазы, ацетилхолинэстеразы), рецепторных комплексов (бензодиазепинового, ГАМК, ацетилхолинового), что усиливает их способность связывания с лигандами, способствует сохранению структурно-функциональной организации биомембран, транспорта нейромедиаторов и улучшению синаптической передачи. Повышает концентрацию дофамина в головном мозге. Этилметилгидроксипиридинсукцинат усиливает компенсаторную активацию аэробного гликолиза и снижает степень угнетения окислительных процессов в цикле Кребса в условиях гипоксии с увеличением содержания креатинфосфата и АТФ, способствует активации энергосинтезирующих функций митохондрий [20].
Цель исследования. Исследование церебропротективных свойств препарата «Мексидол» на модели пневмококкового бактериального менингита в экспериментальных условиях.
Материалы и методы исследования. В экспериментальном исследовании участвовали 50 крыс-самок линии Wistar, массой 230-260 г. В каждой группе было по 10 крыс. Первая группа – интактые животные, вторая – контрольная группа с моделированным пневмококковым менингитом, получавшая только антибактериальную терапию цефтриаксоном; третья – группа с моделированным пневмококковым менингитом, получавшая в качестве лечения цефтриаксон и «Мексидол» в дозе 15 мг/кг;четвертая– группа с моделированным пневмококковым менингитом, получавшая в качестве лечения цефтриаксон и «Мексидол» в дозе 7,5 мг/кг; пятая – группа с моделированным пневмококковым менингитом, получавшая в качестве лечения цефтриаксон и «Мексидол» в дозе 3,75 мг/кг. Животные содержались в стандартных условиях вивария НИУ «БелГУ» со свободным доступом к еде и воде. Содержание животных и постановка эксперимента проводилась в соответствии с требованием приказов № 1179 МЗ СССР от 11.10.1983 г. и №267 РФ от 19.06.2003 г., а также международным правилам «Guide for the Careand of Laboratory Animals». Все манипуляции с животными проводились в условиях наркоза (золетил 60 мг/кг и Хлоралгидрат 160 мг/кг внутрибрюшинно).
Подготовка культуры микроорганизмов. Streptococcus pneumoniae (серотип 3), культивировали в течение ночи в 10 мл бульона Тодда-Хьюита, затем разбавляли свежим раствором и выращивали до логарифмической фазы. Культуру центрифугировали 10 минут со скоростью 5000 оборотов и суспендировали в стерильном физиологическом растворе до концентрации 5*109 КОЕ/мл. Размер инокуляции был подтвержден количественными культурами.
Пневмококковый менингит моделировали следующим образом. С зоны доступа удаляли волосяной покров с помощью депиляционного крема. Была проведена антисептическая обработка места предполагаемой пункции. Животное располагали в положении лежа и наклоняли голову вниз приблизительно под углом 45, так чтобы визуализировалась ромбовидная ямка, между затылочным бугром и атлантом. Пункцию субарахноидального пространства производили с помощью 23-G иглы, держа крысу одной рукой за тазовый пояс. Для индукции менингита вводили 10 мкл суспензии, содержащей 3 серотип S. pneumoniae в концентрации 5*109 КОЕ/мл. Затем животных возвращали в свои клетки. Через восемнадцать часов развитие менингита было подтверждено количественной культурой 5 мклCМЖ, которая была получена путем пункции субарахноидального пространства. Лечение начинали через 18 часов. Животные получали цефтриаксон (100 мг/кг массы тела) внутримышечно в течение 7 дней. Через 10 дней животные были свободны от инфекции. Отсутствие инфекции подтверждали пункцией субарахноидального пространства на 10-е сутки и последующим отрицательным результатом бак посева СМЖ. Этилметилгидроксипиридинсукцинат (препарат «Мексидол») вводился внутримышечно через 7 часов после индукции менингита в указанных выше дозировках.
Каждые 24 часа, ежедневно, в течение десяти суток проводили клиническую оценку состояния здоровья крыс. Крыс взвешивали, и тяжесть заболевания оценивали клинически, используя следующую шкалу: 1 = кома; 2 = не поворачивается вертикально при позиционировании на спине; 3 = поворачивается вертикально в течение 30 с; 4 = минимальная амбулаторная активность, поворачивается вертикально в течение <5 с; и 5 = нормально.
Оценку степени неврологического дефицита проводили, используя шкалу оценкиневрологического дефицита при менингите, менингоэнцефалите (таблица 1).

Степень неврологического дефицита оценивали по общей сумме баллов. При этом 0 баллов свидетельствует о максимальной выраженности нарушений, а 21 балл – об их отсутствии.
С помощью устройства для оценки мышечной силы конечностей мелких лабораторных животных в эксперименте определяли удельную силу крыс.
Оценку ориентировочно-исследовательского поведения крыс проводили с помощью «Инфракрасного монитора активности». Оценивали общую активность, стереотипы движения, максимальную скорость, общую дистанцию, время отдыха в у.е., используя программное обеспечение ActiTrack. В эксперименте использовалась установка фирмы Panlab Harvard Apparaturs LE8825.
На 10-е сутки после индукции менингита проводили оценку когнитивных способностей крыс, использую тест «Задача распознавания объектов». Данный тест позволяет оценить пространственную память. Исследование было выполнено в открытом поле размерами 40 на 50 см, окруженном стенами высотой 50 см, изготовленными из фанеры с передней стеклянной стенкой. Черные линии разделили пол открытого поля на 12 равных прямоугольников. Все животные подвергались сеансу привыкания, в котором им разрешалось свободно исследовать свободное поле в течение 5 минут. Во время этого испытания не было помещено никаких предметов. После сеанса привыкания тренировка проводилась в разные моменты времени. Крыс, по одной, помещали на 5 минут в открытое поле, в котором находились 2 одинаковых предмета (объекты A1 и A2, оба куба). Предметы располагали в 2 смежных углах на расстоянии 10 см от стен.
В анализе кратковременной памяти распознавания объектов, который проводился через 1,5 часа после тренировки, крысы исследовали открытое поле в течение 5 минут в присутствии 1 знакомого объекта (A) и 1 нового объекта (B, пирамида с квадратным основанием). Индекс распознавания был рассчитан для каждого животного как отношение TB /(TA + TB); где TA - это время, затраченное на изучение знакомого объекта A и TB, – это время, потраченное на изучение нового объекта B.
Во время теста на долговременную память распознавания объектов, который проводился через 24 часа после тренировки, этим же крысам разрешалось исследовать открытое поле 5 минут в присутствии знакомого объекта А и нового объекта С (шар с квадратным основанием). Память распознавания оценивалась так же, как и в краткосрочном анализе памяти. Исследованием объекта считалось обнюхивание (исследование объекта с расстояния 3-5 см) или касание объекта носом и / или передними лапами. Все объекты, используемые в задаче, имели похожую текстуру (гладкие), цвет (синий), и размеры (вес, 150-200 г), но отличались по форме.
Результаты и их обсуждение. В группе интактных крыс летальность отсутствовала, в контрольной группе летальность за период наблюдения составила 40 % (рисунок 1). В группах, получавших препарат «Мексидол» в дозах 15 мг/кг и 7,5 мг/кг, летальность была меньше по сравнению с контрольной группой на 15 %. В группе, получавшей препарат «Мексидол» в дозе 3,75 мг/кг, степень летальности приближалась к аналогичному показателю в контрольной группе и составила 38%.

Крысы, получавшие «Мексидол» в дозе 15 мг/кг, имели более высокую клиническую оценку состояния здоровья в первые и на пятые сутки наблюдения по сравнению с животными из группы контроля (p<0,05) (таблица 2). Нормальная активность животных в данной группе восстанавливалась к 7-м суткам после моделирования патологии, в контрольной группе – к 8-м суткам. Но различия в группах были статистически не значимы. В группах, получавших «Мексидол» в дозе 7,5 мг/кг и 3,75 мг/кг, показатели мало отличались от показателей группы контроля. Более того, в контрольной группе крысы на 8 сутки после моделирования патологии имели среднюю оценку – 5 баллов. В группе, получавшей «Мексидол» в дозе 7,5 мг/кг, средняя оценка на 10-е сутки составила 4,5 балла. А в группе, получавшей «Мексидол» в дозе 3,75 мг/кг, на 9-е сутки средняя оценка равнялась 5 баллам.

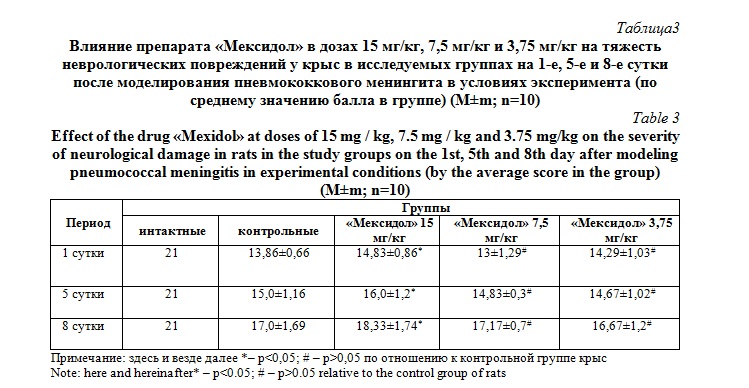
Крысы, получавшие «Мексидол» в дозе 15 мг/кг, имели меньшую степень неврологического дефицита на 1-е, 5-е и 8-е сутки после моделирования патологии по сравнению с контрольной группой (p<0,05) (таблица 3). В первые сутки неврологический дефицит в группе, получавшей «Мексидол» в дозе 15 мг/кг, был меньше на 0,97 балла, на 5-е сутки – 1 балл, на 8-е сутки – 1,33 балла. Степень неврологического дефицита в группах, получавших «Мексидол» в дозе 7,5 мг/кг и 3,75 мг/кг, практически не отличалась от степени неврологического дефицита группы контроля.
В контрольной группе удельная сила на 1-е, 5-е и 10-е сутки после развития менингита равнялась48,7%, 64% и 67,4% от исходных показателей удельной силы (таблица 4). В группе, получавшей «Мексидол» в дозе 15 мг/кг, удельная сила была выше по сравнению с контрольной группой (p<0,05). В 1-е сутки после моделирования патологии она составила 60% от исходной, на 5-е сутки – 68,2%, на 10-е сутки – 76,6%. Различия в группах на 1-е и 10-е сутки статистически значимы, на 5-е сутки – статистически не значимы. Крысы, получавшие «Мексидол» в дозе 7,5 мг/кг, имели удельную силу на 1-е и 5-е сутки после моделирования патологии аналогичную группе контроля. На 10-е сутки удельная сила в данной группе была выше 7,6% по сравнению с контрольной группой. Но различия в группах были статистически не значимы. У крыс, получавших « Мексидол» в дозе 3,75 мг/кг, показатели удельной силы несколько хуже по сравнению с группой контроля. Удельная сила в данной группе на 1-е, 5-е, 10-е сутки составила 49%, 62,5% и 65,9% от исходной, соответственно.

Присравнениидвигательнойактивностиживотныхконтрольнойгруппысгруппой,получавшей «Мексидол» в дозе 15 мг/кг, на 1-е и 10-е сутки после моделирования пневмококкового менингита в тесте актиметрии на инфракрасном мониторе активности IR Actimeter, установлено, что активность крыс в данной группе была выше относительно контрольной группы (p<0,05) (таблицы 5, 6). Данная группа животных более активная, развивает большую скорость, проходит значительно более длинную дистанцию. Времяотдыха в этойгруппениже, в сравнениис контролем. В группах, получавших «Мексидол» в дозах 7,5 мг/кг и 3,75 мг/кг, статистически значимых отличий по сравнению с группой контроля не было выявлено.


В ходе проведения теста «Задача распознавания объектов» на 10-е сутки после моделирования патологии было выявлено, что индекс распознавания приоценки кратковременной памяти у крыс, получавших «Мексидол» в дозах 15 мг/кг и 7,5 мг/кг, был достоверно выше по сравнению с группой контроля (p<0,05) (таблица 7). Индекс распознавания при оценке долговременной памяти у крыс был достоверно выше в группе, получавшей «Мексидол» в дозе 15 мг/кг, относительно контрольной группы (p<0,05).

Заключение: В эксперименте было выявлено, что препарат «Мексидол» в дозе 15 мг/кг обладает церебропротективным действием на модели бактериального пневмококкового менингита, что подтверждается данными летальности, степенью неврологического дефицита, показателями удельной силы, поведенческой активности, индексами распознавания кратковременной и долговременной памяти.





















Список литературы