Морфофункциональные изменения сетчатки при моделировании глаукомного процесса у крыс
Aннотация
Актуальность: Современным перспективным направлением фармакотерапии поражений сетчатки при глаукоме является нейро- или ретинопротекция, что определяет актуальность создания адекватных экстраполируемых на заболевание у человека моделей патологии для доклинических испытаний соответствующих препаратов. Цель исследования:Определение морфофункциональных изменений в сетчатке у крыс при использовании одного из способов моделирования глаукомного процесса длительным введением гиалуроновой кислоты (ГК) в переднюю камеру глаза. Материалы и методы:Исследование выполнено на двух равных (по 10 особей) группах белых лабораторных крыс: контрольной и экспериментальной. В экспериментальной моделировали хроническое повышение внутриглазного давления (ВГД) еженедельным введением в переднюю камеру глаза 25 мкл 1% раствора ГК в течение 10 недель. Определяли уровень внутриглазного давления (ВГД), электроретинографические характеристики сетчатки. Проведено ее гистологическое исследование с компьютерной морфометрией. Результаты:Веление ГК в переднюю камеру глаза уже в раннем периоде приводит к достоверному повышению ВГД до 23,6±1,33 мм рт. ст., которое стойко удерживается на протяжении 10 недель. Электроретинография демонстрирует развитие дисфункции как фоторецепторых, так и ассоциативных нейронов сетчатки в виде достоверного снижения амплитуды а- и в- волн. Морфологические изменения свидетельствуют о развитии характерных для глаукомного поражения изменений нейральных слоев с гибелью ганглионарных нейронов, атрофией слоя нервных волокон. При этом отсутствуют нарушения микроциркуляции в той степени, которая может несомненно свидетельствовать об ишемической природе нейрональной гибели. Последнюю можно связать с двумя другими механизмами: с прямым действием повышенного ИГД, либо с механизмом эксайтотоксичности, что требует отдельного исследования. Сохранившиеся нейроны проявляют признаки компенсаторной реакции с гипертрофией перикарионов, что вероятнее является проявлением их дендритной пластичности. Заключение:Использованная модель воспроизводит характерные для глаукомы морфофункциональные изменения сетчатки и является адекватной для воспроизведения гипертензионного компонента патогенеза данного заболевания.
Введение. Глаукома является одной из основных причин необратимой потери зрения во многих странах [1, 2]. Хотя длительное изучение природы заболевания привело к формированию трех дополняющих друг друга теорий этиологии и патогенеза: гидромеханической, сосудистой и метаболической [3, 4, 5] в качестве главного фактора прогрессирующего дегенеративного поражения сетчатки и зрительного нерва с развитием оптической нейропатии, имеющей характерные морфологические и клинические проявления, рассматривается действие длительно повышенного или нетолерантного внутриглазного давления (ВГД).
Основной мишенью действия патологических факторов являются ганглионарные нейроны сетчатки и дендритные ветвления с синаптическими контактами во внутреннем сетчатом слое и эфферентный выход, формируемый аксонами в слое нервных волокон и зрительном нерве, получившие вместе название «комплекс ганглионарных клеток» [6]. В исследованиях новых фармакотерапевтических средств, направленных против повреждений его компонентов новейшей является парадигма нейропротекции, подразумевая меры защиты именно ганглионарных нейронов [7, 8, 9], или ретинопротекции, не ограничиваясь только этой частью сетчатки [10]. В связи с фармакологическими исследованиями на первый план выходит проблема создания модели глаукомного поражения, позволяющей максимально экстраполировать экспериментальные дынные на человека, чему посвящен целый ряд современных аналитических работ [11, 12, 13]. Другим активно изучаемым вопросом являются механизмы гибели ганглионарных нейронов, особенно с учетом противоречиво оцениваемой возможностью ее селективности у морфологически и функционально различных субпопуляций данных клеток [14, 15, 16]. В связи с последними аспектами проблемы нами определена цель данного исследования.
Цель исследования. Определить особенности морфологических и функциональных (электроретинография) изменений сетчатки при моделировании глаукомного процесса у крыс хроническим повышением внутриглазного давления.
Материалы и методы исследования. Исследование выполнено на 20 белых лабораторных крысах-самцах возрастом 3-4 месяца, массой 180-220 г, составивших две равные группы: интактного контроля и экспериментальную. Для создания в экспериментальной группе хронической внутриглазной гипертензии из часто используемых моделей, выполняемых введением в переднюю камеру глаза микросфер [17, 18], конъюнктивальных фибробластов [19], компонентов основного вещества соединительной ткани [20, 21, 22], нами с учетом технических особенностей и возможностей сопоставлений с имеющимися литературными данными выбрана модель с введением в переднюю камеру глаз 25 мкл 1% раствора гиалуроновой кислоты [21, 22]. Введение выполняли под внутрибрюшинным хлоралгидратным (300 мг/кг) наркозом один раз в неделю в течение 10 недель. Регистрацию уровня внутриглазного давления (ВГД) осуществляли тонометром Icare® TONOVET (Финляндия) согласно инструкции.
Электрофизиологическое исследование сетчатки осуществляли по методике, описанной ранее [23]. Животных выводили из эксперимента под наркозом в СО2 камере. Глаза извлекали целиком с прилежащими тканями и фиксировали в 10% растворе формалина в течение 24 часов. Исследовали периферические части сетчатки, для чего после фиксации осторожного удаляли роговицу, разрезали глаза парацентрально в сагиттальной плоскости и обе части заливали в парафин стандартным способом. Гистологические срезы толщиной 7 мкм окрашивали гематоксилином и эозином. Микропрепараты исследовали под микроскопом» «Ломо» с видеокамерой «DV1000». Для морфометрии под максимальным увеличением микроскопа с использованием объектива ×100 и масляной иммерсии с помощью программы «McrA-View 7.3.1.7» (ЛОМО-микросистемы, Россия) получали изображения случайных полей зрения стандартной площади с захватом в их пределах внутреннего сетчатого, ганглионарного слоев и слоя нервных волокон сетчатки. В каждой серии проанализировано не менее 50 изображений. С использованием программы «ImageJ» (NIH, Bethesda, USA) выполняли линейные измерения. Количественную оценку ганглионарного слоя выполняли путем подсчета количества (линейной плотности) клеток на протяжении стандартных участков слоя в полях зрения. Данные регистрировали в электронных таблицах MsExcel 2003, средствами математического и статистического анализа которых осуществляли первичную статистическую обработку. Достоверность различий величин показателей оценивали с помощью онлайн сервиса статистического анализа «medstatistic.ru», используя критерии t Стьюдента и χ2 Пирсона с поправкой Йейтса.
Результаты и их обсуждение. В результате примененного моделирования глаукомного процесса было достигнуто достоверное значимое повышение ВГД до 23,6±1,33 мм рт. ст. (у интактных животных 10,4±0,65 мм рт. ст.; p<0,001). В исследовании-прототипе [21] была достигнута такая же степень повышения давления уже после первой инъекции и на протяжении всего исследования с еженедельными инъекциями его уровень сохранялся на достоверно больших значениях (21,63+ 1 мм рт. ст.). Электрофизиологического и морфологического исследования сетчатки авторы не выполняли. Они выполнены в последующих исследованиях, что мы обсудим дальше.
В результате электроретинографического исследования у экспериментальных животных через 10 недель повышения ВГД нами выявлены признаки дисфункции в наружной(фоторецепторные и биполярные нейроны) части сетчатки в форме достоверного (p<0,05) снижения амплитуды а-волн до 67% (78,0±6,11 µV) от контрольного (116,0±6,70 µV) значения. Амплитуда в-волн достоверно (p<0,05) снизилась до 56% (115,0±8,06 µV) от контрольного значения (206,0±9,57 µV). В представленных в литературе исследованиях с интракамеральным введением гиалуроновой кислоты в аналогичном нашему исследованию объеме [22] и другом исследовании с введением хондроитинсульфата в объеме 20 мкл [20] были получены сходные данные: повышение ВГД с шестой недели эксперимента с прогрессированием до десятой, снижение амплитуд ретинографических волн. Механизм действия гликозаминогликанов авторы связывают не с прямой механической закупоркой трабекулярных структур угла глаза, как это наблюдается в окклюзионных моделях с применением микросфер [17], а с влиянием концентрации гликозаминогликанов с высоким содержанием связывающих воду анионных групп на сопротивление ее транспорту в межклеточном матриксе структур системы склерального синуса.
При морфологическом исследовании материала экспериментальной группы нами обнаружено, что общая структура сетчатки при использованной модели патологии не подвергается значимым изменениям (рис 1). В фоторецепторном слое наблюдались лишь мелкие очаги разрыхления структуры. В наружном и внутреннем ядерном слоях имелись очаги разрежения расположения ядер нейронов за счет отечного расширения межклеточных промежутков.
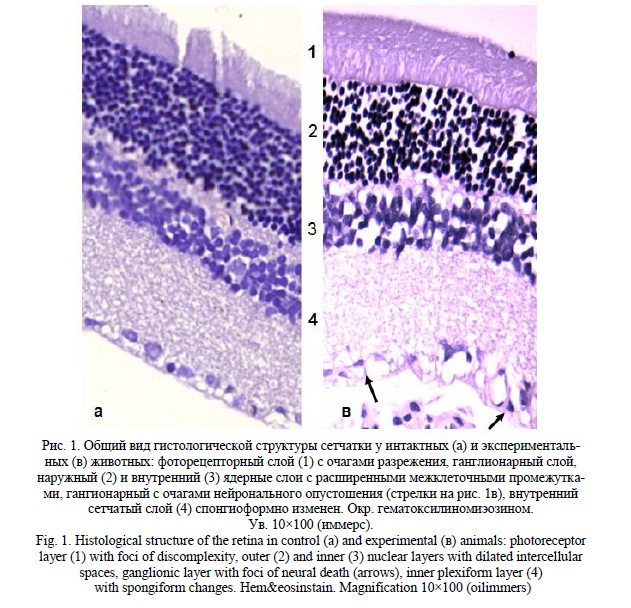
Толщина внутреннего сетчатого слоя уменьшилась только на 10% (116,6+4,3мкм) и достоверно от интактной (128,1+4,7) не отличалась (р=0,07). Однако в структуре его было выражено спонгиоформное разрыхление преимущественно в области внутреннего подслоя на границе с ганглионарным слоем (рис. 2в). Сходный тип изменений выявлен и в слое нервных волокон, который утрачивал сравнительную компактность и четкость контуров, что отразилось и в увеличении толщины на 20% (42,2+3,5мкм), но также без (р=0,2) достоверных отличий от интактного (35,8+3,1) показателя. В имеющихся в литературе морфологических исследованиях в аналогичной примененной нами модели [22] также не было выявлено изменений толщины слоев и сетчатки в целом, но при этом значимым изменениям подвергся ганглионарный слой. В одном из клинических исследований [6] оптическая когерентная томография не выявила четкой зависимости толщины комплекса ганглионарных клеток от внутриглазного давления. Таким образом, толщина внутреннего сетчатого слоя и слоя нервных волокон сами по себе не являются достаточными индикаторами состояния комплекса ганглионарных нейронов. Увеличение толщины внутреннего сетчатого слоя имеет отечную природу и не отражает состояние дендритных ветвлений и синаптических связей ганглионарных нейронов. Об этом свидетельствует и сопоставление с данными других исследований, в которых применены высокоселективные методы идентификации нейронных субпопуляций. В исследовании на модели глаукомы у обезьян [18] установлено, что дегенерация как крупных, так и мелких ганглионарных нейронов начинается с поражения дендритных ветвлений и затем тел нейронов. Как нами указано, заметные спонгиоформные изменения наблюдаются во внутреннем подслое внутреннего сетчатого слоя, то есть месте компактных дендритных ветвлений On-типа. При этом известно, что нейроны с проекцией дендритов в наружный (Off) подслой внутреннего сетчатого слоя изменяются в ранний период повышения ВГД в большей степени, чем нейроны с дендритными ветвлениями On типа [24]. К тому же имеется определенная дендритная пластичность с возможным компенсаторным увеличением On отростков при потере Off ветвлений у бистратифицированных (On-Off) клеток [14]. Полное определение природы изменений компонентов ганглионарного комплекса оказывается возможным при применении методов выявления и оценки структурно-функционального подтипа нейронов и соответствующих синапических полей. Тем не менее, даже рутинные общегистологические методы, использованные и нами, при дополнении количественной оценкой клеточных популяций дают возможность суждения о наличии и степени ипоражения основной мишени глаукомного процесса – ганглионарных нейронов (ГК). В связи с этим внимания заслуживают результаты сравнительного исследования трех моделей глаукомы созданием повышенного ВГД [24]. Авторами исследованы изменения ганглионарного слоя в модели с введением латексных микросфер, микросфер в смеси с метилцеллюлозой и после каутеризации эписклеральных вен. Выявлено, что степень гибели ГК не зависит от типа модели и, более того, одинакова при 13 и 24-х недельной длительности внутриглазной гипертензии, что авторы объяснили наступлением снижения ВГД после 17 недель. Самым интересным в связи с нашим обсуждением является увеличение площадей перикарионов сохранившихся ГК. При этом оно было более выражено в местах наибольших нейрональных потерь. Такие же результаты пятью годами ранее получены в другом исследовании с моделированием глаукомы каутеризацией эписклеральных вен [25]. При этом увеличенные сохранившиеся нейроны не были дегенерирующими, поскольку наблюдалось и увеличение площади синаптических связей.
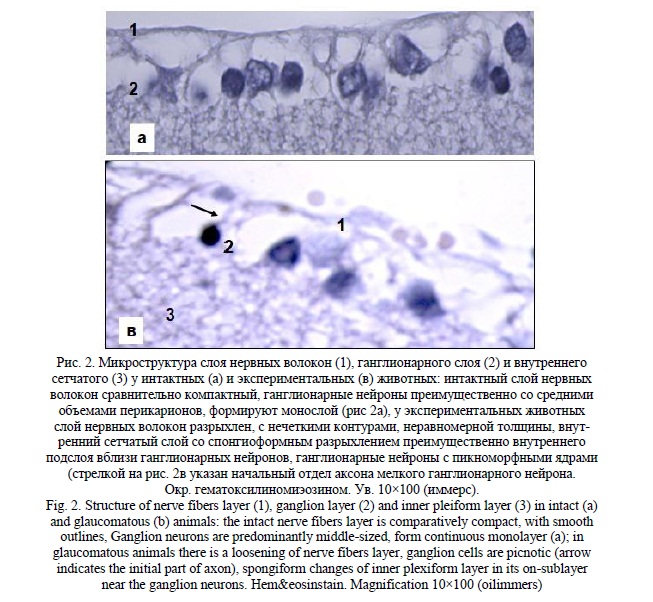
Нами выявлено значительное достоверное (p<0,01) увеличение среднего максимального размера ганглионарных нейронов до 52,9+1,7 мкм (контроль = 10,8+0,7 мкм) с перераспределением количества клеток по размерным классам в виде достоверного преобладания больших клеток и редукции средних размерных групп. При этом, хотя в больших ГК наблюдались признаки дистрофических изменений и ранние гистологические проявления апоптоза (рис. 3), значительная часть клеток была с минимальными изменениями как перикарионов, так и видимых частей отростков.
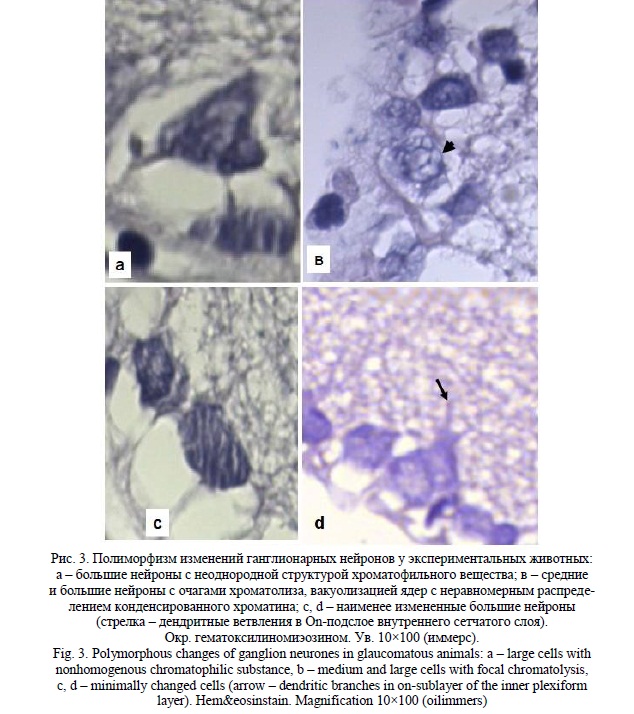
В пределах информативности статичных морфологических картин относительно динамики клеточных изменений мы оцениваем выявленное перераспределение нейронов по размерным классам c редукцией промежуточного следующим образом. С одной стороны, произошел «сдвиг влево», то есть пикноморфные изменения, возможно апоптотической природы, этого класса клеток, составляющие истинный компонент их потерь. С другой стороны, оставшиеся клетки этого класса подвергаются гипертрофии, увеличивая субпопуляцию крупных нейронов и составляя относительный компонент уменьшения численности промежуточных размерных типов. С учетом приведенных выше данных литературы нейрональную гипертрофию можно предположить связанной с компенсаторной реакцией, обеспечивающей дендритную пластичность в претерпевающем видимые изменения внутреннем сетчатом слое, условия для чего создает достаточная длительность эксперимента.
Перед заключением необходимо отметить, что при использованной модели мы не выявили микроциркуляторных изменений в той степени, в которой они могли бы стать объяснением нейрональной гибели в ганглионарном слое. На основании известного [3, 14] остается предполагать фактор нарушения аксоплазматического тока на уровне ламинарной части зрительного нерва вследствие прямого действия внутриглазной гипертензии на решетчатую пластинку, а также механизм эксайтотоксичности, что представляет интерес и актуальность для дальнейшего отдельного исследования.
Заключение. Результаты выполненного исследования свидетельствуют, что при использованной модели с достижением приведенных величин повышения внутриглазного давления в сетчатке развиваются электрофизиологические и морфологические изменения ганглионарных нейронов, соответствующие глаукомной оптической нейропатии. Это делает возможным использование данной модели для воспроизведения одного из ведущих патогенетических механизмов глаукомного процесса – внутриглазной гипертензии, с целью клинически экстраполируемого исследования путей фармакологической коррекции развивающихся изменений и нейропротекции. Значимым и перспективным для дальнейших исследований представляются сосудистый и метаболический (эксайтотоксичность) компоненты патогенеза, а также проявления, механизмы и возможности нейрональной пластичности в естественных и фармакологически корригированных условиях.




















Список литературы