Особенности генного контроля уровня артериального давления у пациенток с гипертензивными расстройствами при беременности
Aннотация
Актуальность: Хроническая артериальная гипертензия и преэклампсия являются мультифакториальной патологией, в развитии которой участвуют многие группы генов в сочетании с негативным средовым влиянием. Цель исследования: Изучить молекулярно-генетические маркеры повышенного риска развития преэклампсии при беременности у пациенток с хронической артериальной гипертензией, позволяющие своевременно сформировать группу риска для профилактики возможных осложнений. Определение неблагоприятных генных полиморфизмов у пациенток с резистентностью к однокомпонентной антигипертензивной терапии обеспечит индивидуальный подход к выбору лечебной тактики. Материалы и методы: Проведено исследование полиморфизма генов, контролирующих тонус сосудистой стенки, методом полимеразной цепной реакции в режиме реального времени у 49 пациенток, беременность которых протекала на фоне хронической артериальной гипертензии, и 42 женщин с хронической артериальной гипертензией и присоединившейся преэклампсией. Результаты: Показано, что у пациенток с хронической артериальной гипертензией и присоединившейся преэклампсией в генотипе достоверно чаще, чем у женщин с хронической артериальной гипертензией без присоединения преэклампсии присутствуют варианты AGT 704C, CYP11B2 C(-344)T, GNB3 825T/Т как по отдельности, так и в совокупности. Заключение: Наличие в генотипе беременной указанных негативных полиморфизмов сочетается с резистентностью к однокомпонентной антигипертензивной терапии, что требует назначения комбинированной схемы лечения у данной категории пациенток для достижения целевого уровня артериального давления.
Ключевые слова: полиморфизм, ген, аллель, беременность, артериальная гипертензия, преэклампсия, антигипертензивная терапия
Введение. Контроль артериального давления в организме человека осуществляется совокупным действием генов многих систем (ренин-ангиотензин-альдостероновой, катехоламиновой и др.) [1-7]. Характерное для каждого генотипа уникальное сочетание определенных аллельных вариантов по данным генам определяет наследственную составляющую в сложном механизме регуляции уровня артериального давления. Подобный тип наследования определяется как полигенный, при котором степень выраженности признака, а именно уровень артериального давления, зависит от суммарного эффекта действия разных аллельных вариантов (полиморфизмов) [8]. Под аллельным полиморфизмом подразумевают некоторые особенности в строении молекулы ДНК, как правило, единичные нуклеотидные замены (single nucleotide polymorphism, SNP), которые не приводят к грубым изменениям белковой молекулы, но, тем не менее, могут определять изменение физико-химических свойств и функциональной активности белковой молекулы, что имеет негативный фенотипический эффект [9]. На сегодняшний день установлено, что при полигенном характере наследования предрасположенности к заболеванию вероятность его развития определяется не только качеством определенных полиморфизмов, но и их количеством в генотипе пациента. Степень риска возникновения мультифакториального заболевания определяется аддитивным действием неблагоприятных аллельных вариантов и условиями среды, в которых реализуется данный генотип [8, 9].
Хроническая артериальная гипертензия (ХАГ) и преэклампсия (ПЭ) являются патологией с наследственной предрасположенностью, развитие которой определяется сочетанным действием неблагоприятного генетического фона у женщины и негативным влиянием факторов внешней среды [2, 3, 9]. Можно предположить, что при определенном сочетании полиморфных вариантов генов в генотипе у индивидуума снижаются адаптивные возможности организма, который становится более уязвимым для действия агрессивных факторов внешней среды. В настоящее время ведется поиск генетических предикторов неэффективности антигипертензивной терапии у пациенток с ХАГ: в ряде работ отмечена высокая частота мутантных аллелей гена рецептора ангиотензина 1-го типа и гена ангиотензинпревращающего фермента (АПФ) у беременных с ХАГ, не достигших целевых уровней артериального давления (АД) [10]. Изучение особенностей генотипа женщины с ХАГ, а также в зависимости от достижения целевого уровня АД сделает возможным формирование группы риска присоединения ПЭ и обеспечит индивидуальный подход к назначению антигипертензивной терапии, что позволит своевременно скоординировать тактику лечебно-профилактических мероприятий в каждом конкретном случае.
Цель исследования. На основании изучения полиморфизма генов, контролирующих тонус сосудистой стенки, у беременных с ХАГ определить молекулярно-генетические предикторы ПЭ и факторы, определяющие резистентность к однокомпонентной антигипертензивной терапии.
Материалы и методы исследования. Исследование выполнялось на базе ФГБУ «Ивановский научно-исследовательский институт материнства и детства имени В.Н. Городкова» МЗ РФ. Были обследованы 91 беременная женщина в сроке 20-36 недель. Согласно МКБ-Х и клиническим рекомендациям «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия» от 2016 г. обследованные пациентки были подразделены на две группы: 1-ю группу составили 49 беременных с ХАГ (шифр по МКБ-Х – О10.0); 2-ю группу – 42 женщины с ХАГ и присоединившейся ПЭ (шифр по МКБ-Х – О11). Обе группы были разделены на 2 подгруппы в зависимости от достижения целевого уровня АД на фоне однокомпонентной или комбинированной антигипертензивной терапии. Методом полимеразной цепной реакции в режиме реального времени было проведено тестирование генов, контролирующих тонус сосудистой стенки (ADD1 G1378T (rs4961), AGT T704C (rs699), AGT C521T (rs4762), AGTR1 A1166C (rs5186), AGTR2 G1675A (rs1403543), CYP11B2 C(-344)T (rs1799998), GNB3 C825T (rs5443), NOS3 T(-786)C (rs2070744), NOS3 G894T (rs1799983)) с использованием набора «Кардиогенетика. Гипертония» («ДНК-технология», Россия). Все обследованные женщины были русскими по национальной принадлежности и проживали в Центральном регионе России (Ивановская, Костромская, Ярославская области). Статистический анализ проводили с помощью программы StatSoft STATISTICA 6.0. Для сравнения показателей использовали критерий χ2. Рассчитывали показатель отношения шансов (OR), приводя 95 % доверительный интервал (95 % CI).
Результаты и их обсуждение. Полученные результаты исследования генных и генотипических частот в генах, контролирующих тонус сосудистой стенки, у женщин с гипертензивными расстройствами при беременности представлены в таблице.
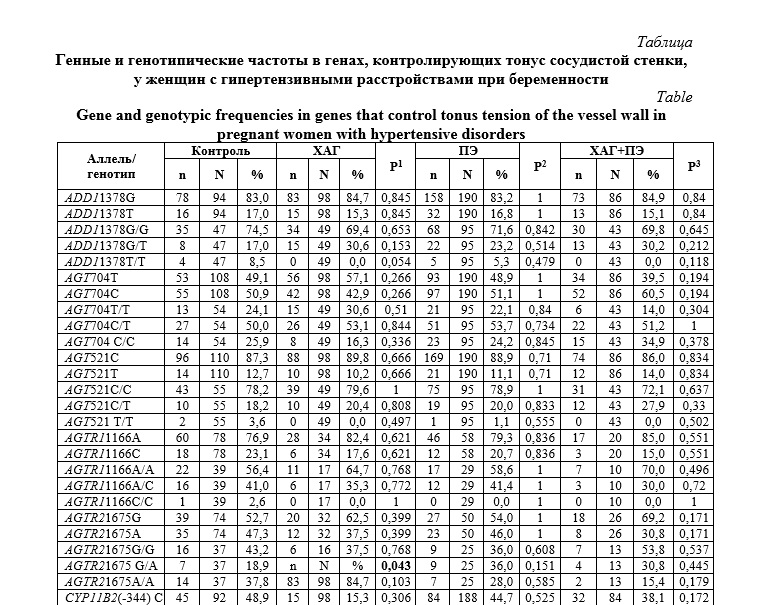

Установлено, что у пациенток с ХАГ и присоединившейся ПЭ достоверно чаще, чем у женщин с ХАГ в генотипе присутствуют негативные полиморфизмы в генах ангиотензиногена AGT 704C, альдостеронсинтазы CYP11B2, гуанинсвязывающего белка в гомозиготном состоянии GNB3 825T/T как по отдельности, так и в сочетании.
Как известно, одной из важнейших систем, участвующих в регуляции уровня АД в организме, является ренин-ангиотензин-альдостероновая система (РААС). Активация компонентов данной системы определяет подъем АД за счет увеличения обьема циркулирующей крови и сосудосуживающего эффекта. Основными компонентами данной системы являются: ангиотензиноген, ренин, ангиотензинпревращающий фермент (АПФ), ангиотензин II и рецепторы двух типов для ангиотензина II. Ангиотензиноген под действием ренина и АПФ преобразуется в ангиотензин II, взаимодействие которого с рецепторами 1-ого типа приводит к сужению сосудов и подъему АД [9, 11-13], взаимодействие ангиотензина II с рецепторами 2-ого типа, напротив, дает сосудорасширяющий эффект [14]. Все компоненты РААС находятся под генным контролем, следовательно, присутствие в генотипе соответствующих полиморфизмов влияет на работу данной системы.
Согласно полученным результатам у пациенток с ХАГ и присоединившейся ПЭ в генотипе достоверно чаще, чем у женщин с ХАГ присутствует полиморфный вариант 704C в гене ангиотензиногена (соответственно в 60,5 и 42,9 %, р=0,03, OR=2,03 (1,13-3,69)). Данный полиморфизм определяет повышенную экспрессию гена AGT, что способствует усиленной продукции ангиотензиногена и развитию гипертензивного эффекта. Наши результаты согласуются с данными литературы, согласно которым частота встречаемости аллеля AGT 704C в европейской популяции составляет 41,0% [15]. В литературе есть указания о повышенной частоте встречаемости негативных полиморфизмов в гене ангиотензиногена у лиц с ХАГ и ПЭ [2, 5, 6, 16-19]. Так, исследования, проведенные в Северо-Западном регионе Российской Федерации, позволили отнести данный вариант к факторам риска развития и ХАГ, и ПЭ [1]. Следует отметить, что в основе развития ХАГ и ПЭ лежат единые генные сети и сходные патогенетические механизмы, поэтому присутствие в генотипах пациенток обеих групп единых негативных полиморфизмов вполне объяснимо. Однако присоединение ПЭ на фоне ХАГ отражает некоторый слом адаптивных механизмов в организме женщины, то есть более негативный фенотип, чем у женщин, беременность которых протекает на фоне ХАГ, но не осложняется развитием ПЭ. Можно предполагать, что за формированием такого тяжелого фенотипического проявления как ХАГ с присоединившейся ПЭ стоит накопление в генотипе пациентки большего количества негативных полиморфизмов в большем проценте случаев. То есть, большая отягощенность генотипа способствует более тяжелому клиническому проявлению патологии.
В генотипе пациенток с ХАГ и присоединившейся ПЭ также достоверно чаще, чем у женщин с ХАГ присутствует негативный аллель в гене альдостеронсинтазы – CYP11B2 (-344)T (соответственно в 61,9 и 42,7 %, р=0,02, OR=2,17 (1,19-3,97)). Альдостеронсинтаза участвует в синтезе альдостерона, принадлежит к суперсемейству цитохрома P450. Альдостерон способствует задержке натрия во внеклеточном пространстве, а вместе с ним и воды. Полиморфизм гена CYP11B2 (-344)T определяет усиление продукции фермента альдостеронсинтазы, а, следовательно, и альдостерона, что приводит к повышенной реабсорбции натрия в почечных канальцах и дает гипертензивный эффект [20]. Кроме того, гиперпродукция альдостерона способствует развитию эндотелиальной дисфункции вследствие усиления экспрессии ингибитора активатора плазминогена-1 [21]. Полученные нами результаты согласуются с данными литературы, согласно которым у лиц европеоидной расы аллель CYP11B2 (-344)T встречается с частотой 45,0% [20]. Сведения о причастности аллеля CYP11B2 (-344)T к развитию гипертензивных осложнений беременности немногочисленны и рассматривают данный полиморфизм как фактор повышенного риска развития ПЭ только в сочетании с другими молекулярно-генетическими и медико-социальными предикторами осложненного течения беременности [22].
Выявлено, что у пациенток с ХАГ и присоединившейся ПЭ достоверно чаще, чем у женщин с ХАГ, в генотипе присутствует аллель GNB3 825Т в гомозиготном состоянии (соответственно в 14,3 и 2,0%, р=0,03, OR=7,8 (1,09-188,8)). Гуанин-связывающие белки (G-белки) экспрессируются во всех клетках организма и играют главную роль в передаче сигналов от множества рецепторов с поверхности клетки. Минорный аллель 825T гена субъединицы бета-3 G-белка (GNB3) связан с образованием варианта белка, обладающего повышенной биологической активностью, приводящей к усиленной сигнальной трансдукции [23, 24].
Полиморфизм C825T гена GNB3 ассоциируется с эндотелиальной дисфункцией [9], однако его связь с ПЭ остается предметом дискуссий [22, 24, 25]. В некоторых ранних работах показано, что вариант GNB3 825Т является фактором риска развития ПЭ независимо от состава исследуемой популяции [24]. Вместе с тем имеются сведения об ассоциации данного полиморфизма с повышенным риском развития ПЭ только в совокупности с действием других негативных аллельных вариантов [25]. В настоящем исследовании была установлена ассоциация между повышенным риском развития ПЭ у пациентки с ХАГ именно с гомозиготным генотипом по указанному негативному аллелю. В группе женщин с ХАГ без ПЭ данный генотип был отмечен лишь в единичном случае, в то время как среди женщин с ХАГ и присоединившейся ПЭ шесть пациенток (14,3%) являлись гомозиготами по аллелю GNB3 825Т.
Как было указано выше, в формировании наследственной предрасположенности к развитию мультифакториальной патологии, к разряду которой относится ХАГ и ПЭ, играет роль не только присутствие в генотипе определенных полиморфизмов, но и сочетанное накопление на генотип негативных аллельных вариантов. Нами были исследованы частоты встречаемости одновременного присутствия в генотипе неблагоприятных полиморфизмов у обследованных женщин. Установлено, что только в группе женщин с ХАГ, беременность которых осложнялась развитием ПЭ, в 14,6% случаев в генотипе определялась комбинация AGT 704C, CYP11B2 (-344)T и GNB3 825Т/Т при отсутствии таковой среди пациенток с ХАГ (соответственно в 14,6 и 0,0%, р=0,03, OR=8,1 (1,13-194,2)). Обращает на себя внимание распределение частот негативных полиморфизмов по указанным локусам у женщин с ХАГ без ПЭ. Для отдельно взятых полиморфных вариантов AGT 704C и CYP11B2 (-344)T генные частоты у пациенток с ХАГ хотя и достоверно ниже, чем у женщин с ХАГ и присоединившейся ПЭ, но демонстрируют высокие значения (соответственно 42,9 и 42,7%), что говорит о широком распространении в генофонде популяции в целом. Гомозиготный генотип по негативному аллелю GNB3 825Т/Т среди женщин с ХАГ отмечен лишь в единичном случае, в то время как комбинация неблагоприятных полиморфизмов не определена ни в одном случае у пациенток с ХАГ.
Нами была проанализирована зависимость достижения целевого уровня АД при однокомпонентной или комбинированной антигипертензивной терапии от особенностей генотипа пациенток по выявленным негативным локусам.
У беременных женщин с ХАГ и присоединившейся ПЭ наиболее часто применялась комбинированная схема антигипертензивной терапии, что было связано с более высокими цифрами среднего АД при поступлении в стационар и затрудняло достижение целевого уровня АД при назначении одного лекарственного средства. Пациентки с ХАГ, напротив, достоверно чаще получали однокомпонентную терапию, однако при отсутствии достижения целевого уровня АД им требовалось назначение комбинированной терапии. Необходимость назначения нескольких антигипертензивных препаратов у женщин с ХАГ сочеталась с присутствием в генотипе женщин аллеля AGT 704C в 75,0% случаев против 35,7% при достижении целевого уровня АД на фоне монотерапии (р=0,02, OR=5,2 (1,17–28,49)). У пациенток с ХАГ и присоединившейся ПЭ необходимость применения комбинированной терапии ассоциировалась с генотипом GNB3 825Т/Т в 30,8% случаев, что было достоверно чаще, чем при достижении целевого уровня АД при приеме одного антигипертензивного средства (3,6%, р=0,04, OR=1,4 (1,12–1,87)). Сочетанное присутствие в генотипе AGT 704C, CYP11B2 (-344)T и GNB3 825T/T было отмечено у 14,6% пациенток с ХАГ и присоединившейся ПЭ, не достигших уровня целевого АД на фоне монотерапии, что потребовало включения в комбинированную схему лечения гипертензивного синдрома препаратов второй линии.
Заключение. Таким образом, генные варианты AGT 704C, CYP11B2 (-344)T и GNB3 825Т/Т, как по отдельности, так и при их сочетании, являются молекулярно-генетическими предикторами повышенного риска присоединения ПЭ у беременных женщин с ХАГ; их определение позволит выделить группу высокого риска развития ПЭ у пациенток с ХАГ и своевременно начать профилактические мероприятия. Наличие в генотипе беременных с ХАГ, в том числе с присоединившейся ПЭ, неблагоприятных полиморфизмов AGT 704C и GNB3 825Т/Т сочетается с резистентностью к однокомпонентной антигипертензивной терапии, их выявление может обеспечить персонифицированный подход к выбору схемы антигипертензивной терапии у данной категории пациенток.





















Список литературы