Связь полиморфизма rs12449964 гене фосфатидил-этаноламин-N-метиленсферазы с развитием гипертриглицеридемии и ожирения у больных сахарным диабетом 2-го типа
Aннотация
Актуальность: Фосфатидилэтаноламин-N-метилтрансфераза (PEMT) – этофермент липидного обмена, катализирующий серию трех последовательных реакций метилирования фосфатидилэтаноламина в фосфатидилхолин. Снижение активности данного процесса приводит к перераспределению субстратов-предшественников фосфолипидов и триглицеридов в пользу синтеза последних и увеличению риска развития ожирения, важнейшего фактора риска сахарного диабета 2 типа (СД2). Цель исследования:Изучить связь полиморфного варианта rs12449964 (C>T) в регуляторном участке гена PEMT с уровнем триглицеридов плазмы крови, а также риском развития ожирения и СД2 у жителей Центральной России. Материалы и методы:В исследование были включены 2060 неродственных индивидов славянского происхождения, из них 1024 пациентов с СД2 и 1036 условно здоровых добровольцев. Генотипирование полиморфизма rs12449964 гена PEMT было выполнено методом времяпролетной масс-спектрометрии на генетическом анализаторе MassArray Analyzer 4 (Agena Bioscience). Для статистического анализа полученных данных использовали программу SNPStats. Результаты:Линейный регрессионный анализ не выявил ассоциации rs12449964 гена PEMT с риском развития СД2 вне зависимости от индекса массы тела (P>0,05). Однако, генотип Т/Т изучаемого SNP связан с повышенным риском развития ожирения у пациентов с СД2 (OR 1,66; 95%CI 1,11-2,46; P=0,011 независимо от пола и возраста. Кроме того, носительство генотипа T/T было сопряжено с более высоким уровнем триацилглицеролов в плазме крови больных СД2, как при наличии ожирения, так и без него (P<0,05). По данным GTEx Portal, аллель rs12449964-T ассоциирован со снижением экспрессии PEMT в различных тканях. Заключение:Впервыеустановлена ассоциация rs12449964 гена PEMT с гипертриглицеридемией и повышенным риском развития ожирения у больных СД2, что может быть обусловлено низкой транскрипционной активностью генафосфатидилэтаноламин-N-метилтрансферазы у носителей альтернативного аллеля изучаемого SNP.
Ключевые слова: сахарный диабет 2 типа, однонуклеотидный полиморфизм, PEMT, триглицериды, генетическая предрасположенность
Введение. Сахарный диабет 2 типа (СД2) – это серьезное хроническое заболевание, характеризующееся гипергликемией и вызванное преимущественной инсулинорезистентностью и относительной инсулиновой недостаточностью или преимущественным дефектом секреции инсулина с инсулинорезистентностью или без нее [1]. По оценке Международной диабетической Федерации (IDF), число больных диабетом в мире за последние 20 лет выросло в 3 раза и на конец 2019 года составляет 463 млн человек [2]. Схожими темпами растет и заболеваемость ожирением, важнейшим фактором риска развития СД2. Согласно данным Всемирной организации здравоохранения, ожирением страдают более 500 млн человек, и еще 1,6 млрд лиц старше 15 лет имеют избыточную массу тела [3]. В Российской Федерации распространенность избыточной массы тела и ожирения составляет 46,5% среди мужчин и 51,7% среди женщин [4], тогда как общее число больных диабетом превышает 8 млн человек и продолжает неуклонно расти [2].
Связь между эпидемиологией ожирения и СД2 с 70-х гг XX века описывают термином «diabesity», подчеркивая таким образом, важное предикторное значение ожирения в развитии СД2. И ожирение, и СД2 являются многофакторными заболеваниями, генетическая основа которых интенсивно изучается. Кандидатные и полногеномные ассоциативные исследования установили сотни общих для этих двух нозологий однонуклеотидных вариантов в генах, ответственных за дисфункцию бета-клеток поджелудочной железы (TCF7L2, KCNJ11, GCKR, SLC30A8, IGF2BP2, HNF1A, HNF1B, HNF4A, PDX1) и инсулинорезистентность (FTO, PPARA, PPARG, IRS1, IRS2, PTEN,UCP2), однако, место абсолютного большинства обнаруженных локусов в патогенезе СД2 неизвестно [5]. Одним из таких вариантов является SNP rs12449964 в регуляторном участке гена фосфатидилэтаноламин-N-метилтрансферазы (PEMT), ассоциированный с повышенным риском развития СД2 [6], ишемической болезни сердца и инсульта [7]. Фермент катализирует трехкратное метилирование атома азота аминогруппы фосфатидилэтаноламина (кефалина) в фосфатидилхолин (лецитин). Этот путь синтеза фосфолипидов связан с синтезом триацилглицеролов (ТАГ), поскольку и нейтральные жиры, и фосфолипиды образуются из общего предшественника, - фосфатидной кислоты. В случае снижения скорости синтеза фосфолипидов из-за недостаточной активности PEMT или дефицита источника метильных групп, S-аденозилметионина, фосфатидная кислота используется для синтеза ТАГ. Следует особо подчеркнуть, что нарушения липидного обмена в виде гипертриглицеридемии являются характерной чертой инсулинорезистентности, присущей как ожирению, так и СД2 [8]. Однако, данные о связи гена PEMT с развитием ожирения, СД2 и гипертриглицеридемии в русской популяции на сегодняшний день отсутствуют.
Цель исследования. Изучение связи полиморфизма гена PEMT (rs12449964, C>T) с уровнем триглицеридов плазмы крови, а также риском развития ожирения и СД2 у жителей Центральной России.
Материалы и методы исследования. Протокол исследования был одобрен Региональным этическим комитетом при КГМУ. В исследование вошли 1024 больных СД2 (367 мужчин и 657 женщин) со средним возрастом 61,1±6,9 лет, находившихся на стационарном лечении в эндокринологическом отделении Курской городской клинической больницы скорой медицинской помощи с ноября 2016 по октябрь 2019 года. Диагноз СД2 устанавливали на основе критериев ВОЗ [9-10]. Группу контроля составили 1036 условно здоровых добровольцев (396 мужчин и 640 женщин) со средним возрастом 60,8±5,7 лет, доноров Областной станции переливания крови, как было описано нами ранее [11-12]. У всех участников исследования на основе письменного информированного согласия проводили забор 5 мл венозной крови натощак в вакуумные пробирки Vacuette с ЭДТА в качестве антикоагулянта. Геномную ДНК выделяли методом фенольно-хлороформной экстракции. Генотипирование полиморфизма гена PEMT (C>T, rs12449964) было с помощью лазерной деcорбционно/ионизационной времяпролетной масс-спектрометрии на платформе MassArray Analyzer 4 (Agena Bioscience). Для проведения биохимических исследований 5 мл крови натощак забирали в вакуумные пробирки с гепарином лития. Концентрации глюкозы, гликированного гемоглобина, триглицеридов, общего холестерина и его подфракций определяли наборами фирмы «Диакон-ДС» на полуавтоматическом биохимическом анализаторе Clima MC-15 (RAL).
Биоинформатический анализ проводили с применением инструментов STRING (https://string-db.org) для визуальной оценки белковых партнеров PEMT; GTEx Portal (https://gtexportal.org) для изучения тканеспецифичной экспрессии гена PEMT; mQTLDatabase (http://www.mqtldb.org) для изучения влияния изучаемого SNP на статус метилирования гена. Статистическую обработку полученных данных проводили с помощью онлайн программы SNPStats (https://www.snpstats.net/start.htm). Тестировали пять генетических моделей: кодоминантную, доминантную, рецессивную, сверхдоминантную и log-аддитивную. Ассоциация считалась значимой при Р<0,05. Для проверки нормальности распределения биохимических показателей использовали критерий Колмогорова-Смирнова. Переменные, имеющие нормальное распределение, были описаны с использованием среднего значения (Mean) и стандартного отклонения (St.Dv.) в виде Mean±St.Dv. В качестве теста статистической значимости использовали тест Стьюдента. Показатели с ненормальным распределением описывали с использованием медианы (Мedian), первого (Q1) и третьего (Q3) квартилей, в виде: Мedian [Q1; Q3]. В качестве теста статистической значимости в таких случаях применяли критерий Манна-Уитни. Обнаруженные отличия групп принимались за статистически значимые при p<0,05.
Результаты и их обсуждение. Клинико-лабораторные показатели участников исследования приведены в таблице 1. Больные СД2 имели значимо более высокий уровень глюкозы натощак, гликированного гемоглобина, ТАГ, общего холестерина и липопротеинов низкой плотности по сравнению со здоровыми лицами (P<0,05). Кроме того, 627 пациентов (61,2%) имели ИМТ≥30 кг/м2, что классифицируется как ожирение. В группе контроля этот показатель составил 12,6% (131 человек).
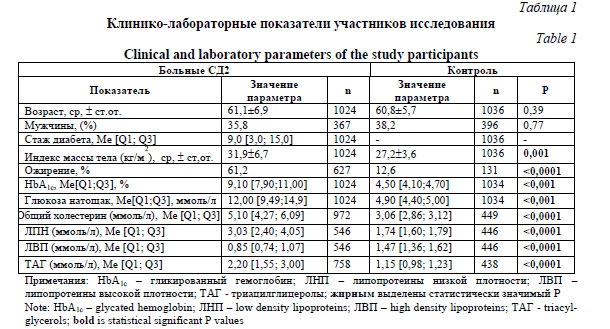
Исследованный SNP находился в соответствии с равновесием Харди-Вайнберга (Р>0,05). Частоты аллелей изучаемого SNP гена PEMT были сопоставимы с европейскими популяциями согласно данным проекта «1000 Genomes», депонированных в Ensembl (https://www.ensembl.org). В таблице 2 представлены данные по частотам аллелей и генотипов PEMT у здоровых лиц и больных СД2. Линейный регрессионный анализ не выявил ассоциации rs12449964 гена PEMT с риском развития СД2. Стратифицированный анализ по ИМТ также не обнаружил ассоциации изучаемого варианта с риском СД2 ни среди лиц с с ожирением (ИМТ≥30 кг/м2), ни среди лиц без него (ИМТ<30).
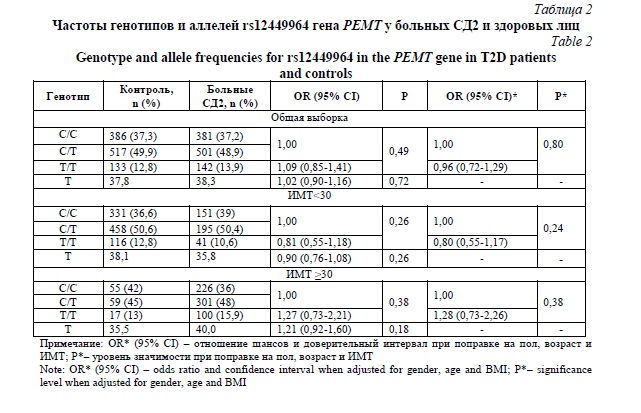
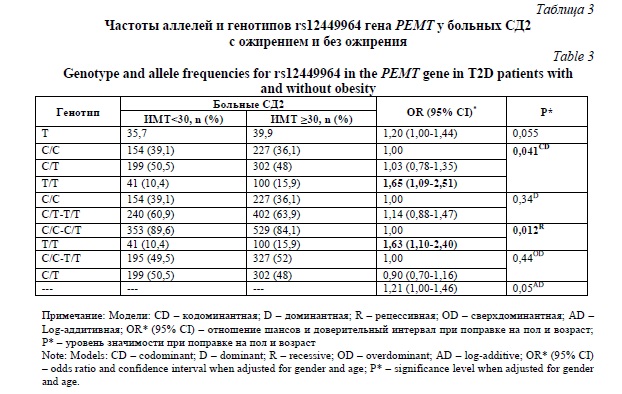
В таблице 3 представлены результаты анализа ассоциаций rs12449964 с риском развития ожирения у пациентов с СД2. Как оказалось, генотип rs12449964-Т/Т связан с повышенным риском развития ожирения у больных СД2 (OR 1,66; 95%CI 1,11-2,46; P=0,011, рецессивная модель).
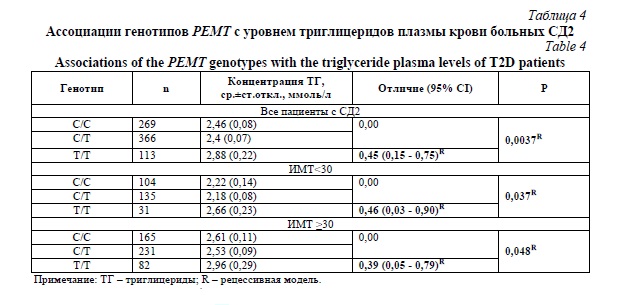
Кроме того, при анализе взаимосвязей между генотипами PEMT и биохимическими показателями углеводного и липидного обмена больных СД2 было обнаружено, что носительство генотипа rs12449964-T/T сопряжено с более высоким уровнем триацилглицеролов в плазме крови, как при наличии ожирения, так и без него (P<0,05, таблица 4).
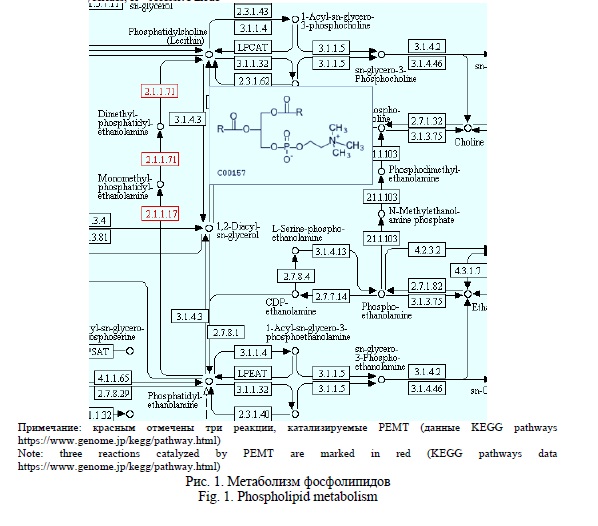
С помощью ресурса KEGG Pathways стала возможной идентификация фермента фосфатидилэтаноламин-N-метилтрансферазы (2.1.1.71) на метаболической карте липидного обмена (рис. 1). Фермент катализирует три реакции метилирования, последовательно превращая фосфатидилэтаноламин (кефалин) сначала в моно-, затем в ди-, и, наконец, в триметилфосфатидилэтаноламин (фосфатидилхолин, или лецитин).
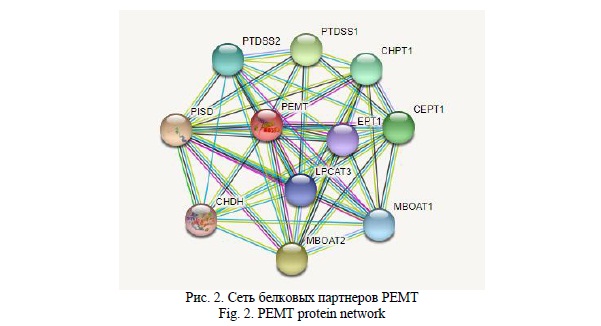
Функциональные партнеры PEMT (данные STRING) формируют интерактомную сеть из 10 белков, 4 из которых обеспечивают синтез лецитина (холин-этаноламинфосфотрансфераза 1, CEPT1; холинфосфотрансфераза 1, CHPT1; лизофосфолипидацилтрансфераза 5, LPCAT3 и холиндегидрогеназа, CHDH), 3 белка катализируют образование кефалина (фосфатидилсериндекарбоксилаза, PISD; этаноламинфосфотрансфераза 1, EPT1; лизофосфолипидацетилтрансфераза 2, MBOAT2), и еще 3 функциональных партнера PEMT вовлечены в синтез фосфатидилхолина (лизофосфолипидацетилтрансфераза 1, MBOAT1; фосфатидилсеринсинтаза 1, PTDSS1; фосфатидилсеринсинтаза 2, PTDSS2).
Настоящее исследование выявило взаимосвязь полиморфного локуса rs12449964 в регуляторном участке гена PEMT с повышенным риском развития ожирения у больных СД2, демонстрируя тем самым потенциальную вовлеченность гена фосфатидилэтаноламин-N-метилтрансферазы в патогенез заболевания. В литературе есть единичные исследования роли PEMT в формировании предрасположенности к ишемической болезни сердца, ишемическому инсульту [7], острому панкреатиту [13, 14] и обсессивно-компульсивному синдрому [15]. Также описаны ассоциации loss-of-function вариантов PEMT с уровнем ТАГ плазмы крови (rs11656215) [16] и отношением объема талии к объему бедер: rs4646404 [17], rs9944423 [18]. Изучаемый SNP также оказался ассоциированным с риском СД2 в когорте UK Biobank, включающей 19860 больных СД2 и 432404 здоровых лиц [6]. Тем не менее, ассоциация rs12449964 c риском СД2 не была подтверждена в настоящей работе.
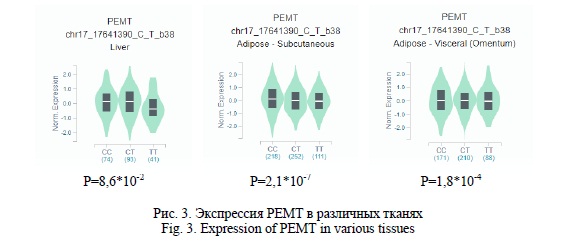
Согласно экспериментальным данным GTEx Portal, аллель rs12449964T ассоциирован со снижением экспрессии PEMT в печени, висцеральной и подкожной жировой ткани, наиболее активно синтезирующих ТАГ и ФЛ по сравнению с другими клетками (рис. 3).
Кроме того, оценка эффектов rs12449964 на статус метилирования генов (mQTL) показала, что альтернативный аллель T связан с гиперметилированием PEMT, а значит, со снижением экспрессии этого гена в детском и взрослом возрасте. Уменьшение активности синтеза лецитина, самого распространенного фосфолипида, может приводить к перераспределению пула фосфатидной кислоты, – общего субстрата для синтеза фосфолипидов и ТАГ, в пользу образования последних, способствуя таким образом, накоплению в клетках нейтральных жиров, и увеличению массы тела. В данной работе впервые показана взаимосвязь между генотипом rs12449964-T/T и более высоким содержанием ТАГ в плазме крови больных СД2 всех весовых категорий. Следует отметить, что увеличение концентрации ТАГ, особенно в сочетании со снижением уровня липопротеинов высокой плотности, считается маркером инсулинорезистентности [8, 19]. Так, в десятилетнем проспективном исследовании A. Tirosh [20] было показано, что увеличение содержания ТАГ в плазме крови от низкого до высокого тертиля в течение 5 лет увеличивает риск развития СД2 в 12 раз независимо от индекса массы тела (ИМТ) участников исследования. Циркулирующие в крови ТАГ служат потенциальным источником свободных жирных кислот, ухудшающих чувствительность периферических тканей к инсулину и замыкающих порочный круг между гипертриглицеридемией и инсулинорезистентностью, составляющей патогенетический фундамент СД2 [21, 22]. Повышение уровня ТАГ и свободных жирных кислот активирует апоптоз бета-клеток поджелудочной железы, снижая их функциональную массу, – эффект липотоксичности, который в сочетании с глюкозотоксичностью способствует поражению различных органов и систем, в первую очередь, глаз, почек, сосудов и нервов нижних конечностей [1].
Заключение. Таким образом, проведенное исследование обнаружило ассоциацию rs12449964 гена PEMT с гипертриглицеридемией и повышенным риском развития ожирения у больных СД2, что может быть обусловлено низкой транскрипционной активностью гена фосфатидилэтаноламин-N-метилтрансферазы у носителей альтернативного аллеля Т изучаемого однонуклеотидного полиморфизма. Полученные результаты также свидетельствуют о том, что сахарный диабет, diabetes mellitus, главным диагностическим критерием которого по-прежнему служит хроническая гипергликемия, серьезно поражает не только углеводный, но и липидный обмен, и может по праву называться diabetes mellipidus.
Информация о финансировании
Исследование выполнено за счет гранта Российского научного фонда (проект № 20-15-00227).
Благодарности
Автор выражает благодарность своему учителю, научному руководителю профессору Алексею Валерьевичу Полоникову за критическое прочтение рукописи, а также младшему научному сотруднику НИИ генетической и молекулярной эпидемиологии Елене Юрьевне Клёсовой за помощь в проведении лабораторной части работы





















Список литературы