Микробиом влагалища при нарушениях менструального цикла (обзор)
Aннотация
Актуальность: В последние два десятилетия, благодаря использованию некультуральных методов исследования, накоплены новые данные об особенностях микробиома женских половых путей. Однако, причины, определяющие преобладание тех или иных микроорганизмов и формирование типа микробиома, окончательно не определены. Наибольшие изменения влагалищного микробиома происходят в ответ на гормональные влияния. Цель исследования: Оценить роль нарушений менструального цикла в формировании микробиома влагалища. Материалы и методы: Выполнен обзор литературы, посвященный роли нарушений менструального цикла в формировании влагалищного микробиома, по данным публикаций в базах данных EBSCO, Pubmed, Scopus, Google Academy, ResearchGate, Elibrary за последние 20 лет. Результаты: Представлены данные о роли микробиома человека в патогенезе соматических заболеваний. Даны основные характеристики влагалищного микробиома, представлена его классификация, описаны основные функции Lactobacillus spp. в женском репродуктивном тракте и их влияние на местную иммунореактивность. Описаны особенности влагалищного микробиома в течение нормального менструального цикла и у пациенток с его нарушениями. Заключение: Несмотря на критическую значимость микробиома женских половых путей для репродукции человека, данные о роли нарушений менструального цикла в формировании микробиома являются единичными и посвящены в основном исследованию влагалищного микробиома при синдроме поликистозных яичников (СПКЯ). Данные о роли гиперпролактинемии, врожденной дисфункции коры надпочечников и других причин нарушений менструального цикла в формировании влагалищного микробиома в литературе отсутствуют. Это диктует необходимость дальнейших исследований микробима у пациенток с нарушениями менструального цикла различного генеза, а также разработки методов коррекции выявленных нарушений.
Ключевые слова: микробиом влагалища, менструальный цикл, нарушения менструального цикла, синдром поликистозных яичников (СПКЯ), лактобактерии, гарднерелла, микоплазма, превотелла, Толл-подобные рецепторы (TLR)
Введение. Микробиом человека вызывает повышенный интерес исследователей в течение последних лет из-за его тесной взаимосвязи со здоровьем. Большинство исследований микробиома сосредоточено на изучении бактерий, населяющих пищеварительную систему человека. Микробиом человека чрезвычайно разнообразен, со значительными вариациями его компонентов у разных людей [1]. Было показано, что корректирование микробиома с помощью экзогенных влияний, таких как фекальная трансплантация или диета, потенциально может служить терапевтическим подходом к решению ряда проблем, связанных со здоровьем [2].
Наиболее изучен микробиом кишечника. Желудочно-кишечный тракт содержит огромное разнообразие микроорганизмов, которые взаимодействуют по принципу «микроб-микроб» и «микроб-хозяин» [3]. Большинство бактерий в нормальных физиологических условиях являются комменсалами и участвуют в процессах пищеварения, укрепляют иммунную систему и подавляют или предотвращают проникновение патогенных микроорганизмов в организм человека. Связь между микробиомом человека и его здоровьем остается малоизученной. В то же время, ряд эпидемиологических исследований показал, что общее сокращение разнообразия микробиоты связано с такими заболеваниями, как астма [4], экзема [5-7], поливалентная аллергия [8], диабет и ожирение [9-11], воспалительные заболевания кишечника и синдром раздраженного кишечника [12, 13]. Есть данные, что дисбактериоз кишечника способствует развитию синдрома хронической усталости [14], а также тревоги и депрессии [15-17]. Микробиом играет роль в регуляции различных иммунных реакций [18], оказывает влияние на метаболизм, токсичность ксенобиотиков и фармакокинетику лекарственных препаратов [19].
Подобно кишечнику, женское влагалище также содержит большое количество микроорганизмов, которые составляют вагинальный микробиом [20]. Lactobacillus spp. являются одной из главенствующих бактерий, колонизирующих здоровое влагалище [21]. Однако микробиом женских половых путей изучен гораздо меньше, чем микробиом желудочно-кишечного тракта, несмотря на его критическую значимость для репродукции человека. Спектр факторов, влияющих на влагалищный микробиом, также окончательно не определен. Это препятствует пониманию его роли в патогенезе целого спектра гинекологических и акушерских заболеваний и разработке мер их лечения и профилактики.
Антиинфекционная защита женских половых путей.
Антиинфекционная защита женских половых путей в последние годы стала объектом пристального изучения в связи c продолжающимся ростом частоты воспалительных заболеваний органов малого таза [22]. Клиническая значимость этих состояний обусловлена их прямым влиянием не только на здоровье женщин, но и на их будущее потомство. Они увеличивают риск развития бесплодия, невынашивания, преждевременных родов, хорионамнионита, неонатальных инфекций (включая внутриутробную пневмонию, менингит и менингоэнцефалит), а также послеродовых гнойно-септических осложнений у родильниц (включая перитонит, сепсис и бактериально-токсический шок) [23-28]. Пациентки c нарушениями микробиоценоза половых путей входят в группу риска по развитию послеабортных и послеоперационных осложнений [29, 30].
Увеличение частоты воспалительных заболеваний репродуктивного тракта происходит не только за счет инфекций, передаваемых половым путем, но и из-за роста числа дисбиозов, возникающих под воздействием эндо- и экзогенных влияний [31].
Применение некультуральных методов исследования микробиоценоза женских половых путей в течение двух последних десятилетий позволило значительно продвинуться в его изучении. Так, высокопроизводительное секвенирование 16S рРНК позволило выявить микроорганизмы, которые ранее не идентифицировались во влагалище традиционными культуральными методами (Sneathia, Atopobium, Dialister и др.). Было установлено, что эти микроорганизмы играют важную роль в патогенезе ряда акушерских осложнений [32, 33].
Биоценоз женских половых путей представляет собой экологическую нишу, которая включает в себя эпителиальный барьер, секрет эпителиальных желез, иммунокомпетентные клетки и специфическую микрофлору, которая формируется под влиянием ряда экзо- и эндогенных факторов [34].
При исследовании влагалищного микробиома методом высокопроизводительного секвенирования 16S рРНК было выделено пять типов вагинальных сообществ на основании преобладания одного из видов лактобацилл или их отсутствия (рисунок 1): Lactobacillus crispatus (CST-I), L. gasseri (CST-II), L. iners (CST-III), L. jensenii (CST-V), а также CST-IV, состоящий преимущественно из облигатных и факультативных анаэробов без преобладания лактобактерий [35, 36]. Было показано, что CST-IV встречается у 25% женщин в общей популяции [35]. Несмотря на то, что большинство из этих женщин не имели клинических симптомов дисбиоза, была выявлена взаимосвязь между наличием данного типа микробиоценоза и вероятностью заражения половыми инфекциями [37] и ВИЧ [38,39], а также развитием бесплодия, невынашивания, преждевременных родов, внутриутробного инфицирования [40]. Данный тип микробиоценоза также ассоциирован с неудачами имплантации после экстракорпорального оплодотворения (ЭКО) [41]. Бактерия L. iners, которая является основным микроорганизмом III типа микробиоценоза, имеет факторы патогенности, отсутствующие у других видов лактобактерий [42], а наличие данного типа микробиоценоза ассоциированно c высоких риском хламидийной инфекции [43] и рядом акушерских осложнений [44].
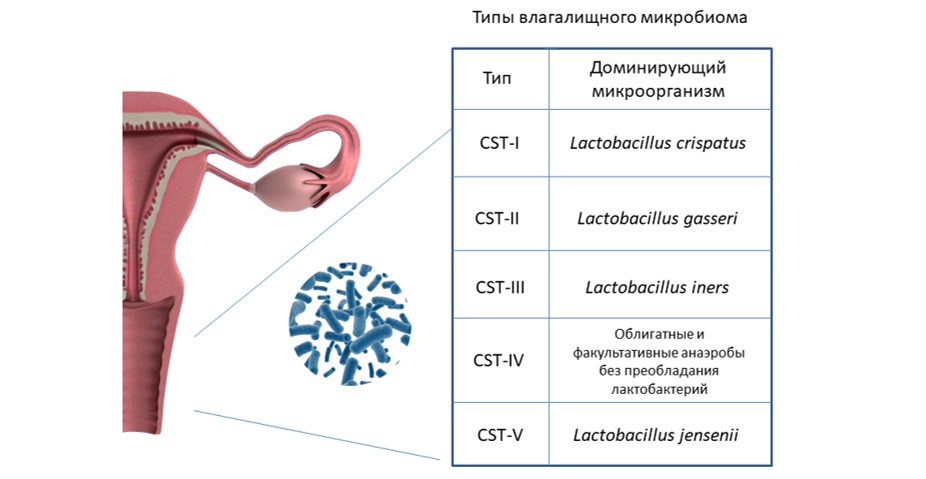
Рис. 1. Классификация типов влагалищного микробиома.
Fig. 1. Classification of vaginal community state types (CSTs).
Известно, что в норме наиболее значимые изменения микробиоценоза и местной иммунореактивности женского репродуктивного тракта происходят в ответ на гормональные влияния в течение менструального цикла [45-47]. Изменения влагалищного микробиома наблюдаются до наступления менархе, в постменопаузе, а также при использовании гормональных контрацептивов [48-52]. Поэтому нарушения менструального цикла являются ключевыми факторами, способными воздействовать на влагалищный микробиоценоз.
Роль лактобактерий в женском репродуктивном тракте.
Согласно J. Ravel et al. (2011), наиболее благоприятными типами влагалищного микробиоценоза являются такие, в которых преобладают лактобактерии [35]. Они обеспечивают колонизационную резистентность, конкурируя с патогенными микроорганизмами за адгезию к эпителиоцитам влагалища [53]. Кроме того, выделяя молочную кислоту, они способствуют снижению pH влагалища, что, свою очередь, также препятствует размножению патогенных бактерий [54]. Лактобактерии также способны выделять перекись водорода, обладающую прямым антибактериальным действием [55]. Лактобактерии обладают иммуномодулирующим действием, способствуя увеличению выработки секреторного иммуноглобулина А (sIgA), лизоцима, гассерицина и комплемента [53, 56-58]. Было показано, что преобладание во влагалищном микробиоме L. crispatus и L. jensenii характеризуется снижением уровней провоспалительных цитокинов [59].
Известно, что лактобактерии способны регулировать интенсивность иммунного ответа, опосредованную Толл-подобными рецепторами (Toll-like receptors, TLRs). Толл-подобные рецепторы – это сигнальные рецепторы, расположенные преимущественно на клетках системы врожденного (неспецифического) иммунитета и первыми распознающие патогены при их попадании в женский репродуктивный тракт [60, 61]. В экспериментах in vitro было показано, что L. crispatus способна снижать выработку провоспалительных цитокинов, индуцированную стимуляцией TLR3 и TLR2/6 соответствующими вирусными и бактериальными лигандами [62].
Основными условиями для нормальной персистенции лактобактерий в женском репродуктивном тракте являются наличие кислого рН и достаточное количество гликогена [55]. Кроме того, важно наличие анаэробной среды, так как лактобактерии являются факультативно-анаэробными микроорганизмами.
Лактобактерии ферментируют углеводы до жирных кислот, тем самым поддерживая низкий рН во влагалище [55]. Поэтому содержание гликогена в эпителиоцитах критически важно для их жизнедеятельности. Известно, что эстрогены способны увеличивать продукцию гликогена [63, 64], а прогестерон – снижать ее [64, 65]. Поэтому состав влагалищного микробиома может меняться в течение менструального цикла.
Физиологические изменения микробиома влагалища в течение менструального цикла.
Мета-анализ, выполненный H. Kaur et al. (2020) [66] и включавший в себя данные 5 крупных исследований микробиома женского репродуктивного тракта (суммарно около 1000 образцов) [35, 48, 67-69], позволяет сделать вывод, что влагалищный микробиом подвержен значительным изменениям в течение менструального цикла.
Так, во время менструации (фаза десквамации) преобладают микроорганизмы типов Fusobacteria, Proteobacteria, Bacteroidetes и Actinobacteria. В фолликулярную фазу количество вышеуказанных микроорганизмов снижается, начинают превалировать микроорганизмы типа Firmicutes, в том числе лактобактерии [66].
S.D. Song et al. (2020) также выявили снижение доли Lactobacillus spp. во время менструации, что сопровождалось одновременным увеличением бактерий родов Streptococcus spp.,Peptostreptococcus spp., и Anaerococcus spp. Доля лактобактерий в микробиоме на протяжении менструального цикла имела положительную корреляционную связь с уровнем эстрадиола [45].
Микробиом во время менструации также отличается большим альфа-разнообразием (внутригрупповым разнообразием микробиоты) по сравнению с фолликулярной фазой менструального цикла и коррелирует с одновременным снижением доли лактобактерий [36, 45, 66].
Такие изменения микробиома объясняются тем, что менструальная кровь повышает рН влагалища, что приводит к увеличению количества анаэробов, которые в небольшом количестве постоянно находятся в нижних отделах женских половых путей [70]. Интересно, что при повышении pH молочная кислота теряет свое бактерицидное действие [71]. Кроме того, менструальная кровь является питательной средой для многих видов микроорганизмов [72]. После менструации pH влагалища снижается, и количество лактобактерий увеличивается. Это приводит к снижению количества других анаэробных микроорганизмов [31].
Микробиом влагалища и нарушения менструального цикла.
Нами был проведен анализ публикаций по теме исследования в базах данных EBSCO, Pubmed, Scopus, Google Academy, ResearchGate,, Elibrary за последние 20 лет.
Было установлено, что, несмотря на увеличение частоты нарушений менструального цикла, исследования об их влиянии на влагалищный микробиом являются единичными.
Одной из самых распространенных причин нарушений овариально-менструального цикла является синдром поликистозных яичников (СПКЯ). Его частота у женщин репродуктивного возраста составляет около 10% [73].
У женщин c СПКЯ хорошо описаны особенности микробиома ротовой полости и кишечника [74-79]. Однако работы, посвященные особенностям влагалищного микробиома при СПКЯ, являются единичными.
Так, X. Hong et al. (2020) исследовали влагалищный микробиом 39 пациенток с СПКЯ и 40 женщин с нормальным менструальным циклом. Диагноз СПКЯ был выставлен на основании Роттердамских критериев [80]. В работе оценивали уровень свободного тестостерона. Уровень глюкозы крови, инсулин, индекс инсулинорезистентности HOMA-IR в данном исследовании не определяли.
Было установлено, что альфа-разнообразие (внутригрупповое разнообразие микробиоты) у пациенток с СПКЯ было достоверно выше, чем в контроле. У женщин с СПКЯ относительное количество лактобактерий было достоверно ниже, а относительное количество бактерий родов Mycoplasma и Prevotella – достоверно выше, чем в контроле.
Авторы считают микоплазму потенциальным биомаркером СПКЯ. Так, если относительное количество микоплазм в микробиоме превышает 0,02%, у пациентки с высокой долей вероятности может быть выявлен СПКЯ. Чувствительность этого метода составляет 100%, специфичность – 72,5%, положительная прогностическая ценность – 78%.
Похожая закономерность была выявлена для L. сrispatus и Prevotella spp. В случае, если относительное количество L. crispatus составляет менее 13%, а Prevotella spp. более 0,25%, у пациентки с высокой долей вероятности может быть диагностирован СПКЯ.
Интересно, что степень чистоты влагалища достоверно не коррелировала с результатами 16S рРНК секвенирования и достоверно не отличалась у пациенток обеих групп. Это позволяет сделать вывод, что исследование микробиома методом 16S рРНК секвенирования является более информативным, чем бактериоскопическое исследование. Кроме того, 16S рРНК секвенирование позволяет дифференцировать различные виды лактобактерий, которые обладают неодинаковыми протективными свойствами (например, L. crispatus и L. iners).
В работе Y. Tu et al. (2020) были изучены особенности микробиома влагалища и цервикального канала у 47 пациенток с СПКЯ и 50 здоровых женщин репродуктивного возраста [81]. Диагноз СПКЯ был установлен на основании Роттердамских критериев [80]. Все пациенткам определяли уровень свободного тестостерона. В статье нет указания на то, что у пациенток определяли уровни других гормонов в крови.
Было установлено, что род Lactobacillus преобладал и в цервикальном канале, и во влагалище как у женщин с СПКЯ, так и в группе контроля. Состав цервикального и влагалищного микробиома в образцах каждой из пациенток не отличался между собой. Авторы не выявили достоверных различий в альфа- и бета-разнообразии микробиомов влагалища и цервикального канала у пациенток основной и контрольной группы.
Однако у пациенток с нормальным менструальным циклом доля лактобактерий во влагалищном и цервикальном микробиоме составила более 90%, в то время как у 30% женщин с СПКЯ во влагалищном микробиоме концентрация лактобактерий была менее 50%.
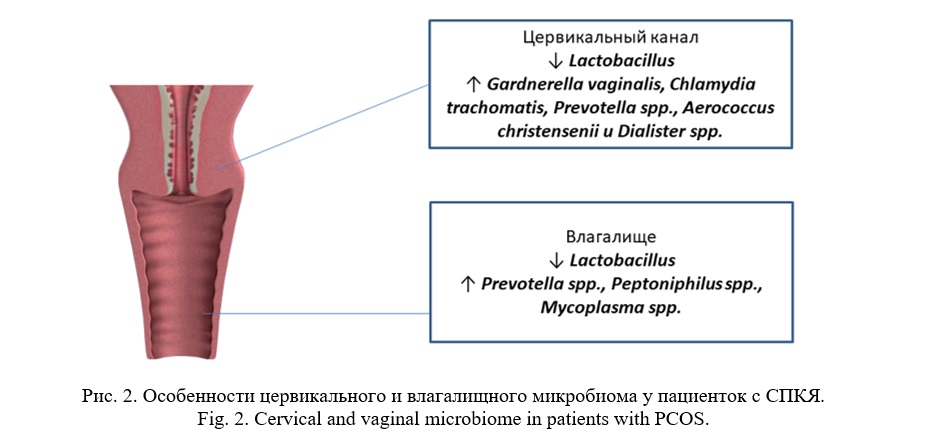
Было установлено, что количество бактерий рода Lactobacillus в цервикальном канале и во влагалище у пациенток с СПКЯ было достоверно ниже, чем в группе контроля. В то же время в цервикальном микробиоме пациенток с СПКЯ количество Gardnerella vaginalis, Chlamydia trachomatis, Prevotella spp., Aerococcus christensenii и Dialister spp. было выше, чем в группе контроля. Во влагалищном микробиоме у пациенток с СПКЯ достоверно чаще, чем в контроле, выявляли Prevotella spp., Peptoniphilus spp., Mycoplasma hominis.
Была также проанализирована взаимосвязь особенностей микробиома и клинико-анамнестических данных (менструального цикла, количества беременностей в анамнезе, индекса массы тела, уровня тестостерона, наличия воспалительных заболеваний органов малого таза в анамнезе). Было установлено, что особенности микробиома нижних отделов половых путей имели достоверную корреляционную связь с длительностью менструального цикла и наличием бактериального вагиноза в анамнезе.
Изменения цервикального и влагалищного микробиома у пациенток с СПКЯ представлены на рисунке 2.
Также представляет интерес исследование J. Zhang et al. (2019), в котором авторы выявили влияние кишечной микробиоты на секрецию половых гормонов у пациенток с СПКЯ [82]. В работе был исследован микробиом кишечника у 38 пациенток с СПКЯ и 26 здоровых женщин того же возраста. У здоровых женщин достоверно чаще преобладали микроорганизмы родов Faecalibacterium, Lachnospira, Bifidobacterium и Blautia, а у пациенток с СПКЯ – бактерии родов Parabacteroides, Bacteroides, Lactobacillus, Oscillibacter, Escherichia/Shigella и Clostridium. У 14 пациенток с СПКЯ была проведена коррекция кишечного микробиома с помощью пробиотика, содержащего Bifidobacterium lactis V9 в количестве 106 КОЕ/мл, который они принимали 1 раз в день в течение 10 недель. У 9 пациенток произошло достоверное снижение уровня лютеинизирующего гормона (ЛГ) и соотношения лютеинизирующего гомона к фолликулостимулирующему гормону (ЛГ/ФСГ) по сравнению с началом лечения. У 5 пациенток никаких достоверных изменений уровней ЛГ и ФСГ не наблюдалось. Было установлено, что у пациенток, которые откликнулись на терапию пробиотиком, в кишечнике наблюдалось увеличение количества бактерий родов Bifidobacterium, Faecalibacterium, Butyricimonas и Akkermansia, а также снижение Collinsella, Coprococcus, Klebsiella, Clostridium, Actinomyces, Streptococcus, Eubacterium и Ochrobactrum по сравнению с их количеством до начала лечения. У пациенток, которые не откликнулись на терапию пробиотиком, выраженных изменений микрофлоры не наблюдалось.
Однако аналогичных исследований с применением интравагинальных пробиотиков и оценкой их влияния на секрецию половых гормонов не проводилось.
Также в литературе отсутствуют исследования особенностей влагалищного микробиома у пациенток с гиперпролактинемией, врожденной дисфункцией коры надпочечников (ВДКН), психогенной аменореей, заболеваниями щитовидной железы, болезнью Кушинга и Аддисона, которые также могут приводить к нарушениям менструального цикла.
Заключение. Таким образом, исследования влияния нарушений менструального цикла на микробиом влагалища являются единичными. В основном они касаются только СПКЯ. Однако, недостатком данных работ является то, что у пациенток не определялось наличие инсулинорезистентности, хотя известно, что патогенез СПКЯ у пациенток с инсулинорезистентностью и без нее различен. Следует подчеркнуть, что индекс массы тела не является обязательным маркером наличия или отсутствия инсулинорезистентности [83], поэтому для их выявления необходима оценка уровней глюкозы, инсулина и индекса инсулинорезистентности HOMA-IR. Кроме того, для дифференциальной диагностики с другими состояниями необходимо определение уровней пролактина, 17-ОН-прогестерона, кортизола, ДГА-S и ряда других гормонов, что не было выполнено в вышеуказанных работах. Также следует подчеркнуть, что общий тестостерон не всегда отражает наличие гиперандрогении, поэтому в клинической практике чаще используется определение индекса свободного тестостерона на основании определения общего тестостерона и глобулина, связывающего половые гормоны. В вышеуказанных работах этого сделано не было.
Известно, что нарушения микробиома приводят к целому ряду репродуктивных осложнений [84-88]. По-видимому, дисбиотические состояния, вызванные нарушениями менструального цикла, в случае возникновения беременности могут оказывать влияние на ее течение и исход.
Все это диктует необходимость дальнейших исследований микробима у пациенток с нарушениями менструального цикла различного генеза, а также разработки методов коррекции выявленных нарушений. Полученные данные могут быть использованы для улучшения репродуктивных исходов.
Информация о финансировании
Работа выполнена при поддержке гранта Президента РФ МД-2326.2017.7.





















Список литературы